溝葉結縷草遺傳轉化體系的建立
王凱 汪毅 曲愛愛 王蕊 郭海林 李曉慧 佘建明 宗俊勤 李建建 劉建秀


摘? 要:為構建有效的溝葉結縷草遺傳轉化體系,以溝葉結縷草愈傷組織為受體材料,通過農桿菌介導法將筆者單位克隆的耐鹽相關基因ZmPDI基因轉入野生型植株中,研究共培養時間、侵染液濃度、侵染時間和抗生素濃度等因子對轉化效率的影響。結果表明:最佳遺傳轉化體系為菌株OD600值為0.4,侵染30 min,共培養3 d后進行選擇培養。特美汀在選擇培養階段最適抑菌濃度為250 mg/L,潮霉素愈傷組織篩選的最適選擇壓力為40 mg/L,苗篩的最適濃度為15 mg/L。通過GUS活性的組織化學分析和PCR鑒定,顯示目的基因已成功轉入溝葉結縷草基因組中。
關鍵詞:溝葉結縷草;蛋白二硫鍵異構酶(PDI);根癌農桿菌;遺傳轉化
中圖分類號:S688.4? ? ? 文獻標識碼:A
Abstract: Zoysia matrella is a perennial warm-season turfgrass, one of halophytes with the salt-tolerantce, and is widely used in temperate zone and subtropical regions. However, its complete genetic transformation system have not been reported. In this study, the callus from Z. matrella was used as receptor material and the genetic transformation of the salt-tolerant gene ZmPDI was carried out by Agrobacterium-mediated method to study a series of conditions for transformation efficiency including the co-culture time, concentration of the infection, and infection time. The results showed that the optimal genetic transformation was supposed to be: agrobacterium concentration OD600 = 0.4, infected for 30 minutes, co-cultured for 3 days and then followed by selective culture. During the whole process, the optimum concentration of timentin in the postponed culture medium was 250 mg/L. As for hygromycin, the optimal selection pressure for callus was 40 mg/L, while the best concentration for rooting screening was 15 mg/L. The histochemical analysis of β-glucuronidase (GUS) activities and PCR identification indicated that the ZmPDI gene was transferred into the genome by hygromycin resistance selection.
Keywords: Zoysia matrella; PDI; Agrobacterium tumefaciens; genetic transformation
DOI: 10.3969/j.issn.1000-2561.2020.08.009
溝葉結縷草(Zoysia matrella)是禾本科(Gramineae)畫眉草亞科(Choridoideae)結縷草屬的多年生暖季型草坪草,同時也是鹽生植物,廣泛分布于溫帶亞熱帶。隨著生物技術的飛速發展,轉基因技術已經成熟,可以對特定的靶基因進行遺傳轉化以縮短育種周期。在植物轉基因方法中,農桿菌介導的方法因其高轉化效率,易于使用和低成本而成為優選的方法。迄今為止,這種方法在結縷草屬中也已經成功。據報道,Kang等[1]將Zjchi2基因導入結縷草胚性愈傷組織中,得到了轉基因植株;馬彩云[2]利用農桿菌介導法將DREB基因轉入青島結縷草;代小梅[3]將ZjGA20ox基因轉入日本結縷草;Li等[4]將CBF1基因轉入中華結縷草。然而,目前,有關溝葉結縷草遺傳轉化的研究報道極少,僅見于溝葉結縷草抗草甘膦遺傳轉化初步研究中,以溝葉結縷草愈傷組織為試驗材料,經農桿菌侵染后,在含有2、3、5 mmol/L草甘膦的篩選培養基上各4周,再生16周,共得到54粒愈傷組織出現綠色小苗,但其再生苗尚未鑒定,所以遺傳轉化體系并不完整[5]。
蛋白二硫鍵異構酶(protein disufide isomerase,PDI)屬硫氧還蛋白亞家族成員,是內質網中一種重要的折疊催化劑,能通過氧化活性(催化蛋白形成二硫鍵)和異構酶活性(催化錯誤配對二硫鍵的重排)來改變蛋白內部結構進而促進蛋白的正確折疊[6]。研究發現水稻中PDI基因的功能缺失表現出粉狀胚乳的特征[7-8];在擬南芥中PDI家族一個成員AtPDI6突變能夠誘導葉綠體中D1蛋白的合成,從而緩解了強光脅迫下的光抑制現象[9]。然而,在結縷草中關于PDI的研究很少。僅在本單位的前期工作中,使用鹽脅迫處理下的溝葉結縷草作為材料構建了全長cDNA表達文庫,轉化酵母細胞后經耐鹽篩選獲得了一個編碼蛋白二硫鍵異構酶基因ZmPDI(NCBI登錄號:KM265179)。鹽脅迫下溝葉結縷草中ZmPDI的表達顯著上調[10]。ZmPDI基因如何調控溝葉結縷草耐鹽性,其機制尚不清楚。
為了闡明ZmPDI基因對溝葉結縷草耐鹽性的分子調控機制,本研究以溝葉結縷草愈傷組織為外植體材料,利用農桿菌介導法將ZmPDI基因導入溝葉結縷草基因組中,探究菌株濃度、侵染時間和共培養時間等因素對農桿菌介導的溝葉結縷草轉基因效率的影響,以期建立農桿菌介導的溝葉結縷草遺傳轉化體系,為溝葉結縷草的包括ZmPDI基因在內的基因功能和分子育種研究奠定基礎。
1? 材料與方法
1.1? 材料
1.1.1? 植物材料與載體菌株? 植物材料為溝葉結縷草匍匐莖誘導的愈傷組織,根癌農桿菌為EHA105(Agrobacterium tumefaciens),載體質粒為pCAMBIA1305.2(含GUS報告基因及潮霉素Hyg篩選標記)。
1.1.2? 生化試劑及酶? 預混型DNA聚合酶Premix Taq? Version 2.0(TaKaRa公司);DNA分子量標準DNA adder Marker(TaKaRa公司);質粒提取試劑盒AxyPrepTM Pasmid Miniprep Kit(天根生化科技有限公司);新型廣譜植物基因組DNA快速提取試劑盒(北京原平皓生物技術有限公司);特美汀Timentin、卡那霉素Kan、利福平Rif、潮霉素Hyg、乙酰丁香酮(AS)(北京索萊寶科技有限公司);GUS染色試劑盒(北京華越洋生物科技有限公司);引物合成及測序均由通用生物系統(安徽)有限公司完成;常規化學藥品及試劑均為國產AR級分析純。
1.1.3? 培養基的配制? 試驗用基本培養基成分見表1。
1.2? 方法
1.2.1? 試驗材料誘導、繼代和預培養? 由溝葉結縷草匍匐莖誘導產生愈傷組織,其誘導和繼代培養參照Chai等[11]的方法進行。轉化前,材料在繼代培養基上培養1周。
1.2.2? 抑菌劑濃度和抗生素篩選壓的確定? 抑菌劑特美汀(Timentin)濃度確定:參照Zhang等[12]的方法并加以調整,將經農桿菌菌株侵染30 min的愈傷組織,分別放置于含Timentin的愈傷組織繼代培養基上,設6個試驗梯度,分別為0、100、150、200、250、300 mg/L,每梯度設3個重復,30 d后記錄數據,確定最佳抑菌劑濃度。
潮霉素(Hyg)篩選濃度的確定:參照Wu等[13]的方法并加以調整,首先進行預試驗,將溝葉結縷草愈傷組織放置于繼代培養基(含Hyg)上生長,設5個試驗梯度0、20、30、40、50 mg/L,處理25 d后移至分化培養基,30 d后記錄數據,確定愈傷組織初篩濃度。將分化苗放置于生根培養基(含Hyg),設5個試驗梯度0、5、10、15、20 mg/L,20 d后記錄數據,確定分化苗初篩濃度。接下來對經農桿菌侵染后的溝葉結縷草愈傷組織進行上述操作(培養基均含有Timentin),確定潮霉素最佳篩選濃度。
統計外植體分化率和成苗率,以上每梯度重復3次。
分化率=完成分化愈傷組織數/總愈傷組織數× 100%;成苗率=分化苗數/總苗數×100%。
1.2.3? 轉化條件的探索? 探索最優的轉化條件時,參照代小梅[3]的方法并加以調整。
菌株濃度的確定:浸染外植體時,菌株濃度(OD600)分別是0.2、0.4、0.6、0.8。
菌株侵染時間的選擇:浸染外植體時,侵染時間為10、20、30、40 min。
共培養時間的確定:浸染外植體時,共培養時間設為1、2、3、4 d。
根據GUS活性的組織化學分析結果記錄藍色愈傷組織數,每梯度重復3次。
轉化率=GUS染色藍色愈傷組織數/愈傷組織總數×100%
1.2.4? 農桿菌介導的溝葉結縷草愈傷組織遺傳轉化? 將放置于80 ℃的菌株(含有50%甘油)在室溫下解凍后[14],在YEP固體培養基(含50 mg/L Kana和50 mg/L Rif)劃板培養,培養條件為28 ℃,48 h,挑取單克隆接種于5 mL YEP+ 50 mg/L Kana+50 mg/L Rif液體培養基震蕩培養,培養溫度為28 ℃,200~220 r/min震蕩20~24 h,取上述培養的菌株800~1000 μL,加入到25 mL含YEP+50 mg/L Kana+50 mg/L Rif液體培養基中,28 ℃,220 r/min培養5~6 h,待菌株OD600為0.5左右時,取25 mL放入50 mL管中,室溫下4000 r/min,離心10 min。棄上清,再向離心管加入侵染液將菌株調至OD600為0.4(約109個/ mL),加入100 μmol/mL AS用于侵染。
參考張麗[5]、張芳等[15]的方法,對轉化過程加以改進。將預培養的愈傷組織放置于菌液(菌株OD600為0.4)浸染30 min,(25±2)℃,暗處理3 d。共培養后先轉入含250 mg/L Timentin和40 mg/L Hyg篩選培養基培養20 d。之后在光照條件下轉入含250 mg/L Timentin分化培養基上生長。切取長至3 cm左右的幼苗,轉入含250 mg/L Timentin和15 mg/L Hyg苗篩選培養基培養20 d,將得到抗性苗經煉苗栽入花盆移至戶外生長(以上培養基見表1)。
1.2.5? 抗性植株的PCR檢測和GUS活性分析? 取抗性苗及未轉化再生苗的葉片,使用DNA快速提取試劑盒提取植株葉片DNA。通過PCR擴增HPT基因,序列為:HPT-F:5-GAAAAAGCCT GAACTCACCGC-3;HPT-R:5-TGCTCCATAC AAGCCAACCAC-3;預期片段大小為729 bp。模板是轉化苗葉片DNA,陽性對照是質粒PcamBIA1305.2,陰性對照是正常再生苗葉片DNA。擴增體系為:12.5 μL Premix Taq,1 μL DNA模板,HPT-F和HPT-R(20 μmol/L)各1 μL,去離子水補足25 μL。擴增條件為:98 ℃預變性3 min;98 ℃變性30 s,56 ℃退火30 s,72 ℃延伸1 min,35個循環;72 ℃延伸10 min。
取侵染后的愈傷組織放入配好的GUS染色工作液中,用錫箔紙包裹,在37 ℃孵育24 h,用70%乙醇脫色6 h,在顯微鏡下觀察愈傷組織著色情況。
1.3? 數據處理
所有數據均用Microsoft Office Excel 2016進行處理,采用SPSS軟件(v22.0)進行方差分析。
2? 結果與分析
2.1? 轉化條件對轉化效率的影響
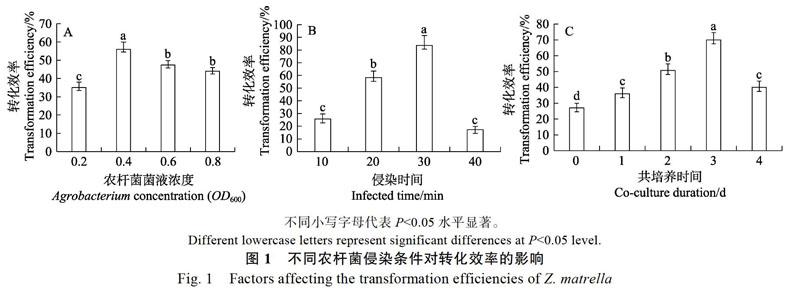
從圖1A可以看出,外植體的轉化效率隨著農桿菌株濃度的增加表現出先升后降的情況。當OD600為0.4時,轉化效率達到頂峰,為56%;當OD600為0.6~0.8時,轉化效率均低于50%,這是因為農桿菌過度生長導致愈傷組織出現大量褐化死亡,進而導致轉化效率降低。所以,選用OD600為0.4作為侵染液菌株最適濃度。
從圖1B可以看出,轉化效率隨著菌株浸染時間的增加表現出先升后降的現象。當浸染時間為30 min時,轉化效率達到峰值,為83.7%,是浸染10 min時的3.3倍;而浸染40 min時的轉化效率不及30 min時的四分之一,這可能是菌株過多包裹于材料上,導致愈傷組織不能生長,進而轉化率下降。所以,最佳的農桿菌浸染時間選擇為30 min。
的增加表現出先升后降的趨勢,當共培養時間為3 d時,轉化效率為70%,達到最高;而4 d時的轉化效率僅為3 d時的一半,這可能是菌株量過多,對受體材料存在嚴重損害,從而影響后期愈傷組織生長。所以,最佳的共培養時間選擇為3 d。
2.2? 特美汀抑菌濃度的確定
如圖2所示,隨著抑菌劑Timentin濃度的增加,其抑菌表現力變得越來越明顯。盡管300 mg/L Timentin能抑制全部菌株生長,但此時的愈傷分化率還沒有250 mg/L Timentin的一半;而200 mg/L Timentin雖有59.7%的愈傷分化率,但其抑菌效果不佳。為了達到既有效控制菌株的快速增殖又不降低愈傷分化率,因此選用250 mg/L Timentin抑制菌株大規模繁殖。
2.3? 潮霉素篩選濃度的確定
由圖3可見,無論轉化材料是否經過農桿菌侵染,隨著潮霉素濃度的升高,其成苗率及分化苗的存活率均逐步下降。當濃度分別為50 mg/L(圖3A、圖3C)和20 mg/L(圖3B、圖3D)時,觀察到經過農桿菌侵染的材料出現大面積褐化及其分化苗枯死情況,這說明它的分化過程與幼苗生長過程均受到嚴重抑制。而濃度分別為40 mg/L和15 mg/L時,其成苗率為6.3%,幼苗存活率為6.3%。這既能篩選掉絕大部分假陽性材料,又保證有一定的存活率。因此在愈傷階段選擇40 mg/L Hyg,在苗篩階段選擇15 mg/L Hyg。
2.4? 轉基因植株的鑒定
2.4.1? 轉化材料GUS檢測? 根據上述轉化方法,經歷從最開始預處理的外植體到最終出現陽性苗的過程,獲得可能的轉基因植株(圖4)。對不同過程的材料使用GUS活性的組織化學分析,發現經菌株侵染的愈傷組織和兩次篩選得到的陽性苗在GUS染色后呈藍色(圖5),說明GUS基因已成功在愈傷組織、植株和葉片中穩定表達。
2.4.2? 轉化材料PCR檢測? 對轉化后的再生苗進行分子水平上的PCR檢測。從18株再生苗中隨機選擇5株,提取其葉片DNA,并進行PCR反應看是否可以擴增出HPT基因。結果表明,5株均能擴增出729 bp的目的片段(圖6),而野生型對照組(-)則未能擴增出目的條帶。這結果進一步說明目的基因已成功地整合到溝葉結縷草的基因組中。
3? 討論與結論
當前,利用農桿菌作為媒介進行轉基因是構建草坪草轉化體系的常用手段,并已在海濱雀稗(Paspalum vaginatum)[13]、黑麥草(Lolium perenne)[14]、假儉草(Eremochloa ophiuroides)[15]、匍匐剪股穎(Agrostis stolonifera)[16]、早熟禾(Poa annua)[17]、日本結縷草(Zoysia japonica)[18]、中華結縷草(Zoysia sinica Hance)[19]和細葉結縷草(Zoysia tenuifolia Willd. ex Trin.)[20]等草坪植物中獲得成功。溝葉結縷草(Zoysia matrella)是鹽生植物,廣泛分布于溫帶亞熱帶。然而,其遺傳轉化體系鮮見研究,嚴重影響了其優異基因發掘和分子育種研究,因此建立其遺傳轉化體系已經迫在眉睫。本試驗以溝葉結縷草匍匐莖誘導產生的愈傷組織作為試驗材料,報告基因為GUS基因,第一次利用農桿菌介導法將本單位克隆的耐鹽相關基因ZmPDI基因轉入野生型植株中,探索適合溝葉結縷草轉化的條件,經潮霉素篩選后得到的抗性苗,通過PCR檢測和GUS活性的組織化學分析表明其為陽性。這為溝葉結縷草的基因轉化奠定了堅實基礎,同時也為其在分子育種方面提供了新思路。
3.1? 轉化條件的選擇
農桿菌介導的轉化過程是極為精密而繁瑣的,多種因素決定其轉化能否成功,包括菌株濃度的高低、侵染時間和共培養時間的長短等,從而導致在轉化率上存在很大差異。在草坪草的遺傳轉化中菌株濃度選擇范圍、侵染時間段和共培養用時范圍均有所區別,其中結縷草中為OD600= 0.4~0.6,15~30 min,2~4 d[18, 21];黑麥草中為OD650= 0.8,20 min,3 d[13, 22];早熟禾中為OD650=0.6,9 min,2~4 d[12],本實驗結果發現,工作菌濃度OD600為0.4,菌株侵染30 min,3 d共培養是最適合溝葉結縷草的。菌液工作濃度過高過低都導致侵染失效,侵染時間和共培養時間過長會對愈傷組織形成永久性損傷引發褐化現象,也會增加抑菌的難度。過短導致侵染效果不佳,出現大量假陽性再生苗進而延長試驗周期。
3.2? 抑菌劑(Timentin)濃度的確定
為了達到既保證菌株可以有效侵染轉化材料,又要防止菌株過快增殖導致轉化失敗的目的,因此抑菌劑的種類也是決定轉化能否成功的重要因素之一。在農桿菌介導的草坪草植物轉基因過程中,抑菌劑選擇范圍包括頭孢霉素、羧芐青霉素和特美汀三類,在結縷草和匍匐剪股穎遺傳轉化研究中頭孢霉素選擇300~500 mg/L[1-3, 23];在假儉草中頭孢霉素選擇200~400 mg/L[15, 24];在結縷草中羧芐青霉素選擇250~1000 mg/L[18];在結縷草和黑麥草中特美汀選擇200 mg/L[5, 12],本試驗對比抑制農桿菌生長的結果發現特美汀比頭孢霉素效果明顯,雖然使用500 mg/L Cef在愈傷組織篩選階段能有效抑制菌株繁殖,但再生階段時常發現菌株出現爆發式生長。而250 mg/L Timentin即能控制其快速生長,同時也能保證轉化材料的正常分化。因此選用250 mg/L Timentin抑制菌株過度增殖。
3.3? 篩選劑潮霉素濃度的確定
潮霉素是禾本科植物中以農桿菌作為媒介進行遺傳轉化常用的篩選劑之一,潮霉素濃度過高或過低均不利于遺傳轉化試驗的順利實施,在已報道的多年生黑麥草遺傳轉化研究中,采用潮霉素濃度選擇25~80 mg/L[12, 14];在農桿菌介導的結縷草遺傳轉化研究中,篩選濃度在愈傷組織生長期間多選擇45~75 mg/L,在再生苗生長階段選擇20 mg/L[18, 21]。本試驗分別在愈傷分化期和再生苗生長期進行潮霉素梯度試驗(用量范圍為0~50 mg/L),發現不管轉化材料是否經過農桿菌侵染,隨著濃度用量不斷加大,其分化率及分化苗的存活率均逐步下降。在預試驗中隨著用量不斷加大,愈傷分化率從73%下降至3.6%;再生苗的成苗率從81.7%降至5.3%;而經農桿菌侵染過的愈傷組織的分化率及其再生苗的成苗率下降更加明顯,分別從57%降至0%和從66.7%降至0.3%。這其中當濃度分別為50 mg/L和20 mg/L時,觀察到經過農桿菌侵染的愈傷組織出現大面積褐化情況及其分化苗因超負荷篩選而枯死,這說明它的分化過程與幼苗生長過程均受到嚴重抑制。而濃度選擇40 mg/L和15 mg/L時,其成苗率為6.3%,幼苗存活率為6.3%。這既能篩選掉絕大部分假陽性材料,又保證有一定的存活率。因此對于潮霉素采用間隔性二篩法,其中在愈傷階段選擇40 mg/L Hyg,在苗篩階段選擇15 mg/L Hyg。
參考文獻
Kang J N, Park M Y, Kim W N, et al. Resistance of transgenic zoysiagrass overexpressing the zoysiagrass class II chitinase gene Zjchi2 against Rhizoctonia solani AG2-2 (IV) [J]. Plant Biotechnology Reports, 2017, 11(4): 229-238.
馬彩云. 結縷草組織培養再生體系建立及轉BdDREB2基因的研究[D]. 阿拉爾: 塔里木大學, 2010.
代小梅. 日本結縷草(Zoysia japonica Steud.)ZjGA20ox基因表達模式及RNA干擾載體遺傳轉化體系研究[D]. 北京: 北京林業大學, 2013.
Li R F, Wei J H, Wang H Z, et al. Development of highly regenerable callus lines and Agrobacterium-mediated transformation of Chinese lawn grass (Zoysia sinica Hance) with a cold inducible transcription factor, CBF1[J]. Plant Cell Tissue and Organ Culture, 2006, 85(3): 297-305.
張? 麗. 溝葉結縷草抗稀禾定體細胞無性系變異篩選和抗草甘膦遺傳轉化初步研究[D]. 杭州: 浙江大學, 2013.
劉光快, 曹珍珍, 韋克蘇, 等. 水稻蛋白二硫鍵異構酶基因沉默載體構建及其轉基因后代的高溫結實特性分析[J]. 作物學報, 2013, 39(5): 816-826.
Han X H, Wang Y H, Liu X, et al. The failure to express a protein disulphide isomerase-like protein results in a floury endosperm and an endoplasmic reticulum stress response in rice[J]. Journal of Experimental Botany, 2012, 63(1): 121-130.
Zhu C, Luo N, He M, et al. Molecular characterization and expression profiling of the protein disulfide isomerase gene family in Brachypodium distachyon L.[J]. PLoS One, 2014, 9(4): e94704.
Wittenberg G, Levitan A, Klein T, et al. Knockdown of the Arabidopsis thaliana chloroplast protein disulfide isomerase 6 results in reduced levels of photoinhibition and increased D1 synthesis in high light[J]. The Plant Journal, 2014, 78(6): 1003-1013.
Chen Y, Zong J Q, Tan Z Q, et al. Systematic mining of salt-tolerant genes in halophyte-Zoysia matrella through cDNA expression library screening[J]. Plant Physiology and Biochemistry, 2015, 89: 44-52.
Chai M L, Jia Y F, Chen S, et al. Callus induction plant regeneration and long-term maintenance of embryogenic cultures in Zoysia matrella (L.) Merr[J]. Plant Cell Tissue and Organ Culture, 2011, 104(2): 187-192.
Zhang K W, Wang J, Hu X R, et al. Agrobacterium- mediated transformation of shoot apices of Kentucky bluegrass (Poa pratensis L.) and production of transgenic plants carrying abetA gene[J]. Plant Cell Tissue and Organ Culture, 2010, 102(2): 135-143.
Wu X L, Shi H F, Chen X W, et al. Establishment of Agrobacterium-mediated transformation of seashore paspalum (Paspalum vaginatum O. Swartz)[J]. In Vitro Cellular & Developmental Biology Plant, 2018, 54(5): 545-552.
Esmaeili S, Salehi H, Khosh K M, et al. Isopentenyl transferase (IPT) gene transfer to perennial ryegrass through sonication-assisted Agrobacterium-mediated transformation (SAAT), vacuum and heat treatment[J]. Molecular Biotechnology, 2019, 61(5): 332-344.
張? 芳, 王? 舟, 宗俊勤, 等. 農桿菌介導的假儉草遺傳轉化體系的建立[J]. 草業學報, 2011, 20(2): 184-192.
安惠惠, 馬暉玲, 李? 堅, 等. 農桿菌介導的Lyz-GFP基因對匍匐翦股穎Penn A-1轉化和表達的研究[J]. 草業學報, 2012, 21(2): 141-148.
任玉靜, 甘? 露, 蘇浩天, 等. 農桿菌介導的草地早熟禾轉基因的研究[C]//2018中國草學會年會論文集, 2018: 470-474.
劉? 莉. 日本結縷草IPT基因遺傳轉化及野牛草實生群體內遺傳多樣性研究[D]. 武漢: 華中農業大學, 2010.
Lei J L, Wang D, Wu Y M, et al. Establishment of genetic transformation system of Chinese zoysia (Zoysia sinica) mediated by Agrobacterium tumefaciens soaked seeds[J]. Journal of Agricultural Biotechnology, 2009(5): 865-871.
Li M R, Li H Q, Hu X Y, et al. An Agrobacterium tumefaciens-mediated transformation system using callus of Zoysia tenuifolia Willd. ex Trin [J]. Plant Cell Tissue and Organ Culture, 2010, 102(3): 321-327.
Ge Y X, Norton T, Wang Z Y, Transgenic zoysiagrass (Zoysia japonica) plants obtained by Agrobacterium- medi ated transformation[J]. Plant Cell Reports, 2006, 25(8): 792-798.
Bales, Carmille J C. Agrobacterium-mediated transformation of perennial ryegrass (Lolium perenne L.) for cold tolerance[J]. Masters Abstracts International, 2010(49): 67.
Han Y J, Kim Y M, Lee J Y, et al. Production of purple-colored creeping bentgrass using maize transcription factor genes Pl and Lc through Agrobacterium-mediated transformation[J]. Plant Cell Reports, 2009, 28(3): 397-406.
Liu M X, Lu S Y, Liu L, et al. Agrobacterium-mediated transformation of centipede grass (Eremochloa ophiuroides [Munro] Hack.)[J]. Plant Cell, Tissue and Organ Culture, 2012, 109(3): 557-563.

