文件管理系統DMS在集團化醫藥企業的規劃和應用
過明祺 邵揚
摘 要 醫藥工業企業的GMP文件普遍是以紙質形式保存,隨著歷史版本的文件越來越多,人工管理出現很多問題從而帶來合規性風險。本文闡述了從集團層面,如何推動下屬醫藥企業共同參與,集中部署一套經過計算機化系統驗證的文件管理系統,以及集中部署的優勢及意義。
關鍵詞 文件管理系統;集中部署;計算機化系統驗證;集團型醫藥企業
引言
(1)制藥企業文件管理水平參差不齊:上海醫藥的集團化工業體系由三個層級、30個生產企業、50個生產基地組成。每個藥品生產企業與GMP相關的文件包括:生產工藝、質量標準、管理類文件、操作類文件、各類記錄等,單個企業與質量相關文件超過3000個。原先采用紙質及人工管理出現很多問題,海量文件存儲占用空間,造成文件管理困難、版本混亂、易出錯、易遺失、查找緩慢、效率低下、無法協作共享、審批過程不受控、安全性缺乏保障等一系列弊端,難以滿足GMP合規和管理的要求。有部分生產企業已嘗試使用一些信息化軟件來支持相關的藥品生產和質量管理,但集團發現各個企業的成效并不相同,有的子公司對質量管理理解程度比較高,做得就相對比較全面,在接受監管檢查的時候,這樣的子公司能夠對答如流,滿足監管的相關要求。但有的企業相對來說水平會差一些,就不能完全符合監管要求。如果能統一用一套符合行業高標準的系統來管理,就能確保相應子公司能夠高水平、高質量地應對監管的檢查。
(2)集團發展的戰略要求:隨著近幾年集團業務發展及信息化整體建設快速推進,集團已在決策層、管控層、屬地層同步推進信息化建設。目前,智能工廠的推進已成為集團戰略,信息化是支撐智能工廠的五大支柱之一,而文件管理系統(DMS)是工業板塊信息化架構中不可或缺的組成部分,更是維持良好GMP體系的核心系統之一。集團希望能夠以此次質量文件管理系統的實施項目為契機,在質量管理工作的管控模式上形成一定的轉變,逐步打造一個合規、高效的管理體系。
我們對文件管理系統提出了如下需求:①建立管理GMP文件標準:審批流程標準化、文件格式標準化、文件編碼標準化;②實現集團總部對下屬企業文件進行查看和管控;③統分結合,在標準化統一的前提下,滿足各企業的個性化受控使用文件的需求;④滿足計算機化系統驗證(CSV)要求,保證文件管理系統的安全性。
1集中部署的優勢和難點
經過慎重的比較分析,我們選擇了集團集中部署的方案進行推進。
1.1 集中部署的優勢
①采用集中部署,各子公司不用單獨進行本地文件系統建設,大大節約軟件購買和服務器資源費用。②集團及各子公司統一使用一套系統對質量相關文件進行管理,文件可根據管控需要實現共享。③集團部署并同步做計算機化系統驗證(CSV),總部承擔了大部分驗證工作,且驗證文件可以重復利用,大大節約各子公司單獨做驗證的時間和成本。
1.2 DMS功能與架構
根據GMP對文件管理的要求,DMS系統具備對一類、二類、三類文件全生命周期管理的功能。
1.3 面臨的主要挑戰與解決策略
為了完成最終覆蓋所有生產基地的總目標,我們采用“總體規劃,試點先行,積累經驗,全面覆蓋”的推進策略。項目一期范圍:集團總部及5家試點企業。
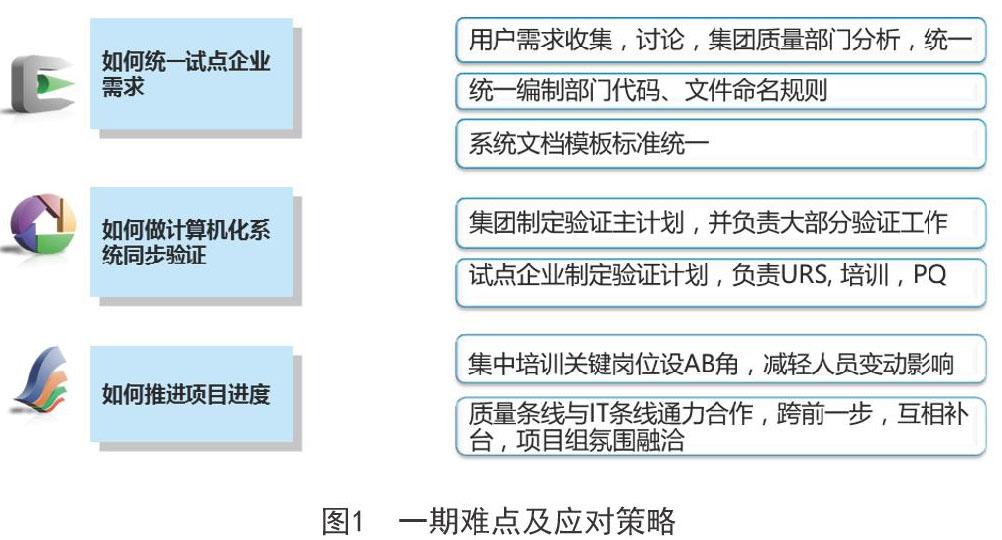
在一期,我們面臨三個難點,分別是:①如何統一試點企業需求?②如何做計算機化系統同步驗證?③如何推進項目進度?
我們的應對策略如圖1:
通過充分借鑒所選軟件承載的管理模式與最佳實踐,充分吸取管理良好企業的經驗方法,我們形成統一規范和標準,上下達成共識,發布后嚴格執行,使一期項目得以順利上線并平穩運行[1]。
2CSV驗證方法
因為DMS系統和質量相關,根據法規要求,必須同步完成計算機化系統驗證(CSV)。由于項目實施主要是采用產品配置方式實現,根據GAMP5指南,用4類(可配置產品)驗證方法進行計算機化系統驗證工作。
本次實施中質量部門全程參與項目,且有對應的業務負責人、驗證負責人和質量負責人參與進行審核,項目經理對項目風險進行把控,多方緊密配合,完全依據CSV的要求和方法論推進,確保了CSV的順利完成。
因為采用集中部署,具有共性的計算機化系統驗證工作由集團總部完成,具體包括:供應商審計、驗證主計劃、驗證計劃模板、系統影響性評估、需求說明書、功能說明書、功能性風險評估、系統架構說明書、系統配置說明、設計審查報告、安裝說明書、IQ方案腳本和報告、OQ方案腳本和報告、PQ方案、系統操作手冊、追溯矩陣、驗證總結報告。
由于集團總部已完成上述工作,各子公司僅需完成驗證計劃、需求調研、系統培訓和PQ部分的工作,80%的驗證工作量由集團總部這邊統一完成,避免子公司進行不必要的重復性計算機化驗證工作。
項目過程中一旦出現一些偏差或者是需要變更之類的,集團總部發起一份變更就好,不用各個子公司再發起一遍。一期做過的供應商審計和IQ驗證等工作也可以在二期中進行簡化,這對于將來在全集團的生產單位推廣使用該系統的時候,將會節省巨大的CSV工作量和時間,積累了經驗。
3效益分析
通過一期項目建設和軟件的平穩運行,我們總結取得的效益如下:①DMS的文件分類使用了DIA(藥品信息協會)的模型,符合行業標準,對于不同的文件分類,依據最佳實踐對應不同的生命周期以及審批流程,系統能夠對文件版本進行管理,審計追蹤功能保留了對文件所有的修改信息。系統提供的這些功能使得GMP相關文件合規性大大提升。②協同編輯功能使文件修改更方便高效,審批流程都是自動推送,縮短審批時間。系統對文件版本進行了有效管理,文件生效后自動升版本號,避免了文件流轉過程中的丟失現象。③靈活強大的搜索功能既可以方便業務部門的使用,又可以大大節約監管機構的檢查時間,提升檢查效率和正確通過率,給監管部門樹立良好形象。④通過集團統一部署質量文件管理系統,整個集團范圍內實現標準統一,各個子公司的文件架構以及相關流程架構都得到了統一規范。通過這一系統,各子公司的文件管理遵守集團統一要求,并由經過驗證的計算機系統進行管控,在滿足運營管控戰略要求下,同時為其提供高效的文件管理系統工具。⑤相關部門能夠更為有效、透明地管控質量,集團與子公司更為高效地協同,在整體上將合規的能力提升到新的水平,向獲取完全的運營管控能力邁出了堅實的第一步。⑥通過這個項目的實施,可以很好地起到練兵的作用,項目參與人員的能力都得到提升,制造環節的質量部門與信息化部門也可以形成良好的工作關系和默契,為后續系統的建設積累經驗并打下堅實的人員基礎。
4結束語
通過統一部署質量文件管理系統,集團可以在權限合規的情況下,方便查閱目標子公司的相關文件,在必要的情況下,也可以參與相關質量管控工作,從而使得原先松散的集團與下屬企業之間的關系變得更為緊密,讓集團在履行藥品上市持有人職責時沒有后顧之憂。
本次質量文件管理系統的實施是集團集中部署的針對GMP計算機驗證與合規方面進行的首次項目,也是一次積累經驗和學習的過程。通過這次質量文件管理系統計算機化驗證的統一工作,集團也可以帶領子公司來熟悉這項工作的過程,讓子公司來學習如何做計算機化系統驗證,并積累相關經驗,熟悉流程中各個節點要注意哪些問題。同時,由集團質量部門和IT部門一塊出面,來完成計算機化系統驗證的工作,形成一份集團規劃的指導性文件,再把這份指導性文件推廣到下屬生產企業去。我們將借鑒和總結一期成功經驗,今后將大規模向集團下屬的其他藥品生產企業推廣DMS實施工作,讓全集團共同提升這方面的能力。
參考文獻
[1] 良好自動化生產實踐指南第五版[ED/OL].https://ishare.iask.sina.com.cn/f/34351981.html,2012-10-22.
作者簡介
過明祺(1977-),男,江蘇無錫人;學歷:本科,研究方向:軟件項目管理。

