血管內皮祖細胞外泌體調控骨髓間充質干細胞基因表達譜芯片
魏韓笑,張愛君,李 強,金培生
(徐州醫科大學附屬醫院整形外科,江蘇徐州 221000)
糖尿病創面(簡稱糖創)遷延不愈是糖尿病最常見的慢性并發癥之一,致死致殘率高。糖創治療困難且極易復發,是臨床上治療的重點、難點。傳統治療方法是皮片或皮瓣移植,但存在局部血液供應不良引起皮片或皮瓣壞死。密集的血管網不僅可以將有害代謝產物導出微環境、排出機體,更重要的是把細胞因子及基礎營養物質攜帶到組織缺損區域[1]。血管內皮祖細胞(endothelial progenitor cells,EPCs)是內皮細胞的前體,是成體干細胞中的一種。EPCs 常與MSCs 聯合用于微血管網絡的構建。EPCs 不僅有促進組織快速血管化的能力,并且對與其共培養的其他種子細胞也具一定的有營養支持作用[2],這為臨床上治療組織器官缺血性疾病帶來希望。
研究表明,EPCs 和其他類型干細胞性質類似,存在進入機體后無法充分定向分化的技術瓶頸[3]。因此,EPCs 來源的外泌體為組織修復和再生開辟了嶄新道路。外泌體是細胞分泌的直徑在40~150 nm 的微囊泡,常以胞吞的形式進入受體細胞,通過“重編程”相關基因來發揮作用[4]。因此本研究擬通過基因芯片方法篩選可能在EPC-exos 調控MSCs 生物學功能中發揮重要作用的相關基因,探索EPC-exos 調控MSCs 發揮干細胞優越性的具體機制,為后續外泌體靶向修復糖尿病創面打下理論依據。
1 材料與方法
1.1 芯片樣本(細胞來源)
骨髓間充質干細胞(bone marrow stromal cells,MSCs)和血管內皮祖細胞(endothelial progenitor cells derived from peripheral blood,EPCs)均取自同新西蘭大耳白兔,10 周齡,體重約(1 000±50)g,實驗動物均由徐州醫科大學實驗動物中心提供,質量合格。
1.2 主要試劑和耗材
TRIzol Reagent P/N 15596-018 Invitrogen Life Technologies,Poly-A RNA Control Kit P/N 900433 Affymetrix。
Hybridization Control Kit P/N 900454 Affymetrix。
1.3 細胞復蘇
細胞復蘇應用文獻報道方法進行分離鑒定MSCs 和EPCs[5-6],復蘇細胞后更換干細胞培養液,調整細胞數量約為為105/mL,于37℃、5%CO2飽和濕度培養箱內培養。
1.4 EPC-Exos 的獲取和鑒定
EPCs 在無血清的培養液中培養48 h,用超速離心法提取培養液中的外泌體,BCA 法檢測其蛋白濃度。Western Blotting 檢測表達內皮祖細胞外泌體表達CD9、CD63 和Alix 情況[7]。
1.5 構建聯合培養裝置
棄培養瓶中培養液,收集細胞。用血球計數板計數細胞,取104MSCs 和EPC-Exos 懸液,建立共培養體系,同時設立單獨MSCs 培養組,以此方法制備送檢樣本。每孔分別滴入2 mL 含有10%的胎牛血清的DMEM培養液,次日換液,連續培養14 d 后送檢。
1.6 總RNA 質檢和雜交芯片
Trizol 提取total RNA,使用分光光度計和電泳技術定量檢測。取芯片,滴入對應雜交液,45℃,60 r/min 旋轉雜交約16 h。
1.7 數據提取及分析
通 過AGCC 軟 件(Affymetrix GeneChip,Command Console Software)記下探針(Probe)的熒光信號大小。校正背景,將探針信號綜合整理成探針組(Probeset),遺傳物質片段利用歸一化將非生物學因素清除掉。刪去數據集中沒有注釋的探針及同時對應多個基因的探針,關鍵基因表達分析采用軟件SPSS 23.0 對最終篩選出的關鍵基因進行兩獨立樣本t檢驗,P<0.05 為差異有統計學意義。
2 結果
2.1 細胞培養
倒置相差顯微鏡下見與外泌體共培養的MSCs于72 h 后貼壁狀態(圖1A),相比較MSCs 單獨培養組,細胞大量增殖(圖1B),出現較多突觸連接,多數細胞巢式生長,鏡下可見大量復層細胞。
2.2 EPC-exos 鑒定
從EPCs 中分離出外泌體,并進行透射電鏡、Western Blot 外泌體標記蛋白檢測。外泌體呈典型圓形和橢圓形,WB 檢測Alix、CD9、CD63 呈高表達(圖2)。
2.3 待測樣本的Scatter Plot
樣品經質量檢測后顯示參數符合質控標準。為研究EPC-exos 對MSCs 增殖、分化等功能的影響,本研究對與EPCs-exos 聯合培養的MSCs 和單獨培養的MSCs 間基因表達有差異者進行檢測。結果顯示EPC-exos 對MSCs 的基因表達影響較大(圖3)。

圖1 顯微鏡下觀察兩組細胞生長情況Fig.1 The cell growth status under microscope
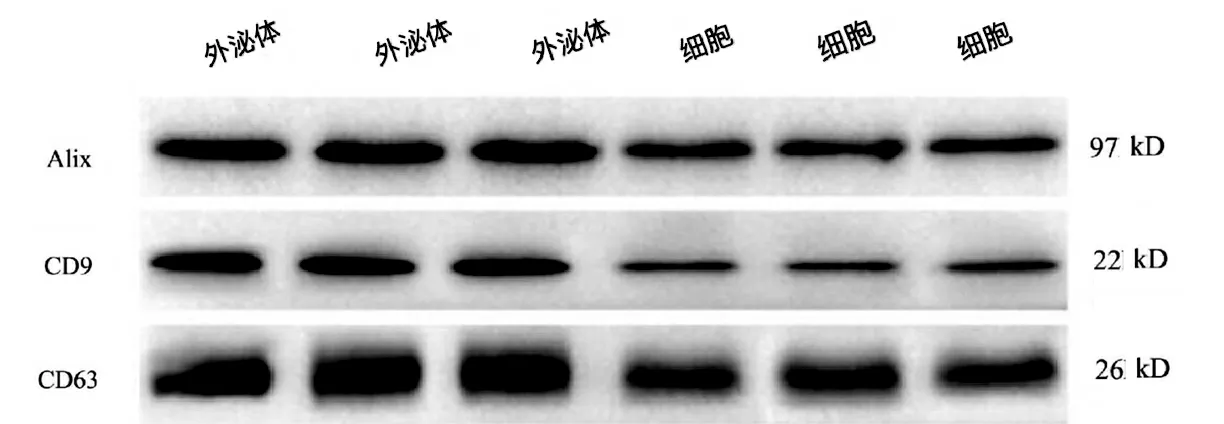
圖2 EPC-exos 經WB 檢測Alix、CD9、CD63 呈高表達Fig.2 High expression of Alix、CD9 and CD63 of EPC-exos by Westernblot
圖3 EPC-exos 影響MSCs 基因差異表達情況Fig.3 The differentially expressedgenes of MSCsinfluenced by EPC-exos
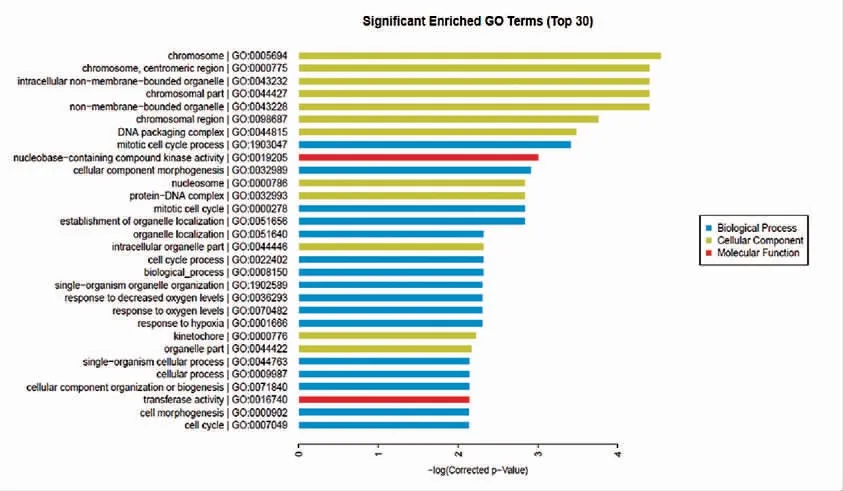
圖4 EPC-exos 影響MSCs 差異表達基因GO 分析Fig.4 GO analysis of differentially expressed genes of MSCs cultured with EPC-exos
2.4 差異表達基因
進行GO 功能富集和KEGG 通路富集,分析使用DAVID,篩查差異基因表達,總數據顯示差異共1 772 個基因,上調者664 個,下調者1 108個,有統計學意義(P<0.05)。
2.5 MSCs 基因差異表達的Gene ontology(GO)分析
GO 富集分析分為三個方面,分別是:分子功能、生物學過程、細胞組分。利用對基因芯片結論中差異表達基因的Ontology 研究,筆者發現染色體、著絲粒等結構差異基因表達活躍,細胞器定位發生影響。這些都與MSCs 增殖、細胞周期等密切相關;通過觀察EPC-exos 調控MSCs 顯著富集的通路,筆者發現細胞周期、P53 通路及酮體合成和降解影響最大(圖4~圖5)。

圖5 EPC-exos 調控MSCs 顯著富集通路的影響Fig.5 Significant Enriched pathway of MSCs cultured with EPC-exos
2.6 EPC-exos 調控MSCs 差異表達基因的Pathway 分析
為了進一步明確EPC-exos 調控MSCs 增殖和分化的機制,通過KOBAS 數據庫對基因芯片的結果進行分析。通過分析認為EPC-exos 調控MSCs增殖分化主要通過細胞周期和MARK 通路進而激活MSCs 增殖分化相關信號傳導的過程。圖6 分別展示的是EPC-exos 對MSCs 影響的信號通路中的一些關鍵基因(紅色背景)。

圖6 EPC-exos 調控MSCs 差異表達基因CELL CYCLE 分析Fig.6 EPC-exos regulates CELL CYCLE analysis of MSCs differentially expressed genes
3 討論
近年來,基因測序技術和基因芯片等高通量檢測技術的迅速更新迭代使生物學功能進入更加微觀和精準的研究中。從這些數據中可以挖掘出數以萬計甚至百萬的與生物體生理、病理過程相關的基因集。大數據時代中科技融合產生科技創新,在醫學領域中健康和疾病的表征變得簡單和準確,技術的進步和診斷儀器的精準化使當代醫學得到迅猛發展[8]。
再生醫學是當代生命醫學、材料學、計算機學、工程學等有機結合形成的新興學科。各個學科相互引證結合以解決人類重大疾病問題。組織器官再造是再生醫學的重要范疇之一。近年來再生醫學的研究逐漸深入,包括細胞治療、微環境治療、基因靶向治療和組織工程等,學科和范疇間交叉并且互相滲透。
細胞是再生醫學中真正的工程師。隨著再生醫學中精準醫療時代的開啟,生物樣本采集和測序逐漸受到國內外學者的重視。生物樣本庫為基因、細胞靶向治療或藥物開發提供了豐富的生物樣本和數據,推動著腫瘤、心血管疾病、免疫系統疾病等重大疾病的研究和治療進展[9]。在機體眾多細胞中,干細胞是最具潛力的細胞之一。胚胎干細胞或成體干細胞均可自我更新和多項分化,機體在正常生理狀態通過干細胞增殖分化來代謝更新衰老和死亡細胞,在病理狀態下可通過干細胞歸巢招募來實現機體修復[10]。除此之外,各類干細胞可分泌不同細胞因子、生長因子等參與生物體的生理病理過程。
目前對血管內皮祖細胞(endothelial progenitor cells,EPCs)特點和機制有了越來越詳盡的認識,但是在應用方面,因為生物體內環境的復雜性和多樣性,EPCs 進入活體后的應用面臨各種瓶頸。比如因子及信號傳導通路的網絡性、細胞策略如何迅速建立組織血管化、進入機體后無法充分定向分化等[11]。
外泌體的靶向治療作用可避免細胞治療時移植異體活細胞而帶的免疫排斥反應,降低干細胞注入后對全身造成的影響,加快實現臨床無細胞修復,對進一步臨床研究和應用推廣有重要的轉化醫學意義。外泌體攜帶的內含物(LncRNA、miRNA,mRNA,DNA 和蛋白質等)能夠影響受體細胞的生理狀態[12]。EPC-exos 是來源于EPCs 的外泌體,研究報道EPC-exos 在促進創面愈合方面可能作用機制如下:(1)在創面的局部微環境下,外泌體參與誘導分化為創面修復所必需的成纖維細胞、角質形成細胞和血管內皮細胞等;(2)外泌體可能具有抗炎、免疫調節和免疫抑制作用,可通過調控創傷后成纖維細胞向肌纖維細胞分化的調控作用;(3)外泌體促進創傷局部或循環中的細胞遷移、増殖和新血管形成[13]。
大量臨床前研究證實骨髓間充質干細胞(bone marrow stromal cells,MSCs)在治療糖尿病創面上具備良好的前景。部分研究已經進入臨床觀察。Kyung 等[14]將糖尿病創面患者分為治療組和對照組,證實異體脂肪來源的MSCs 應用于糖尿病創面,12 周后實驗組創面閉合率遠高于對照組。現階段干細胞的主要移植方式有血管內注射和局部注射,但存在劑量層次不好控制且細胞存活時間段等問題,因此如何能加速創面組織血管化進程是目前干細胞應用于臨床的關鍵問題。
本研究通過構建EPC-exos 與MSCs 共培養獲取EPC-exos 與MSCs 共培養后的MSCs 差異表達顯著的基因,通過生物信息分析數據,尋找這些基因所影響細胞代謝特點和信號通路以及這些基因可能涉及的疾病,在分子水平闡述EPC-exos 對MSCs增殖、分化和趨化運動等作用機制。從基因芯片的分析結果來看,MSCs 與EPC-exos 共培養后,MSCs 產生大量表達差異基因共1 772 個,上調者664 個,下調者1 108 個。差異基因集中于細胞周期相關構如染色體、著絲粒等。從KOBAS 數據Pathway 分析結果中可以看到,眾多的差異基因在細胞周期和MARK 等通路中起著作用,我們猜測EPC-exos 調控MSCs 增殖分化是一個主要通過調控細胞周期和MARK 通路進而激活MSCs 增殖分化相關信號傳導的過程。
體外細胞和組織模型是病理生理學研究、疾病建模、藥物開發和個性化治療策略開發工作流程中的重要一步。出于這些目的,科學和制藥研究都采用了體外干細胞模型,因其可以很好反映待測數據,并且相對于動物實驗,實驗人員可以更精準的實施變量調控。目前干細胞在體外培養方式,如支架細胞模型、類器官或芯片器官,可以克服二維培養系統的局限性,并更好地模擬組織結構和功能。目前基因組編輯和基因治療技術的出現對干細胞疾病模型的有效建立產生顯著推動作用。本研究討論EPC-exos 調控MSCs 基因表達的差異影響,并在基因芯片的高通量背景下挖掘檢測結果并對產生的差異基因進行相關預測。
細胞、基因產業已成為當下全球生物醫藥行業、生命科技前沿探索最重要的領域之一[15]。但是目前的研究還存在許多瓶頸,例如如何安全合理地將實驗室成果應用于臨床,如何建立行之有效的評價體系;如何最大可能減少干細胞對機體致瘤性等等,這些問題的解決都還有很長的路要走。

