化療誘導的衰老細胞胞外囊泡的分離及相關特性研究①
周 琦 丁麗麗 李 芬 劉愛國 周學鋒 楊 燕
(華中科技大學同濟醫學院附屬同濟醫院,武漢 430000)
細胞衰老是指細胞受到外界壓力時細胞周期進入長久停滯的狀態。細胞衰老可分為復制性衰老與治療誘導性衰老(therapy-induced senescence,TIS)[1]。復制性衰老是對DNA損傷、癌基因激活、端粒縮短等的應急反應,是阻止腫瘤發生的一種自我保護機制。TIS是指放療、化療或藥物靶向治療引起的腫瘤細胞衰老,其可由治療導致的DNA損傷或抑制細胞分裂必需的激酶(如極光激酶aurora kinase,AURKA)引起[2]。TIS因其能使腫瘤細胞進入生長靜止期且其藥物毒性遠低于細胞凋亡而倍受關注。早期研究在肺癌、乳腺癌中觀察到化療誘導的細胞衰老與治療應答正相關[3,4]。衰老的腫瘤細胞停止分裂,腫瘤進展得到控制。近期研究表明化療誘導的細胞衰老是一把“雙刃劍”:一方面衰老細胞周期阻滯可有效控制腫瘤生長;另一方面衰老細胞并沒有死亡,其可自分泌或旁分泌生長因子、細胞因子及蛋白酶等,這種現象稱為衰老相關的分泌表型(senescence-associated secretory phenotype,SASP)。SASP 可使衰老的成纖維細胞轉成促炎細胞,產生炎癥因子和基質金屬蛋白酶,促進周邊非衰老腫瘤細胞生長、復發[5,6]。衰老細胞可分泌胞外囊泡(EVs),其分泌的EVs能夠調節受體細胞表型,如加速衰老、炎癥、干細胞失能與癌癥進展,功能類似于SASP,因此認為衰老相關EVs(senescence-associated EVs,SAEs)是一類新的SASP因子[7]。為了解SAEs對腫瘤細胞及免疫細胞的影響,本文利用AURKA抑制劑MLN8237處理神經母細胞瘤細胞系IMR32建立細胞衰老模型,收集培養上清中衰老細胞分泌的EVs(SAEs),分別觀察SAEs對IMR32細胞與單核細胞THP-1的影響,初步判斷SAEs是否影響腫瘤微環境相關細胞,為進一步探討SAEs對腫瘤微環境的影響及其機制提供參考。
1 材料與方法
1.1材料 化療藥物阿霉素、順鉑及AURKA抑制劑 MLN8237購自MCE公司;RIPA細胞裂解液購自武漢生命公司;蛋白酶抑制劑購自Roche公司;BCA蛋白定量試劑盒購自Pierce公司;衰老相關β-gal染色試劑盒購自GENEMED科技公司;AURKA、 pAURKA、GAPDH、 TSG101、 GRP78、 β-actin、C-MYC、N-MYC及BRD4抗體購自Arigo公司;Rb及p-Rb抗體購自Arigo公司;PI與RNaseA購自谷歌公司;定量RT-PCR試劑盒PrimeScriptTMRT Master Mix (Perfect Real Time)與TB Green?Fast qPCR Mix試劑盒購自TaKaRa公司;外泌體分離試劑盒Exoquick購自廣州銳博生物公司。神經母細胞瘤細胞系IMR32、SK-N-SH、SK-N-BE2及單核細胞系THP-1購自ATCC;DMEM、MEM、RPMI1640培養基、胎牛血清購自Gibco;化學發光顯色試劑、2-硫基乙醇、DMSO、肉豆蔻酸佛波酯(phorbol myristate acetate,PMA)購自Sigma公司;TRIzol購自Invitrogen。
1.2方法
1.2.1細胞培養 IMR32與SK-N-SH 用含10%胎牛血清、100 μg/ml青鏈霉素的DMEM培養于37℃、5% CO2培養箱;SK-N-BE2培養于含10%胎牛血清的MEM/F12;THP-1用含10%胎牛血清、0.05 mmol/L 2-巰基乙醇的RPMI1640培養基培養。待細胞生長至對數期用于實驗。
1.2.2細胞周期檢測 細胞(IMR32、SK-N-SH、SK-N-BE2)以3×105個/孔接種于6孔板,第2天分別加入0.5 μmol/L阿霉毒(Doxorubicin)、0.5 μmol/L順鉑(Cisplatin)及0.5 μmol/L MLN8237處理72 h,以不加藥的培養基(Medium)或DMSO為對照組。胰酶消化后,加入冷無水乙醇,-20℃固定1 h。將固定好的細胞離心棄無水乙醇,冷PBS洗2次。加入RNaseA溶液,37℃水浴30 min。加入PI染色液,充分混勻后4℃避光孵育30 min,流式細胞儀檢測。
1.2.3衰老相關β-半乳糖苷酶(SA-β-gal)活性檢測 IMR32細胞以3×105個/孔接種于6孔板,第2天加入0.5 μmol/L MLN8237處理72 h,設置未經藥物處理的正常對照組。按照SA-β-gal染色試劑盒說明書染色細胞,37℃孵育16 h,鏡下觀察藍染細胞并拍照。
1.2.4EVs收集與鑒定 將含10%胎牛血清的DMEM培養基以170 000 g、4℃超速離心2 h后棄去血清中EVs,收集上清,0.22 μm過濾后備用。IMR32細胞用上述含EVs-free血清的DMEM培養至對數生長期,0.5 μmol/L MLN8237處理72 h后收集上清,分別用超速離心技術或PEG技術分離EVs。超速離心技術:2 000 g離心10 min,10 000 g 4℃離心30 min棄去細胞碎片,4℃ 170 000 g離心2 h,所得沉淀用PBS重懸,保存備用。利用PEG技術根據Exoquick試劑盒說明書分離EVs。Western blot檢測兩種方法得到的EVs后選取超速離心得到的EVs送至廣州表觀生物技術公司分析囊泡粒徑與濃度。
1.2.5Western blot分析EVs對腫瘤細胞影響 收集處理好的細胞或EVs樣本,用含蛋白酶抑制劑的RIPA裂解液冰上裂解,提取總蛋白,蛋白經BCA法定量。總蛋白變性后每孔上樣20 μg行SDS-PAGE電泳分離。凝膠經轉移緩沖液平衡后,將蛋白轉印到NC膜,5%脫脂牛奶常溫封閉1 h,加入一抗4℃過夜。所用一抗使用濃度分別為:AURKA(1∶2 000),pAURKA(1∶1 000),GAPDH(1∶5 000),TSG101(1∶1 000),GRP78(1∶1 000),β-actin(1∶1 000),C-MYC(1∶1 000),N-MYC(1∶1 000),BRD4(1∶1 000)。TBST漂洗后加二抗(1∶10 000),37℃孵育1 h。NC膜浸泡于等量ECL發光試劑A、B混合液數秒,于化學發光成像系統掃描成像。
1.2.6顯微成像及RT-qPCR分析EVs對巨噬細胞的影響 THP-1細胞接種至6孔板培養至對數生長期,分別加入SAEs(SAEs組)、腫瘤細胞來源EVs(EVs組),以不加EVs為陰性對照(Non-treated組),PMA處理組(PMA組)為陽性對照。培養96 h后收集細胞,顯微觀察并成像記錄細胞形態;TRIzol法提取mRNA。逆轉錄得到cDNA;各基因定量PCR采用TB Green?Fast qPCR Mix試劑盒完成。引物序列見表1。PCR程序如下:95℃變性2 min;95℃ 10 s,60℃ 10 s;72℃ 10 s,共40個循環;72℃延伸1 min。以GAPDH作為內參,各目的基因mRNA水平用2-ΔΔCt表示。
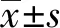
2 結果
2.1細胞衰老模型建立 3種藥物中,MLN8237誘導細胞周期阻滯最明顯;阻滯于G2/M期的IMR32細胞比例最高,達87.4%。阿霉素作用神經母細胞瘤導致細胞周期阻滯程度最輕,順鉑組細胞阻滯程度中等(圖1A)。0.5 μmol/L MLN8237可抑制AURKA磷酸化,導致細胞周期阻滯與細胞衰老(圖1B)。通常衰老細胞形態變化表現為體積和細胞核增大、核膜內折、細胞器變形等,同時β-gal活性上調,底物X-gal在β-半乳糖苷酶催化下生成藍色產物。圖1C顯示0.5 μmol/L MLN8237處理IMR32細胞72 h后,與正常組比較,加藥組細胞呈現大而扁平的衰老狀態,鏡下所見幾乎所有細胞均變大且藍染。因此,選擇MLN8237作用IMR32細胞建立細胞衰老模型用于后續實驗。
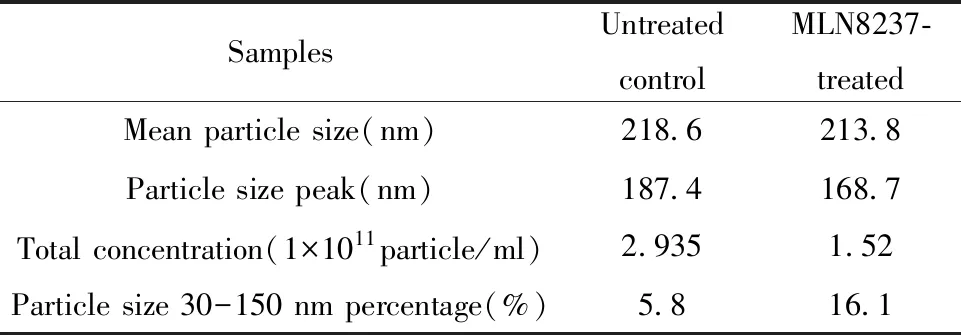
表2 EVs顆粒大小與濃度
圖1 細胞衰老模型的建立Fig.1 Establishment of cell senescence model

圖2 SAEs的分離與鑒定Fig.2 Isolation and identification of SAEs
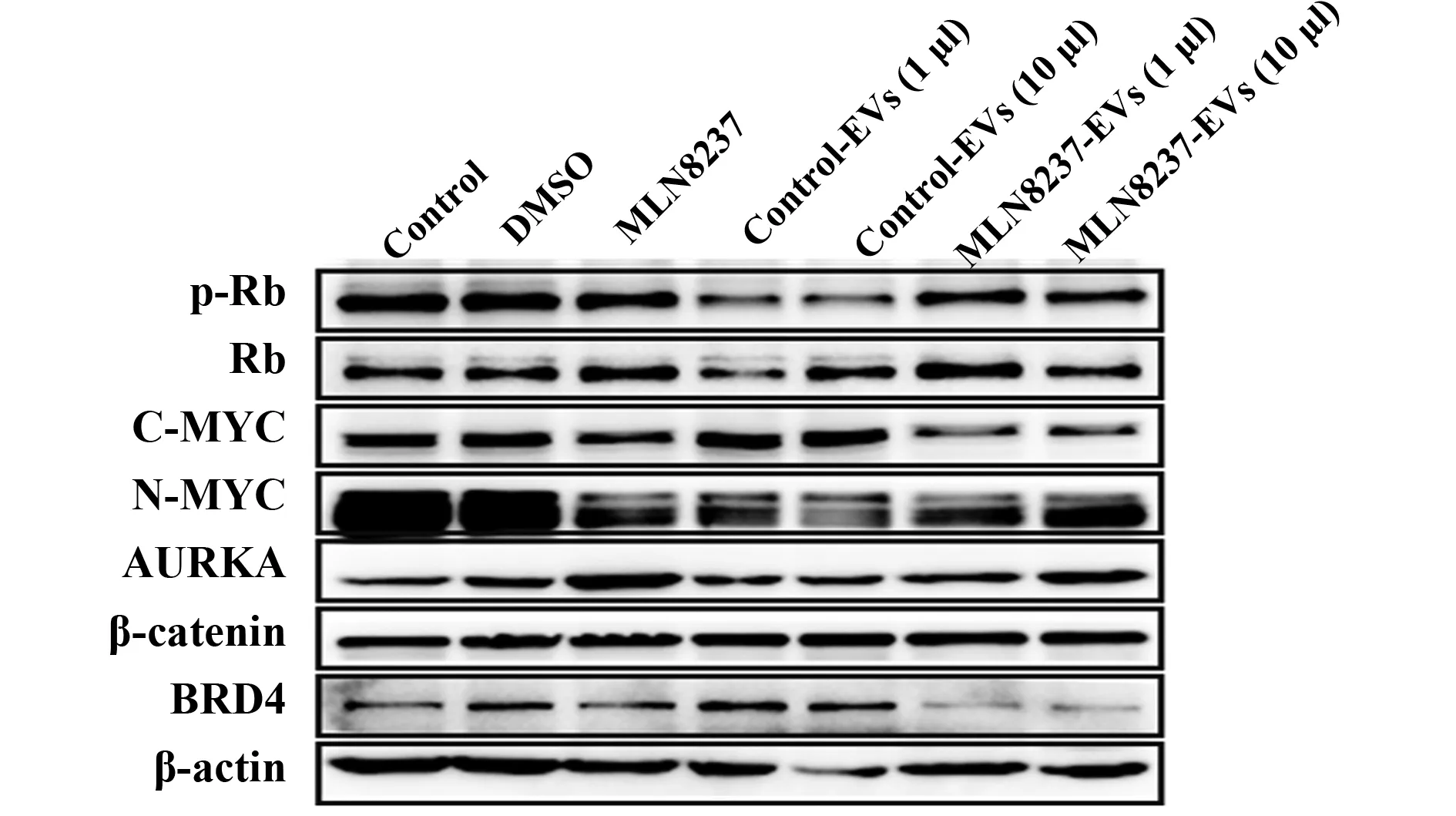
圖3 SAEs抑制IMR32細胞BRD4通路Fig.3 SAEs inhibits BRD4 pathway in IMR32 cells
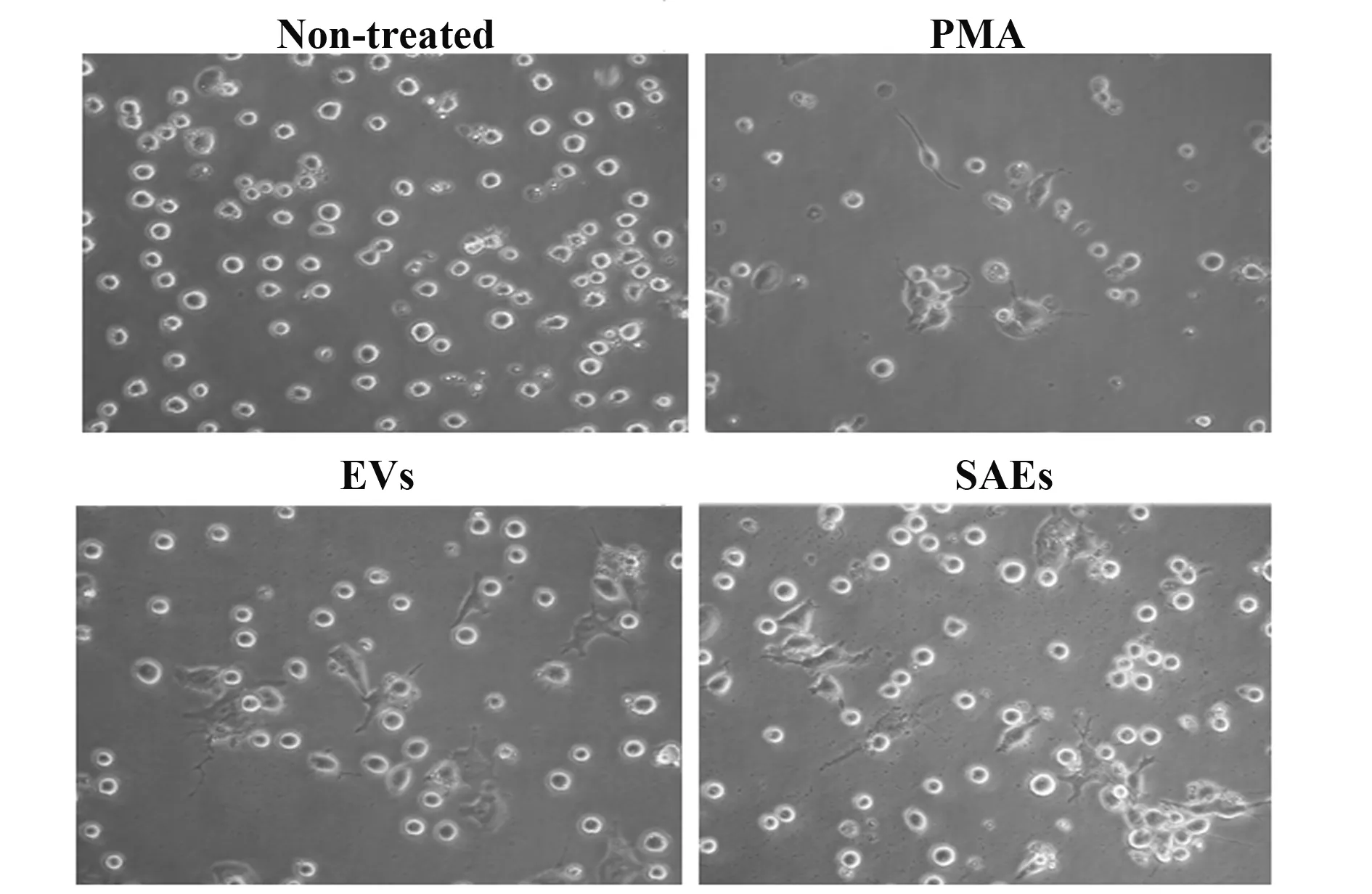
圖4 SAEs誘導THP-1細胞極化Fig.4 SAEs induced THP-1 cell polarization
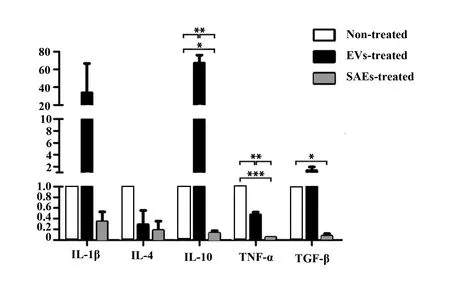
圖5 SAEs抑制THP-1細胞相關細胞因子表達Fig.5 SAEs inhibited cytokines expression of THP-1 cellNote:*.P<0.05;**.P<0.01;***.P<0.001.
2.2超速離心收集衰老細胞上清EVs Western blot結果顯示,兩種方法分離樣本的膜蛋白TSG101在IMR32細胞及EVs樣品中均有表達,定位于胞漿的蛋白GRP78及β-actin只在細胞樣品中檢出,EVs樣品中沒有發現陽性條帶。超速離心收集的EVs樣品中TSG101含量明顯高于PEG法分離的EVs(圖2A)。衰老細胞與對照細胞分泌的EVs平均粒徑差異無統計學意義,但SAEs濃度明顯降低,可能與衰老細胞停止分裂,細胞數目顯著低于對照細胞有關(圖2B、表2)。由表2可知SAEs顆粒大小處于30~150 nm的顆粒百分比明顯高于對照組,即SAEs外泌體含量高于對照組。
2.3SAEs抑制IMR32細胞BRD4通路 與對照EVs相比,SAEs顯著抑制BRD4與C-MYC表達,對β-catenin、AURKA、N-MYC、Rb及p-Rb表達影響不顯著。對照EVs明顯上調C-MYC,對Rb與p-Rb的水平有明顯抑制作用(圖3)。
2.4SAEs影響THP-1細胞分化狀態 不同細胞來源的EVs與單核巨噬細胞共同孵育96 h后THP-1細胞形態如圖4,未處理的陰性對照組細胞處于正常懸浮狀態;PMA組細胞發生極化,貼壁伸出偽足;兩種EVs處理組細胞狀態與PMA處理組相似。RT-qPCR結果表明,兩種來源EVs均能抑制巨噬細胞表達TNF-α,且SAEs的抑制效果顯著高于腫瘤細胞來源EVs;與未處理對照組相比,SAEs顯著抑制巨噬細胞表達IL-10與TGF-β,而腫瘤細胞來源EVs大幅上調了這兩種蛋白特別是IL-10表達;EVs與SAEs對巨噬細胞內IL-1β與IL-4的表達影響均無統計學差異(圖5)。
3 討論
低濃度化療藥物誘導腫瘤細胞衰老是化療控制腫瘤的機制,細胞衰老同時伴隨細胞周期阻滯。本文利用3種神經母細胞瘤細胞系,分析了不同化療藥物誘導細胞周期阻滯情況。結果表明不同藥物誘導細胞阻滯效果不同,同種藥物作用不同細胞誘導細胞周期阻滯的效果也不同。例如臨床常用藥物阿霉素誘導3種神經母細胞瘤細胞周期阻滯效果均不明顯;另一種化療藥物順鉑對SK-N-SH細胞系幾乎無影響,但能誘導約50%的IMR32細胞周期阻滯于G2/M期。三種藥物中,AURKA抑制劑MLN8237效果最明顯,有87.4% IMR32細胞阻滯于G2/M期。β-半乳糖苷酶染色顯示,幾乎所有鏡下細胞均藍染,細胞大而扁平,呈現典型衰老狀態。因此,課題組利用MLN8237作用IMR32細胞建立細胞衰老模型研究衰老相關胞外囊泡。
EVs是細胞主動釋放的納米級膜囊泡,是腫瘤微環境的重要成分,在細胞通訊中發揮重要作用。基于其生物發生、大小和物理性質,可進一步分類為外泌體和微泡。其中直徑30~150 nm的顆粒為外泌體。外泌體中含有miRNA、mRNA、DNA片段和蛋白質,從供體細胞穿梭到受體細胞,是細胞間信息傳送的重要媒介[8,9]。各種細胞均可以分泌EVs,盡管經化療藥物誘導的SAEs低于未處理細胞,但外泌體所占百分比高于未處理細胞,說明細胞在藥物刺激下,細胞向外傳遞信息的“包裹”增加。SAEs中具體包含哪些信息目前尚未明確,本研究結果顯示SAEs明顯抑制了腫瘤細胞內BRD4/C-MYC通路。BRD4全稱為溴結構域蛋白4(bromodomain-containing protein 4),為BET家族成員。有研究顯示,BRD4表達失調與血癌、乳腺癌及結腸癌等多種癌癥有關[10]。BRD4蛋白能夠與RNA聚合酶Ⅱ(Pol Ⅱ)正向轉錄延長因子(positive transcription elongation factor b,P-TEFb)結合共同參與MYC、BCL2和BCL6等癌基因的轉錄[11]。有研究表明,BRD4蛋白占據了超級增強子的基因位置,能讓癌細胞保持相對不成熟的類干細胞狀態,在一定程度上驅動癌癥[12]。本文SAEs抑制了BRD4水平,發揮其抑癌效果,相對于腫瘤來源EVs其抑制C-MYC效果更明顯。而腫瘤來源EVs,更多地顯示了促癌作用,不僅上調了C-MYC表達,對Rb與磷酸化Rb也有明顯抑制作用。
觀察SAEs對免疫細胞調節作用發現腫瘤細胞來源EVs和SAEs均可誘導THP-1細胞分化為巨噬細胞,分化出的巨噬細胞會因誘導因素的不同而表現出不同表型和功能,即巨噬細胞的極化,表現為M1型和M2型巨噬細胞。M1型巨噬細胞通過分泌促炎細胞因子和趨化因子,并專職提呈抗原,參與正向免疫應答,發揮免疫監視功能;M2型巨噬細胞僅有較弱抗原提呈能力,其通過分泌抑制性細胞因子IL-10和/或TGF-β等下調免疫應答,在免疫調節中發揮重要作用[13]。本文利用腫瘤細胞來源EVs或SAEs作用THP-1細胞,引起胞內相關分子變化。在腫瘤微環境中免疫細胞處于抑制狀態,這種抑制可能由腫瘤細胞分泌的EVs介導[14]。本研究結果顯示SAEs能夠顯著降低免疫細胞表達IL-10與TGF-β,減輕免疫抑制狀態。提示化療誘導衰老細胞分泌的胞外囊泡傳遞的信息有利于腫瘤預后。
綜上,AURKA抑制劑MLN8237可以誘導神經母細胞瘤細胞IMR32衰老,SAEs一方面通過抑制BRD4/C-MYC通路影響腫瘤細胞生長,另一方面通過影響巨噬細胞極化減輕免疫抑制,為臨床使用低劑量化療藥物誘導腫瘤細胞衰老從而限制腫瘤增殖提供理論依據。由于本文實驗觀察的時間點較早,且所檢測的信號通路蛋白不夠全面,SAEs對腫瘤預后不利的一面及其對微環境中基質細胞影響還有待進一步研究。SAEs對腫瘤微環境影響的深入研究可為臨床化療效果評估提供參考。

