FHIT及Apollon蛋白在結直腸癌組織中的表達特征及預后預測價值
徐紀中,袁維堂,王貴憲,周全博,胡晟云
鄭州大學第一附屬醫院結直腸肛門外科 鄭州 450052
結直腸癌(colorectal cancer,CRC)是臨床常見消化道惡性腫瘤。據調查[1],世界范圍內CRC每年新發病例約800萬,發病率和死亡率均位居惡性腫瘤前列,近年來隨著人們生活節奏的加快及飲食結構的改變,其發病率呈逐年升高趨勢。CRC起病隱匿,早期癥狀不典型,故多數患者確診時已至局部晚期或發生遠處轉移,尤其以肝轉移最為常見,導致根治術、放化療效果不理想,預后較差[2]。隨著分子生物學研究的進展,人們發現抑癌基因失活及凋亡抑制基因過度表達在惡性腫瘤發生、發展及轉移過程中起重要作用。脆性組氨酸三聯體(fragile histidine triad,FHIT)基因是一種包含人類染色體脆性位點的抑癌基因,目前已有報道[3]其在肺癌、胃癌等多種惡性腫瘤組織中異常表達。另有研究[4]表明,凋亡抑制蛋白Apollon過度表達可促進細胞的惡性變。FHIT和Apollon蛋白在腫瘤發生、發展過程中均起重要作用,但關于其對CRC轉移病程影響的研究尚少。本研究對既往收治的163例CRC患者的臨床資料進行回顧,分析FHIT和Apollon蛋白在CRC組織中的表達情況,重點探討其與CRC轉移及預后的關系。
1 對象與方法
1.1研究對象回顧性分析2012年7月至2014年6月我院收治的163例CRC患者的臨床資料。其中男84例,女79例;年齡35~71(58.7±6.2)歲;腫瘤部位:結腸138例,直腸25例;腫瘤直徑≤5 cm者92例,>5 cm者71例;分化程度:高分化72例,中分化59例,低分化32例;浸潤深度:肌層65例,漿膜外60例,漿膜層38例;Dukes分期:A、B期46例,C、D期117例;組織學分型:管狀/乳頭狀腺癌118例,黏液腺癌30例,印戒細胞癌15例;有淋巴結轉移117例;有同時性結直腸癌肝轉移(SCRLM)93例,無SCRLM 70例。研究獲得醫院倫理委員會審批。
CRC患者均符合以下納排標準。納入標準:①接受CRC根治術治療。②術后病理檢測確診為CRC,SCRLM經病理學檢查肝轉移灶來源于CRC。③術前均未進行化療。④臨床資料完整。排除標準:①合并其他部位原發性惡性腫瘤。②術后隨訪資料缺失。③有嚴重貧血、感染或凝血功能障礙。
1.2FHIT及Apollon蛋白表達的檢測收集CRC癌組織、癌旁組織(距離病灶<3 cm,非正常組織),均采用體積分數10%中性甲醛固定,修整為1 cm3組織塊,經梯度乙醇脫水、二甲苯固定后,石蠟包埋,制作4 μm厚連續切片。切片經二甲苯脫蠟、梯度乙醇水化、熱修復后,用體積分數3%過氧化氫孵育,PBS洗滌,封閉液封閉;每張切片加入1∶100稀釋的兔抗人FHIT、Apollon多抗(北京中杉金橋生物技術有限公司)37 ℃孵育1 h,加入生物素標記的二抗繼續孵育30 min;DAB顯色,蘇木精復染,中性樹膠封片,光學顯微鏡下觀察染色結果。FHIT蛋白定位于細胞質,Apollon蛋白定位于細胞質和(或)細胞核。采用雙評分半定量分析法[5]判定蛋白表達情況。200倍鏡下每張切片隨機選取5個視野:按染色強度評分,無著色為0分,淡黃色為1分,棕黃色為2分,棕褐色為3分;按陽性細胞百分數評分,無陽性細胞為0分,≤10%為1分,≤50%且>10%為2分,≤75%且>50%為3分,>75%為4分。兩項評分乘積≤1判定為陰性,≥2判定為陽性。
1.3資料的收集及分析收集CRC患者性別、年齡、腫瘤部位、分化程度等臨床及病理資料。采用門診或電話方式進行隨訪,以接受手術治療為隨訪起始時間,以患者死亡、失訪或研究截止時間(2019年7月)為終點事件,計算總生存時間。
1.4統計學處理采用SPSS 19.0分析處理數據。CRC及癌旁組織中FHIT、Apollon陽性率的比較采用配對χ2檢驗,不同臨床病理特征CRC組織中FHIT、Apollon陽性率的比較采用χ2檢驗或精確概率法,采用列聯系數c評估CRC組織中FHIT、Apollon表達的關聯性;采用Kaplan-Meier法繪制不同FHIT、Apollon表達特征的CRC患者的生存曲線并進行log-rank檢驗;檢驗水準α=0.05。
2 結果
2.1CRC組織中FHIT及Apollon蛋白的表達CRC組織中,FHIT和Apollon蛋白陽性率分別為32.5%和84.7%,癌旁組織中分別為67.5%和48.5%。與癌旁組織比較,CRC組織中FHIT蛋白陽性率降低,Apollon蛋白陽性率升高,見表1、2。CRC組織中FHIT與Apollon蛋白表達存在負關聯,見表3。
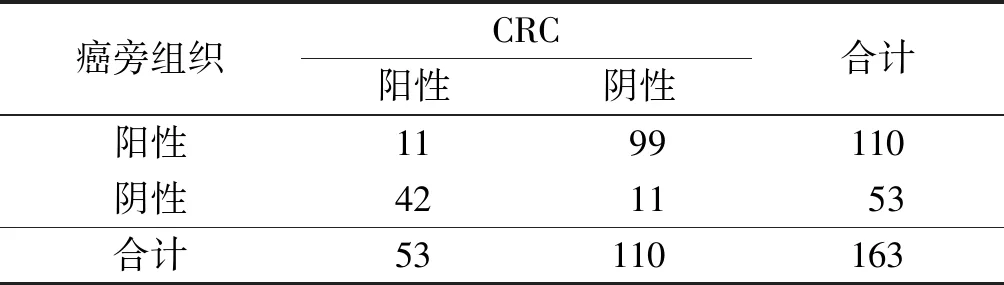
表1 CRC與癌旁組織中FHIT蛋白表達的比較 例

表2 CRC與癌旁組織中Apollon蛋白表達的比較 例
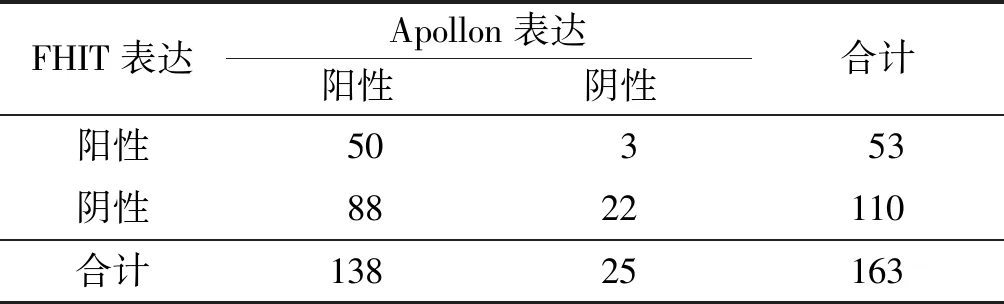
表3 CRC組織中FHIT與Apollon蛋白表達的關聯性分析 例
2.2不同臨床病理特征CRC組織中FHIT及Apollon蛋白表達的比較與浸潤至肌層或漿膜外、Dukes分期A或B期、無淋巴結轉移、無SCRLM者比較,浸潤至漿膜層、Dukes分期C或D期、有淋巴結轉移、有SCRLM的CRC組織中FHIT陽性率降低,Apollon陽性率升高(P<0.05);而不同性別、年齡、腫瘤部位、腫瘤直徑、組織學分型、大便隱血試驗狀態、HBsAg狀態及腹腔積液狀態的患者FHIT、Apollon陽性率比較,差異均無統計學意義(P>0.05),見表4。

表4 不同臨床病理參數CRC組織中FHIT及Apollon蛋白表達的比較 例(%)
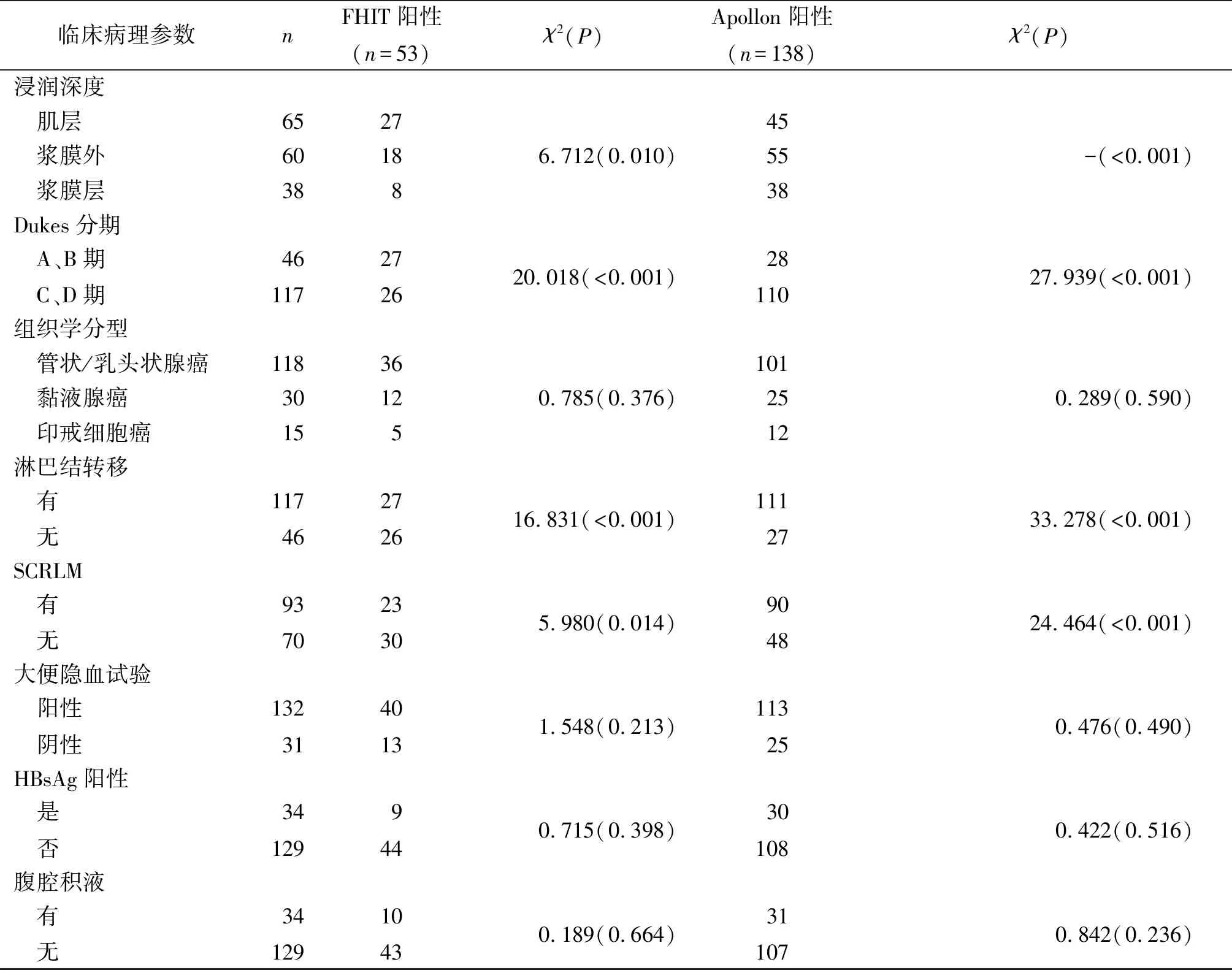
續表4
2.3FHIT、Apollon表達與CRC預后的關系163例生存曲線見圖1。FHIT+Apollon-患者預后優于FHIT+Apollon+患者(χ2=10.765,P<0.001);FHIT-Apollon+、FHIT-Apollon-患者預后差于FHIT+Apollon+患者(χ2=9.154、12.130,P<0.001);FHIT-Apollon+與FHIT-Apollon-患者生存曲線比較,差異無統計學意義(χ2=0.205,P=0.651)。
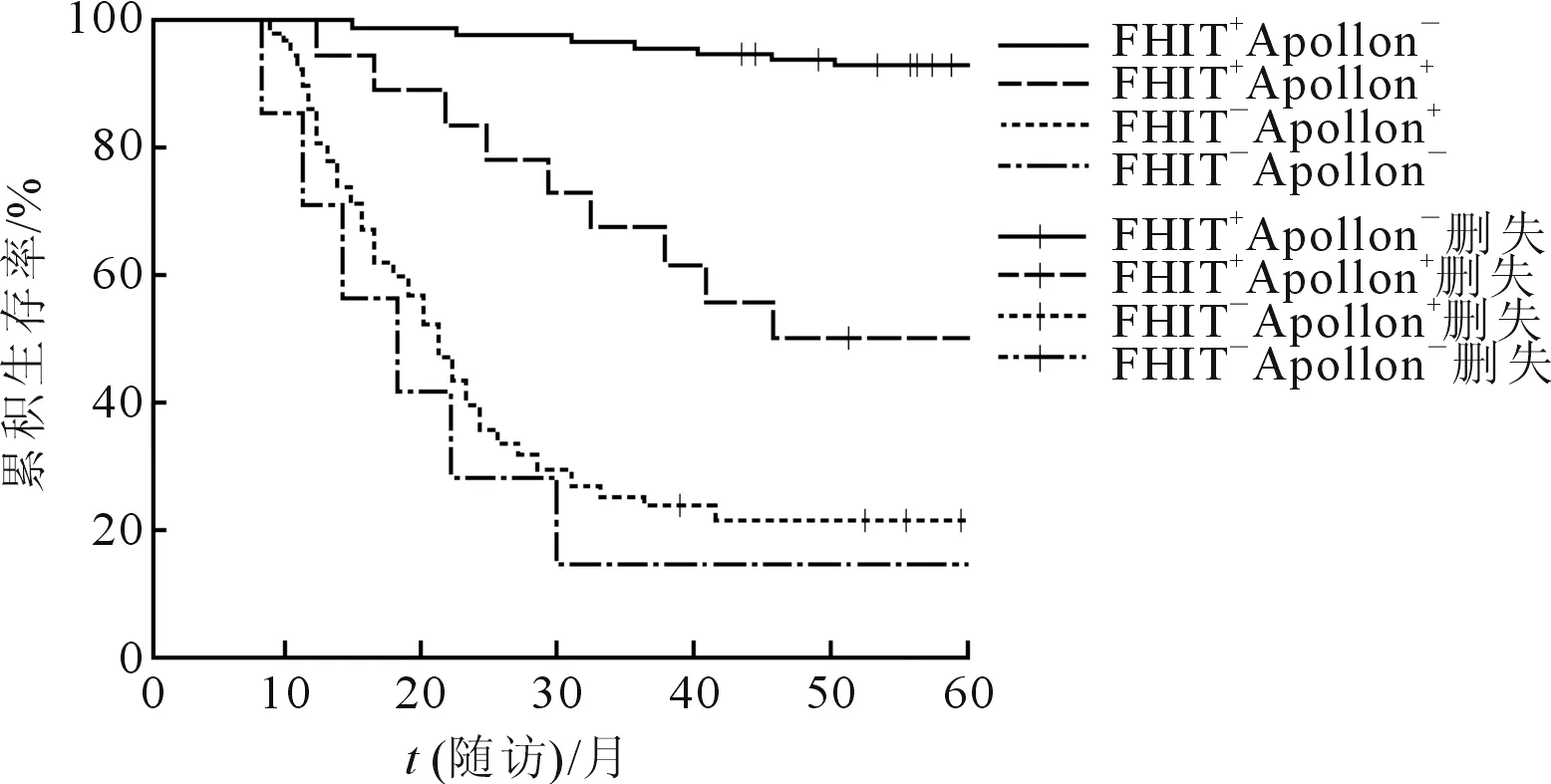
圖1 不同FHIT、Apollon表達狀態的CRC患者的生存曲線
3 討論
CRC屬于結腸黏膜上皮細胞惡性腫瘤,其發病原因與不良生活習慣、遺傳及環境因素等關系密切[6]。由于腸道血供及淋巴回流豐富,CRC細胞更易通過血液及淋巴循環發生遠端轉移,導致多數患者確診時已失去最佳治療時機,預后差[7]。因此,急需尋找可早期預測CRC復發和轉移的標志物,以便能及時有效干預,改善患者預后,延長生存期。
FHIT蛋白是三聯組氨酸家族重要成員,生理狀態下可在機體多種組織中表達。本研究發現CRC組織中FHIT蛋白陽性率低于癌旁組織,Apollon陽性率高于癌旁組織,提示FHIT蛋白表達缺失或Apollon蛋白表達增強與CRC的發生關系密切。Zheng等[8]研究發現,FHIT在胃癌中的表達水平低于正常胃黏膜組織,且其表達水平與浸潤深度、淋巴結轉移、遠端轉移及分化程度負相關。Apollon是凋亡抑制蛋白家族中相對分子質量最大的蛋白,其特有結構域桿狀病毒IAP重復序列(BIR)可與Caspase-9、Smac結合并促進其降解,從而抑制Caspase-9前體活化,抑制凋亡信號啟動,從而有利于癌細胞的無限增殖、轉移等過程[9]。本研究中與浸潤至肌層或漿膜外、Dukes分期A或B期、無淋巴結轉移、無SCRLM者比較,浸潤至漿膜層、Dukes分期C或D期、有淋巴結轉移、有SCRLM的CRC組織中FHIT陽性率降低,Apollon陽性率升高,提示FHIT蛋白表達異常降低或Apollon蛋白表達異常升高均有利于CRC細胞的侵襲、轉移。
Druck等[10]研究表明,FHIT可通過死亡受體途徑和線粒體依賴凋亡蛋白酶活化因子(Apaf)-1/Caspase-9兩種信號通路誘導細胞凋亡;FHIT蛋白具有顯著的抑癌作用,但其作用機制尚不明確,有研究[11-12]認為與FHIT具有二腺苷三磷酸(Ap3A)水解酶、mRNA脫帽、形成FHIT底物復合物等多種因素有關。而Apollon可促進Caspase-9降解,從而抑制凋亡進程;兩者可能存在負調節及相互抑制的關系。本研究發現,CRC組織中FHIT與Apollon蛋白表達存在較微弱的負向關聯性。
禹志韞等[13]研究發現,FHIT陽性宮頸癌患者1 a生存率明顯高于FHIT陰性患者,提示FHIT與腫瘤預后關系密切。吳玨堃等[14]采用小干擾RNA法敲低乳腺癌MCF-7細胞Apollon基因,結果顯示低表達Apollon基因的乳腺癌細胞對順鉑的敏感性增強,提示Apollon與腫瘤治療轉歸關系密切。本研究經Kaplan-Meier生存分析發現,FHIT陰性表達(FHIT-Apollon+、FHIT-Apollon-)患者的預后均差于陽性表達(FHIT+Apollon+、FHIT+Apollon-)者;Apollon陽性表達(FHIT-Apollon+)患者預后差于陰性表達(FHIT+Apollon-)者;進一步證實FHIT蛋白低表達和Apollon蛋白高表達不利于CRC的預后轉歸。
綜上所述,FHIT和Apollon蛋白在CRC組織中的表達呈負相關,兩者的表達與CRC侵襲、轉移及預后關系密切,可作為預測CRC轉移及預后的可靠標志物;臨床上可通過靶向調控FHIT與Apollon的表達,調控CRC細胞增殖、轉移等過程。本研究的不足之處在于,納入研究對象較少,隨訪時間較短。我們進一步將擴大樣本量,開展多中心、高質量隨機對照研究,以證實本研究結果的穩定性和正確性,為CRC臨床治療提供一定理論依據。

