巧借鄉(xiāng)土素材 助推實驗創(chuàng)新 提升學(xué)科素養(yǎng)
史培艷


摘要:為探究碳酸鈉、碳酸氫鈉與酸反應(yīng)的劇烈程度的本質(zhì),引導(dǎo)鄉(xiāng)村學(xué)生巧借鄉(xiāng)土素材,利用實驗室儀器紐裝實驗裝置進(jìn)行實驗探究;通過文獻(xiàn)查閱,實驗創(chuàng)新,融合布倫斯特酸堿理論、堿平衡常數(shù)、路易斯酸堿理論、路易斯堿結(jié)構(gòu)等分析CO3-、HC03與H+結(jié)合能力的證據(jù)。宏觀實驗、微觀分析、證據(jù)推理等相結(jié)合,得出碳酸氫鈉與酸反應(yīng)產(chǎn)生氣泡劇烈程度強于碳酸鈉,碳酸氫鈉與質(zhì)子結(jié)合能力弱于碳酸鈉。
關(guān)鍵詞:鄉(xiāng)土素材;實驗創(chuàng)新;化學(xué)學(xué)科核心素養(yǎng);碳酸鈉;碳酸氫鈉
文章編號:1008-0546( 2020)08-0082-05
中圖分類號:C632.41
文獻(xiàn)標(biāo)識碼:B
doi: 10.3969/j.issn. 1008-0546.2020.08.023
化學(xué)實驗是化學(xué)教學(xué)重要手段,是課堂探究主要活動,是開展“素養(yǎng)為本”教學(xué)最有效的形式。教師通過引導(dǎo)學(xué)生創(chuàng)新實驗,能激發(fā)學(xué)生學(xué)習(xí)化學(xué)興趣,培養(yǎng)學(xué)生觀察、質(zhì)疑、思考、分析、比較、抽象、概括等思維能力,促進(jìn)學(xué)生學(xué)習(xí)方式改變,進(jìn)一步提升學(xué)生化學(xué)學(xué)科核心素養(yǎng)。
一、問題的提出
1.教材中實驗
《碳酸鈉的性質(zhì)與應(yīng)用》是蘇教版《化學(xué)1》中專題2第二單元重點內(nèi)容之一,其中碳酸鈉、碳酸氫鈉性質(zhì)比較是本節(jié)課重點。如圖1裝置,將滴管中的濃鹽酸加入瓶中,觀察實驗現(xiàn)象。教材中Na2C03、NaHC03與酸反應(yīng)對比的觀點是“都放出C02氣體,但NaHC03與酸反應(yīng)的劇烈程度強于Na2C03”[1]。
存在問題是使用濃鹽酸與未知濃度的碳酸鈉、碳酸氫鈉溶液反應(yīng),可能會出現(xiàn)反應(yīng)劇烈程度相似的現(xiàn)象,導(dǎo)致無法進(jìn)行性質(zhì)比較。
2.學(xué)生的疑惑
《普通高中化學(xué)課程標(biāo)準(zhǔn)(2017年版)》要求對碳酸鈉與碳酸氫鈉的性質(zhì)進(jìn)行比較學(xué)習(xí)[2]。在比較學(xué)習(xí)過程中,有的學(xué)生疑惑:“同濃度Na2C03溶液的pH大于NaHCO3溶液的pH,說明Na2CO3與水電離的H+結(jié)合能力強于NaHCO3,Na2CO3、NaHCO3與酸反應(yīng)實質(zhì)是C03-、HCO3與酸電離出的H+反應(yīng),則CO2-與H+反應(yīng)快,即Na2CO3與酸反應(yīng)的劇烈程度強于NaHCO3,只是微觀上反應(yīng)快肉眼看不到而已”。Na2CO3、NaHCO3與酸反應(yīng)的劇烈程度具體是指什么?
3.研究的現(xiàn)狀
通過文獻(xiàn)查閱,了解到很多一線教師對碳酸鈉、碳酸氫鈉與酸反應(yīng)進(jìn)行實驗探索,對實驗裝置進(jìn)行改進(jìn),改進(jìn)的主要幾種類型裝置及實驗結(jié)論見表l。
4.本文的目的
自從波意耳提出現(xiàn)代化學(xué),多數(shù)化學(xué)家認(rèn)為“化學(xué)是一門以實驗為基礎(chǔ)的科學(xué)”。著名的化學(xué)教育家戴安邦先生也說過:“化學(xué)實驗教學(xué)是實施全面的化學(xué)教育的一種最有效的教學(xué)形式。”然而,量子化學(xué)的發(fā)展將化學(xué)帶入新時代,中科院上海有機所退休研究員、博導(dǎo)陳敏伯說:“化學(xué)不再是純實驗化學(xué)。”[15]通過本實驗創(chuàng)新、理論搜集、數(shù)據(jù)分析,讓學(xué)生了解化學(xué)是“實驗、理論、計算”于一身的科學(xué)。
鄉(xiāng)村中學(xué)沒有先進(jìn)的傳感器,更沒有能體現(xiàn)粒子之間反應(yīng)的設(shè)備。為了反映碳酸鈉、碳酸氫鈉與酸反應(yīng)情況及反應(yīng)本質(zhì),本研究目的是(1)利用實驗室的儀器、藥品和鄉(xiāng)土素材進(jìn)行實驗創(chuàng)新,在實驗過程中,學(xué)生仔細(xì)觀察并描述實驗現(xiàn)象,總結(jié)實驗結(jié)論;(2)搜集相關(guān)數(shù)據(jù)、理論、微觀結(jié)構(gòu)等證據(jù),分析碳酸鈉、碳酸氫鈉與酸反應(yīng)本質(zhì),從宏觀和微觀角度準(zhǔn)確描述反應(yīng)的劇烈程度是指什么;(3)通過宏觀實驗、微觀分析、證據(jù)推理等,提升學(xué)生化學(xué)學(xué)科核心素養(yǎng),見圖2。
二、實驗創(chuàng)新
1.實驗儀器及藥品
軟塑料藥瓶、注射器、輸液管、輸液用開關(guān)、紗布、用完的圓珠筆芯、鐵架臺、表面皿。
0.2mol/L碳酸鈉溶液、0.2mol/L碳酸氫鈉溶液、1.0mol/L檸檬酸溶液、飽和碳酸鈉溶液、飽和碳酸氫鈉溶液、酚酞、溴百里香酚藍(lán)、502膠水。
2.實驗裝置
改進(jìn)后的實驗裝置(圖3):用軟塑料藥瓶作反應(yīng)器,用部分輸液管和圓珠筆芯做導(dǎo)管,導(dǎo)管上套醫(yī)用開關(guān)。導(dǎo)管有長短兩種,長導(dǎo)管伸入塑料藥瓶中,下端靠近塑料瓶底部,滴加檸檬酸溶液用;短導(dǎo)管剛伸人塑料瓶口,導(dǎo)氣用;導(dǎo)管另一端連接注射器。將裝置固定在鐵架臺上。
3.實驗操作及現(xiàn)象
(1)加料:向塑料藥瓶中加入約60.0mL 0.2mol/L碳酸鈉、碳酸氫鈉溶液,滴加2滴酚酞(酚酞變色pH范圍:←無色=8.2-粉紅-10.0-紅色→)。碳酸鈉、碳酸氫鈉溶液分別呈玫瑰紅、粉色。內(nèi)側(cè)注射器分別取約30.0mL 1.0mol/L檸檬酸溶液,并使長導(dǎo)管充滿檸檬酸,趕走長導(dǎo)管中空氣,此時注射器中液面刻度值約為29.5mL。
(2)趕氣:關(guān)上連接裝有鹽酸注射器導(dǎo)管上的開關(guān),打開連接用于收集氣體注射器導(dǎo)管上的開關(guān),擠壓塑料瓶,趕走空氣,關(guān)上開關(guān)。塑料瓶未恢復(fù)到原來形狀,說明裝置的氣密性很好。
(3)粘布并染布:取下外側(cè)2支用于收集氣體的注射器的活塞,在活塞分別用502膠水粘上等大的白色紗布條。表面皿上加入約2mL飽和碳酸鈉、碳酸氫鈉溶液,并滴加2滴溴百里香酚藍(lán),溶液分別呈藍(lán)紫色、藍(lán)色;將活塞上紗布分別浸泡在藍(lán)紫色、藍(lán)色溶液中。染色后,將活塞和紗布一起塞人注射器中,把活塞推至底部,趕走空氣,連接導(dǎo)管。過程如圖4。
(4)加酸:打開所有開關(guān),同時向反應(yīng)器中緩慢加入約1.0mol/L檸檬酸(不揮發(fā),制得CO2較純),反應(yīng)器中粉色消失快,并快速產(chǎn)生氣泡,反應(yīng)器鼓起,收集氣體的注射器活塞上移,藍(lán)色紗布(增大溶液與氣體的接觸面)快速變?yōu)榫G色后變?yōu)辄S色;另一反應(yīng)器中玫瑰紅逐漸變淺至無色,先無氣泡,后產(chǎn)生氣泡,反應(yīng)器緩慢鼓起,注射器中活塞緩慢上移,上移到頂后又緩慢下移,紗布條由藍(lán)紫色先變?yōu)樗{(lán)色,后藍(lán)色變?yōu)榫G色,上邊綠色變黃。如圖5。
(5)紗布變色分析:溴百里香酚藍(lán)也稱溴麝香草酚藍(lán),是一種酸堿指示劑,變色pH范圍:←黃色-6.0-綠色- 7.6-藍(lán)色→,飽和碳酸鈉溶液和碳酸氫鈉溶液中滴加溴百里香酚藍(lán)分別呈藍(lán)紫色和藍(lán)色。在生物學(xué)中,根據(jù)溴百里香酚藍(lán)色澤差異顯著,顏色由藍(lán)變綠再變黃特點,常用來檢測CO2[16]。外側(cè)注射器中活塞上移快慢不同,裝碳酸氫鈉溶液對應(yīng)外側(cè)注射器活塞上移速度快,且藍(lán)色紗布變綠到黃變化快;裝碳酸鈉溶液對應(yīng)外側(cè)注射器活塞上移速度慢,且藍(lán)紫色紗布變綠慢,過一段時間,因CO2與碳酸鈉溶液反應(yīng),內(nèi)壓減小,活塞又下移一部分。
4.實驗原理及結(jié)論
(1)反應(yīng)器中微觀原理
碳酸鈉、碳酸氫鈉溶液與檸檬酸反應(yīng),實質(zhì)是碳酸根、碳酸氫根水解產(chǎn)生的OH-優(yōu)先與檸檬酸電離的H+反應(yīng),OH-濃度減小,使平衡不斷向水解方向移動,當(dāng)OH-消耗完,HCO3與H+反應(yīng),生成H2CO3,因H2CO3不穩(wěn)定發(fā)生分解生成CO2。碳酸鈉溶液中OH-濃度大,結(jié)合質(zhì)子需要時間偏長,所以,碳酸鈉溶液中紅色褪色慢,產(chǎn)生氣泡慢。
(2)注射器中微觀原理
碳酸鈉溶液與CO2反應(yīng),實質(zhì)是碳酸根水解產(chǎn)生的OH-優(yōu)先與碳酸電離的H+反應(yīng),OH-濃度減小,使平衡不斷向水解方向移動,HCO3不斷增多,OH-被消耗。HCO3與碳酸不反應(yīng),多余的CO2與水反應(yīng),CO2+H2O==H2CO3=HCO3+ H+,碳酸電離程度強于碳酸氫跟水解程度,使溶液由原來堿性變?yōu)槿跛嵝浴?/p>
(3)實驗結(jié)論
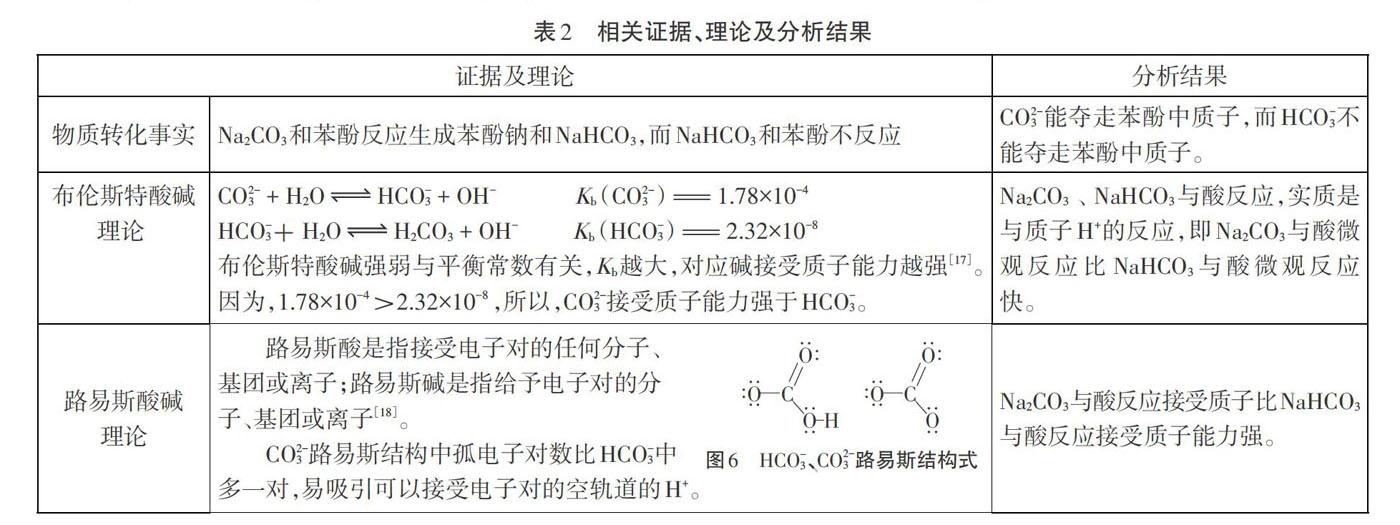
同濃度、同體積的碳酸鈉、碳酸氫鈉溶液同時與酸反應(yīng),NaHCO3與酸反應(yīng)產(chǎn)生氣泡劇烈程度強于Na2CO3。CO3-能奪走H2CO3中H+,而HC03不能奪走H2CO3中H+,說明CO3-結(jié)合H+能力強于HCO3,即Na2C03結(jié)合質(zhì)子劇烈程度強于NaHCO3。 5.證據(jù)推理 根據(jù)物質(zhì)之間轉(zhuǎn)化事實、堿平衡常數(shù)、粒子微觀結(jié)構(gòu)分析,比較Na2CO3、NaHCO3與酸反應(yīng)的本質(zhì)特征(表2)。
6.實驗創(chuàng)新之處
(1)形成封閉體系,使用軟塑料藥瓶,便于擠壓,趕走空氣,打破常規(guī)排空氣法收集氣體。
(2)使用檸檬酸代替鹽酸,CO2氣體中不會有氯化氫氣體,收集的CO2較純。
(3)根據(jù)同時逐次加入檸檬酸,溶液、紗布顏色變化、活塞移動現(xiàn)象,對比性強,便于對比分析宏觀現(xiàn)象差異原因。該實驗裝置實現(xiàn)檸檬酸分別與碳酸鈉、碳酸氫鈉溶液反應(yīng)和CO2與碳酸鈉溶液反應(yīng)的一體化。
(4)根據(jù)布倫斯特酸堿理論即質(zhì)子理論,利用堿常數(shù)分析碳酸鈉、碳酸氫鈉接受質(zhì)子能力;根據(jù)路易斯酸堿理論,利用路易斯結(jié)構(gòu)分析,碳酸鈉、碳酸氫鈉給予電子對的數(shù)量有差異,CO3-路易斯結(jié)構(gòu)中孤電子對數(shù)比HCO3中多一對,CO3-比HCO3更易接受質(zhì)子。利用證據(jù)分析、推理,通過結(jié)構(gòu)模型解釋反應(yīng)本質(zhì),培養(yǎng)學(xué)生證據(jù)推理與模型認(rèn)知素養(yǎng)。
(5)根據(jù)宏觀辨識和微觀探析,得出碳酸氫鈉與酸反應(yīng)產(chǎn)生氣泡劇烈程度強于碳酸鈉,但碳酸鈉接受質(zhì)子劇烈程度強于碳酸氫鈉。
三、實驗反思
從生活中學(xué)習(xí)化學(xué),引導(dǎo)學(xué)生把生活知識和理論知識融合進(jìn)行實驗創(chuàng)新,巧借鄉(xiāng)土素材,助推實驗創(chuàng)新對比分析。學(xué)生在真實實驗情境中親身體驗學(xué)習(xí)過程,宏觀上理解物質(zhì)性質(zhì)差異,微觀上掌握了微粒變化的本質(zhì)。文獻(xiàn)與實驗結(jié)合,進(jìn)行深度分析,促進(jìn)學(xué)生學(xué)習(xí)方式轉(zhuǎn)變,實現(xiàn)深度學(xué)習(xí),提升學(xué)生化學(xué)學(xué)科核心素養(yǎng)。
參考文獻(xiàn)
[1]王祖浩.普通高中課程標(biāo)準(zhǔn)試驗教科書-化學(xué)1[M].南京:江蘇教育出版社,2015:51-52
[2] 中華人民共和國教育部.普通高中化學(xué)課程標(biāo)準(zhǔn)(2017年版)[M].北京:人民教育出版社,2018:16
[3]杜麗月.化學(xué)教學(xué)中幫助學(xué)生形成定量認(rèn)識思維的教學(xué)研究——以“碳酸鈉和碳酸氫鈉與酸的反應(yīng)”為例[D].長春:東北師范大學(xué),2013
[4]錢華,姜國峰,呂永秀.巧用實驗創(chuàng)新提升科學(xué)素養(yǎng)——人教版必修1“碳酸鈉和碳酸氫鈉的性質(zhì)”一組創(chuàng)新實驗示例[J].化學(xué)教與學(xué),2016(2):77-78
[5]史淑鳳,碳酸鈉與碳酸氫鈉鑒別創(chuàng)新實驗[J].中學(xué)化學(xué)教學(xué)參考,2017(6):44
[6] 張秋彥,鄭鐵安,馮品鈺.碳酸鈉和碳酸氫鈉與稀鹽酸反應(yīng)速率比較實驗的改進(jìn)[J].教學(xué)儀器與實驗,2010(3):19-20
[7] 潘澤新.《碳酸鈉和碳酸氫鈉與稀鹽酸反應(yīng)實驗改進(jìn)》的探索過程[C].第五屆中國教育技術(shù)裝備論壇獲獎?wù)撐募ㄖ校?014:303
[8]徐慧,顧菲菲.方法與過程并行定量與定性并重——“碳酸鈉與碳酸氫鈉”的教學(xué)設(shè)計[J].化學(xué)教育,2011(11): 18
[9] 曾珍,鮑正榮.利用“手持技術(shù)”比較碳酸鈉和碳酸氫鈉與稀鹽酸反應(yīng)的速率[J].中小學(xué)實驗與裝備,2012(3):58- 59
[10]吳曉紅,任斌,肖敏,馬金剛.利用手持技術(shù)探究碳酸鈉和 碳酸氫鈉與稀鹽酸的反應(yīng)本質(zhì)[J].教學(xué)儀器與實驗,2015(4):32-33
[11]張健,李雪蓮,李欣.探究碳酸鈉和碳酸氫鈉與稀鹽酸反應(yīng)的快慢[J]實驗教學(xué)與儀器,2016( 7/8):61-64
[12]霍愛新,張瑜,王皖娣.應(yīng)用手持技術(shù)探究碳酸鈉和碳酸氫鈉的性質(zhì)[J].化學(xué)教與學(xué),2016(3):88-89
[13]張婷,江軍.比較碳酸鈉、碳酸氫鈉與酸反應(yīng)快慢的新方法[J].實驗教學(xué)與儀器,2017(10):40-41
[14]吳曉紅,肖敏,任斌,馬金剛.利用pH傳感器探究碳酸鈉和碳酸氫鈉與稀鹽酸的反應(yīng)[J].中國教育技術(shù)裝備,2015(6):127-129
[15]陳敏伯.化學(xué)不再是純實驗科學(xué)[J].科學(xué),1999(1):58-61
[16]高海元,淺談溴麝香草酚藍(lán)[J].生物學(xué)教學(xué),2013(10):63
[17][18]曾紹瓊.有機化學(xué)(下冊)[M].北京:高等教育出版社,1993:379,382

