α-二羰基化合物檢測方法的研究進展
楊 陽,劉少靜,焦淑玲,曾寶平,毋 卓,權科佳,何孝文
(西安醫學院藥學院 藥物研究所,陜西 西安 710021)
α-二羰基化合物(α-dicarbonyl compounds,α-DCs),如甲基乙二醛(MGO)、乙二醛(GO)等(圖1),是在體內和體外都能產生的化學和生物活性物質。在體內,α-DCs主要是由一些腸道細菌及人體細胞的代謝產生的,如細胞內的糖酵解、酮體的新陳代謝、蘇氨酸的降解、磷酸丙糖的分裂等[1]。在體外,α-DCs主要存在于一些熱加工(如焙烤或油炸等)食品或者長期儲存的食品中。
α-DCs是一類具有高反應活性的糖化因子,是晚期糖化終產物(AGEs)最重要的前體物質。AGEs與相鄰蛋白上的游離氨基以共價鍵結合的形式形成交聯結構,穩定且不可逆, 導致蛋白質的沉積和淀粉樣變性[2],這也是AGEs涉及多種疾病(糖尿病腎病、糖尿病心肌病、糖尿病動脈粥樣硬化、阿茨海默癥等)發病機制的重要原因[2-4]。醫學檢測發現,以上慢性疾病患者體液(血液、尿液、透析液等)內α-DCs的水平與正常人的相比明顯偏高,這說明α-DCs在體液內濃度的升高很可能與這些慢性疾病的發生發展密切相關。因此,對食品中α-DCs進行檢測可以指導糖尿病患者和正常人健康飲食,防止病情加重或降低患病幾率;而對血清、唾液等生物樣品中α-DCs進行檢測可輔助診斷糖尿病及其并發癥。作者在此對α-DCs的檢測方法進行綜述,并比較不同檢測方法的適用范圍和優缺點。
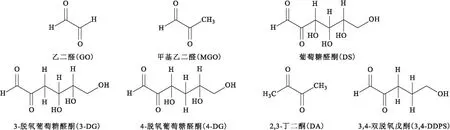
圖1 常見α-DCs的結構式Fig.1 Structure formula of common α-DCs
1 高效液相色譜法(HPLC)
HPLC法分離效率高、選擇性好、檢測靈敏度高、對樣品的適用范圍廣、不受分析對象揮發性和熱穩定性的限制。測定α-DCs較為常用的檢測器有熒光檢測器、紫外檢測器和質譜檢測器。
1.1 高效液相色譜-熒光檢測器聯用(HPLC-FLD)
由于α-DCs本身無固有熒光,直接使用熒光檢測法檢測會比較困難,需要先對α-DCs進行衍生化。
苯甲醛及其衍生物適合作為α-DCs的熒光衍生化試劑。Kishikawa課題組[5]在乙酸銨(CH3COONH4)存在下,向α-DCs溶液中加入4-甲酯基苯甲醛(圖2),改變待測物的檢測特性,以增加其對檢測器的響應,混合后,在100 ℃加熱30 min后用熒光分光光度計對α-DCs進行檢測,或者將混合物裝入HPLC系統再進行定量分析。
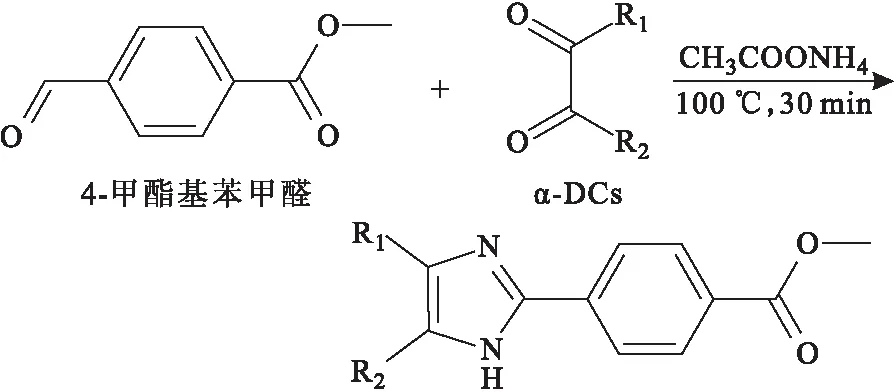
圖2 4-甲酯基苯甲醛與α-DCs的衍生化反應Fig.2 Derivatization reaction between 4-methoxycar-bonylbenzaldehyde with α-DCs
Palomino-Vasco課題組[6]以3,4-二氨基吡啶(3,4-DAP)為衍生化試劑,在90 ℃、pH值為2的條件下進行120 min的衍生化反應(圖3),然后在優化色譜條件下,采用HPLC-FLD法在4 min內即可完成對葡萄酒中α-DCs的檢測。
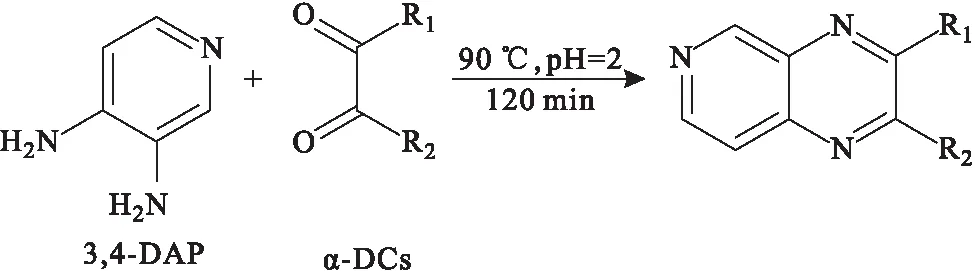
圖3 3,4-DAP與α-DCs的衍生化反應Fig.3 Derivatization reaction between 3,4-DAP with α-DCs
Ogasawara等[7]以1,2-二氨基-4,5-亞甲基二氧苯(DMB)為衍生化試劑,在60 ℃下進行40 min的衍生化反應(圖4),然后采用HPLC-FLD法對人血漿中的MGO進行檢測。結果表明,健康受試者血漿中MGO濃度在0.024~0.258 μmol·L-1之間,日內和日間精密度的RSD值分別為2.55%和4.03%。
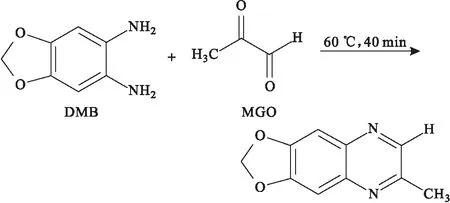
圖4 DMB與MGO的衍生化反應Fig.4 Derivatization reaction between DMB with MGO
Wrobel課題組[8]以4-甲氧基鄰苯二胺(4-MPD)為衍生化試劑、二乙基乙二醛(DEGO)為內標物,采用HPLC-FLD法測定尿液中GO、MGO和DA,GO、MGO、DA的檢測限分別為0.46 μg·L-1、0.39 μg·L-1、0.28 μg·L-1,日內精密度的RSD值小于6%。
1.2 高效液相色譜-紫外檢測器聯用(HPLC-UV)
α-DCs是一類高度水溶且缺乏發色團的化合物,可以通過對α-DCs的衍生化,引入一些具有紫外吸收的基團,從而提高其可檢測性和檢測靈敏度[9]。鄰苯二胺(OPDA)是一種較好的衍生化試劑,可與α-DCs形成喹喔啉類化合物(圖5),而喹喔啉的結構具有穩定性好、紫外吸收靈敏等特點,可以通過HPLC-UV法進行檢測[10]。如Ta?bi等[11]在測定牛血清中的MGO時,先用OPDA將血清中的MGO衍生化為2-甲基喹喔啉,再以乙腈-0.2%乙酸水溶液為流動相進行梯度洗脫,采用RP-HPLC法進行檢測。

圖5 OPDA與α-DCs的衍生化反應Fig.5 Derivatization reaction between OPDA with α-DCs
由于OPDA在衍生化時需要加熱或長時間孵育并且在酸性條件下進行,會影響樣品中α-DCs的實際含量,從而使得檢測結果不太準確。于是Wang等[12]在分析測定血漿中α-DCs時,以新合成的4-(2,3-二甲基-6-喹喔啉基)-1,2-苯二胺(DQB)為衍生化試劑(圖6),在弱堿性條件下不加熱進行衍生化。比較發現,DQB和OPDA的衍生化產物無明顯差異,說明堿性條件對檢測結果沒有影響。在此基礎上, Wang等[13]以 DQB為衍生化試劑,對Ⅱ型糖尿病患者唾液中的3-DG、GO、MGO、DA、戊烷-2,3-二酮(PD)進行了定量分析,發現5種α-DCs含量的RSD值為0.34%~4.64%,回收率為80.26%~100.63%。

圖6 DQB與α-DCs的衍生化反應Fig.6 Derivatization reaction between DQB with α-DCs
1.3 高效液相色譜-質譜檢測器聯用(HPLC-MS)
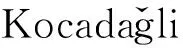
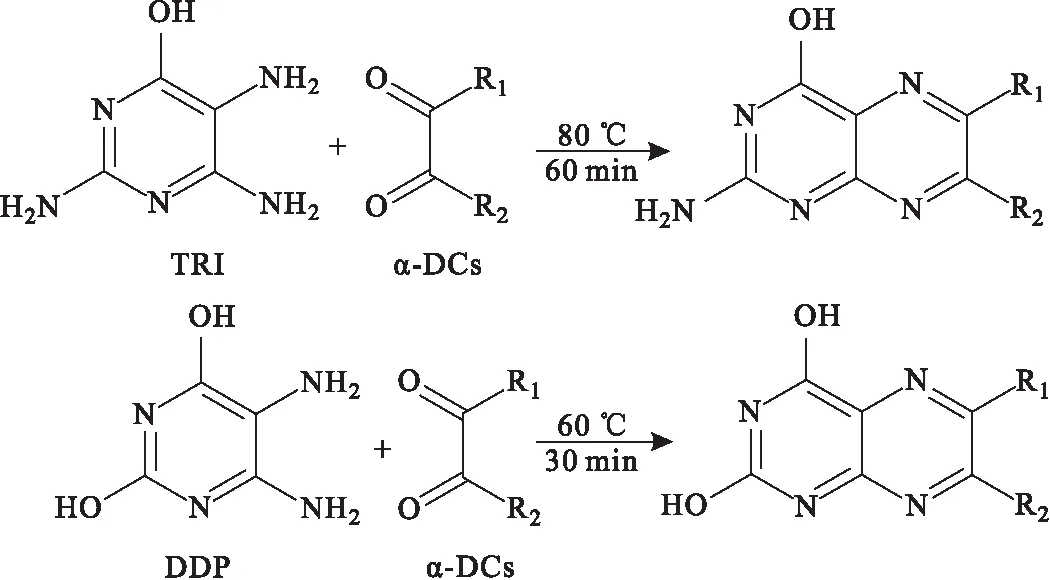
圖7 TRI、DDP分別與α-DCs的衍生化反應Fig.7 Derivatization reaction between TRI,DDP with α-DCs
高效液相色譜-串聯質譜法(HPLC-MS/MS)在α-DCs的定量分析中也有廣泛應用。Henning等[17]采用LC-MS/MS法檢測血樣中的15種α-DCs、2種α-酮羧酸,衍生化反應在氬氣環境中進行,以避免氧氣環境下產生新的α-DCs。Gensberger-Reigl等[18]采用UHPLC-DAD-MS/MS法對艾考糊精中的3,4-DDPS、3-DG、4-DG等α-DCs和5-羥甲基糠醛(5-HMF)進行檢測。通常情況下,需先將樣品中的5-HMF與葡萄糖的降解產物分開,再進行檢測,Gensberger-Reigl等則使用OPDA將5-HMF衍生化為苯并咪唑衍生物進行平行分析,操作簡便、分析快速、誤差較小。陳榮祥等[19]采用HPLC-MS/MS法對木瓜飲料中GO、MGO、DA進行檢測,3種化合物在0.012~0.900 mg·L-1范圍內線性關系良好(R2>0.99),檢測限分別為5.3 μg·L-1、3.1 μg·L-1、3.5 μg·L-1,平均加標回收率為86.26%~95.29%,RSD值為2.49%~7.31%。
2 氣相色譜法(GC)
GC是以氣體為流動相的色譜方法,主要用于分離分析易揮發的物質,具有效率高、靈敏度高、選擇性高等優點。由于α-DCs屬于中間體,反應活性高、不穩定,因此在用GC法檢測時需要對其進行衍生化以提高其穩定性。最常用的衍生化試劑是OPDA。氣相色譜聯用氫火焰離子化檢測器(FID)、電子捕獲檢測器(ECD)等是目前檢測α-DCs的重要方法。
2.1 氣相色譜-氫火焰離子化檢測器(GC-FID)
FID是一種質量型檢測器,一般只對含碳元素的化合物具有靈敏度高、響應快、噪音小等優點。Khuhawar等[20]以1,2-二氨基丙烷(DAP)為衍生化試劑來測定MGO和DA(圖8),由于衍生化需在pH值為3的環境中進行,且反應運行時間太短(4.6 min),導致目標峰與雜質峰不能有效分離。王晨等[21]以OPDA為衍生化試劑,建立了同時在線檢測MGO和GO的GC法,OPDA用量為二羰基化合物的67倍,衍生化時間為10 min,MGO和GO的定量限分別為0.06 mg·L-1和0.08 mg·L-1,檢測限分別為0.02 mg·L-1和0.03 mg·L-1,方法靈敏度高。

MGO:R1=CH3,R2=H;DA:R1=CH3,R2=CH3
2.2 氣相色譜-電子捕獲檢測器(GC-ECD)
ECD是一種濃度型檢測器、離子化檢測器,只對含有強電負性元素的化合物具有高選擇性和高靈敏度。OSHA Method 1012[22]是以鄰五氟芐基羥胺鹽酸鹽(PFBHA)為衍生化試劑(圖9),通過硅膠管-GC-ECD來檢測二乙酰基化合物,該方法以兩個串聯的專門干燥的硅膠管來收集DA,代替了NIOSH Method 2557法[23]中的Anasorb碳分子篩(CMS)吸附劑管和OSHA Method PV2118法[24]中的硅膠管,從而解決了使用單個硅膠管所遇到的遷移問題。
2.3 氣相色譜-氮磷檢測器(GC-NPD)
氮磷檢測器(NPD)是一種質量檢測器,對含氮、磷元素的化合物具有高靈敏度和高選擇性。由于喹喔啉類化合物含氮元素,因此Jiang等[25]以2-甲基吡嗪(500 mg·L-1)-乙酸乙酯溶液為內標,以OPDA為衍生化試劑,通過固相萃取-GC-NPD來檢測α-DCs,12種商業軟飲料中的總α-DCs為5.75~50.72 μg·mL-1,DA的檢測限為0.3 ng·mL-1,回收率為75.6%~106.3%。Stephanie等[26]使用OPDA處理過的硅膠管代替固相萃取進行樣品前處理,DA的檢測限為7 ng·mL-1,回收率達到95%以上,與Jiang等的方法相比靈敏度較低,但準確度高、穩定性好,且解決了NIOSH Method 2557法[24]中的濕度問題,可以檢測其它方法難以檢測的化合物。
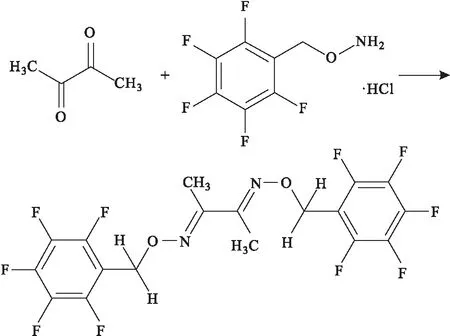
圖9 PFBHA與二乙酰基化合物的衍生化反應Fig.9 Derivatization reaction between PFBHA with diacetyl compounds
2.4 氣相色譜-質譜聯用(GC-MS)
GC-MS是目前發展最完善、應用最廣泛的聯用儀器,具有靈敏度高、檢測范圍廣等優點。LeBouf等[27]用質譜儀代替FID,通過硅膠管-氣相色譜-選擇性離子監測(SIM)條件下的質譜聯用來檢測DA,與OSHA Method 1013/1016法相比,定量限降低6.2~6.6倍。Lim 等[28]以2,2,2-三氟乙基肼(TFEH)為衍生化試劑,采用頂空固相微萃取(HS-SPME)-GC-MS法對酒精飲料和發酵食品中GO和MGO進行檢測,樣品中只有揮發性化合物被固相微萃取(SPME)送到GC系統,而非揮發性干擾物質留在小瓶中,GC-MS的SIM可以獲得低干擾峰,GO和MGO的檢測限分別為0.001 1 μg·mL-1、0.000 7 μg·mL-1,定量限分別為0.003 6 μg·mL-1、0.002 1 μg·mL-1,RSD值均小于8%。
3 離子色譜法(IC)
IC使用裝有離子交換樹脂的分離柱進行分離,使用電導檢測器(ELCD)進行檢測,ELCD對含鹵、硫、氮元素的化合物具有高選擇性和高靈敏度。王永梅等[29]在堿性條件下使GO與過氧化氫反應生成草酸根(圖10),然后使用IC法測定煙用紙張中GO的含量,檢測限為5.0×10-5μg·mL-1,具有靈敏度高、重現性好、有機溶劑使用量少等優點。
圖10 GO與過氧化氫反應生成草酸根Fig.10 GO reacts with hydrogen peroxide to form oxalate
4 紫外分光光度法
衛佳歡等[30]和劉卓欽等[31]采用紫外分光光度法測定生活用紙中GO的含量,以水為提取溶液,GO與2-亞肼基-2,3-二氫-3-甲基苯并噻唑鹽(HMBT)在乙酸溶液中80 ℃下反應生成一種黃色化合物(圖11),然后使用紫外分光光度計測定405 nm處吸光度。與其它方法相比,紫外分光光度法不需要繁瑣的衍生化條件,而且操作簡便,實用性強。
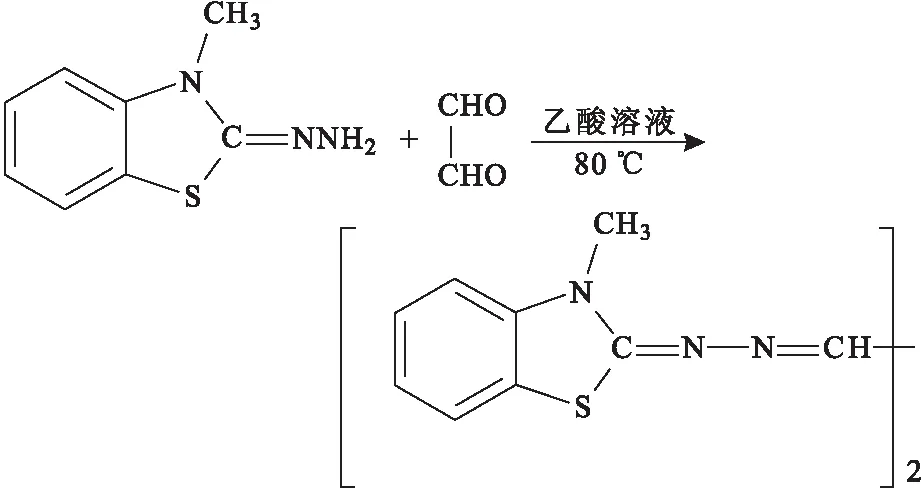
圖11 GO與HMBT的反應Fig.11 GO reacts with HMBT
5 傳感器檢測法
傳感器的工作原理是把化學能轉變為電能,從而使檢測方便、快速、有效地進行。多種傳感器技術可應用于MGO的分析檢測,包括熒光傳感技術、電化學傳感技術等。Wang等[32]開發了一種熒光傳感器(甲基二氨基苯-bodipy,MBo),可以在生理條件下檢測MGO。MBo利用了OPD對MGO的反應性,同時通過調節熒光團和芳基部分的電子特性來克服喹啉的缺電子性質。MBo對MGO的選擇性優于其它生物學相關的二羰基類化合物,且對低濃度(50 nmol·L-1)的MGO也很敏感,適用于檢測復雜環境中的MGO,包括活細胞環境。
Wu等[33]成功設計了一種基于羧化功能化多壁碳納米管(MWCNTs-COOH)與羧甲基纖維素(CMC)和殼聚糖納米圈(CSN)共功能化的納米復合傳感器,用于新西蘭麥努卡蜂蜜中MGO的簡單、低成本、高靈敏度的伏安識別和測定。CSN-CMC粘附在MWCNTs-COOH表面;納米復合傳感器表現出較大的電化學有效面積及優異的電催化活性,線性范圍為5×10-8~8×10-4mol·L-1,檢測限為9.6×10-9mol·L-1,在優化條件下具有良好的穩定性和選擇性。
6 結語
α-DCs是AGEs的重要前體物質,而AGEs是糖尿病并發癥的重要發病機制之一。對生物樣本中α-DCs的檢測有助于對糖尿病腎病、糖尿病心肌病、糖尿病動脈粥樣硬化等糖尿病并發癥的發病機制的研究,并對糖尿病的輔助診斷具有一定意義。對食物中α-DCs的檢測能夠指導糖尿病患者和正常人健康飲食,有效控制外源性α-DCs的攝入量。可見,α-DCs的檢測在臨床診斷、代謝、藥物研究等方面具有重要作用。
α-DCs的檢測方法中,應用最廣泛的是HPLC和GC。色譜分析前,需要進行衍生化處理,OPDA是使用最廣泛的衍生化試劑,4-MPD和DQB作為其衍生化產物也被用作衍生化試劑測定α-DCs;此外,其它鄰二氨基化合物,如DAP、3,4-DAP、DDP也可用于α-DCs的柱前衍生化;羥胺、肼等含氨基化合物(2,2-三氟乙肼、鄰五氟芐基羥胺鹽酸鹽等)也可作為衍生化試劑。傳感器技術檢測α-DCs可以避免或縮短復雜樣品前處理及衍生化過程,排除樣品中有色物質的干擾,較現有基于色譜學的檢測方法更快、更省時,可用于測定復雜樣品中的α-DCs,在臨床和基礎科學研究及實踐中具有潛在的應用價值。

