叢枝菌根真菌對黃花蒿生長和根系分泌物化學組成的影響
孫晨瑜 曾燕紅 馬俊卿 劉璐 王文奇 黃京華
摘 ?要:研究盆栽條件下,接種與未接種叢枝菌根真菌(arbuscular mycorrhizal fungi,AMF)摩西球囊霉(Glomus mosseae)對黃花蒿(Artemisia annua L.)生長和根系分泌物化學組成的影響。結果表明,接種AMF黃花蒿的株高、苗干重和根干重均顯著增加,增幅均達到20%以上;接種AMF也改善了黃花蒿的根系形態,除了根系半徑以外,根長增加了87.0%、根表面積增加了97.0%、根體積增加了10.7%、根尖數增加了38.4%、根分叉數增加了75.6%、根系活力提高了19.6%,差異均達到極顯著水平;與未接種AMF的黃花蒿基質中的根系分泌物(NM-S)相比,接種AMF下黃花蒿基質中的根系分泌物(AM-S)可溶性蛋白含量增加了74.38%,可溶性糖含量增加了16.13%,游離氨基酸含量增加了203%,有機酸的種類增多且含量顯著提高;但接種AMF對黃花蒿水培液中根系分泌物含量的影響卻呈現出了相反的作用。說明接種AMF有助于改善黃花蒿的根系形態,提高根系活力,在基質中促進根系分泌物的分泌,從而使黃花蒿汲取更多養分、提高生物量。
關鍵詞:叢枝菌根真菌;黃花蒿;根系分泌物
中圖分類號:S567.2 ? ? ?文獻標識碼:A
Abstract: The effects of arbuscular mycorrhizal fungi (AMF) Glomus mosseae on the growth index and the root exudates chemical composition of Artemisia annua L. were studied under potted conditions. The results showed that the height, shoot dry weight and root dry weight of A. annua inoculated with AMF increased significantly, with an increase of more than 20%; in addition to root radius, root length, root surface area, root volume, tips, forks and root activity of A. annua increased by 87.0%, 97.0%, 10.7%, 38.4%, 75.6% and 19.6%, respectively; compared with the root exudates obtained from the matrix of A. annua without AMF inoculation (NM-S), the content of soluble protein, soluble sugar and free amino acid in the root exudates obtained from matrix of A. annua with AMF inoculation (AM-S) increased by 74.38%, 16.13% and 203%, respectively, following the types and contents of organic acids increased significantly; but the effects of AMF on the root exudates of hydroponic solution showed an opposite trend. In the substrate, AMF may improve root morphology, root activity and secretion of the root exudates so that A. annua could absorb more nutrients and improve its biomass.
Keywords: arbuscular mycorrhizal fungi; Artemisia annua L.; root exudates
DOI: 10.3969/j.issn.1000-2561.2020.09.016
植物通過合成和釋放根系分泌物對周圍環境產生影響,目前已發現超過10萬種植物次生代謝物質[1]。在自然界中,根系分泌物在植物種內和種間相互關系、群落演替和生物入侵等領域的重要作用近年來得到了廣泛的關注,成為作物學和生態學領域的研究熱點[2-3]。
黃花蒿(Artemisia annua L.)是一種具有解毒作用的草本植物,20世紀70年代青蒿素被從其體內成功提取分離出來[4]。青蒿素是世界衛生組織認定的治療抗藥性瘧疾最有效的治療藥物,其也被證明有抗腫瘤特性[5]。由于青蒿素人工合成的生產成本很高,因此,目前仍然需要從黃花蒿中提取,而黃花蒿的野生資源已不能滿足大量提取的需要,主要依靠人工栽培來生產。如何提高人工栽培黃花蒿的產量和質量就成為值得深入研究的問題。叢枝菌根真菌(arbuscular mycorrhizal fungi,AMF)在農業生產上的應用越來越受到重視,而且相關領域的研究越來越透徹,或許能應用于黃花蒿的人工栽培。AMF是一類非常常見的內生真菌,能同陸地80%以上的植物形成互惠共生體[6-7]。AMF侵染宿主植物根系之后,可以從宿主中汲取它自身代謝所需的碳源,與此同時,還能促進植物對土壤中營養成分的吸收,改善根系分泌活動,進而有利于植物的生長、增強植物的抗逆性[8-9]。Stefanowicz等[10]研究發現紅薔薇的入侵伴隨著土壤中AMF生物量的增加,植物根系的次生代謝產物含量顯著增加。Chen等[11]發現,在營養脅迫下,接種AMF摩西球囊霉(Glomus mosseae)可以改善甘草根系結構、提高類黃酮化合物的積累以及植物對P、K、Mg、Cu、Zn和Mn的吸收。黃京華等[12]研究表明,接種摩西球囊霉使黃花蒿吸收更多的N、P和K,促進其光合作用,增加青蒿素含量。但是,AMF促進黃花蒿養分吸收的機理還不清楚,是否與叢枝菌根共生介導的根系分泌物變化有關,有待進一步開展研究。
本文通過對黃花蒿接種AMF,探討叢枝菌根共生對黃花蒿根系分泌物的影響,對揭示AMF促進黃花蒿養分吸收的機理有重要意義,并可為黃花蒿的生產提供理論依據。
1 ?材料與方法
1.1 ?材料
1.1.1 ?材料與試劑 ?供試黃花蒿為‘酉青1號,種子購自重慶市富民青蒿科技有限公司。叢枝菌根真菌菌種為摩西球囊霉(Glomus mosseae),購自中國叢枝菌根真菌種質資源庫(Bank of Glomeromycota in China,BGC,編號NM02A),由本實驗室用盆栽沙培法擴繁。供試的培養基質:河沙(購自本地建材市場)、泥炭(丹麥Pindstrup公司)。乳酸、乙酸、甲酸、蘋果酸、酒石酸、草酸、檸檬酸對照品,均購自Sigma公司。
1.1.2 ?儀器與設備 ?UV-2450紫外-可見分光光度計(日本島津),Expression 11000xl根系掃描儀(日本Epson),PH100-DB800U-IPL光學顯微鏡(江西鳳凰數碼),Dionex ICS-5000離子色譜儀(美國Thermo Fisher)。
1.2 ?方法
1.2.1 ?盆栽試驗設計 ?試驗設2個處理:即接種叢枝菌根真菌摩西球囊霉(以AM表示)和未接種叢枝菌根真菌(以NM表示)。采用盆栽,以河沙和泥炭(體積比4:1)為培養基質。河沙過3 mm篩后,自來水流動沖洗,干燥后置于高壓蒸汽滅菌鍋121 ℃高溫濕熱滅菌1 h,以滅活基質中原本可能含有的叢枝菌根真菌及其孢子,冷卻后備用。將黃花蒿種子用10% H2O2浸泡消毒2 min,蒸餾水沖洗3遍,室溫干燥備用。塑料花盆用0.1%高錳酸鉀溶液浸泡消毒后用自來水沖洗干凈。取冷卻的滅菌河沙作盆栽培養基質,以每盆3 kg的量裝入塑料花盆。接種處理組每盆接種摩西球囊霉菌劑150 g,對照處理組則每盆添加滅菌沙150 g。接種菌劑均勻拌在盆栽培養基質表層,之后將黃花蒿種子均勻播撒在接種菌劑表層,覆蓋一層約1 cm厚度的滅菌基質。播種后立即澆水淋透培養基質。每個處理各20個重復,共40盆,在網室大棚內隨機擺放。播種后到出苗前適時澆水,出苗后每周澆Hoagland營養液2次,每次每盆澆200 mL,并適時澆水。出苗整齊后,間苗,每盆留長勢一致的苗5株。
1.2.2 ?菌根侵染率的測定 ?在盆栽4個月后對黃花蒿進行根系取樣,用直徑為1.0 cm的打孔器,在各盆栽中隨機打孔取根5次。將取出的根系洗凈,用剪刀剪成1.0 cm長的根段,用酸性品紅染色后,鏡檢并計算測定菌根侵染率,至少要觀察200條根段[13]。
1.2.3 ?黃花蒿生長指標的測定 ?從植物根部到最高點測量株高。取完整的黃花蒿,用蒸餾水沖洗掉殘留在根系的盆栽培養基質,用濾紙吸干殘留的水分。使用根系掃描儀進行根系掃描,并用根系分析應用軟件WinRHIZO來分析根系的根長(cm)、根表面積(cm2)、根直徑(mm)、根體積(cm3)、根尖數和根分叉數。將整株黃花蒿置于40 ℃烘箱烘干至恒重,測定黃花蒿的苗干重和根干重。
1.2.4 ?根系活力的測定 ?根系活力的測定參照氯化三苯基四氮唑(TTC)法[14],用紫外-可見分光光度計在485 nm波長下測定。
1.2.5 ?根系分泌物的收集 ?黃花蒿盆栽4個月后,分別收集水培液和殘留在基質中的根系分泌物。
(1)水培液中的根系分泌物收集。從盆中取出整株黃花蒿,用自來水沖洗除去殘留在根系上的盆栽培養基質,盡可能不傷及植株。用冰盒將試驗材料帶回實驗室后,用蒸餾水再沖洗根系3遍,用吸水紙吸干表面水滴,將植株根部放入0.5 mmol/L的CaCl2溶液中過渡30 min,然后轉移至裝有250 mL CaCl2溶液(0.5 mmol/L)的1.7 L遮光塑料容器中,溶液剛好浸沒根系。在充足的光照條件下培養4 h,取出植株后用蒸餾水沖洗其根部3次,沖洗液與水培過植物的CaCl2溶液合并即為黃花蒿水培液根系分泌物,此溶液用真空抽濾裝置過0.22 μm的水系濾膜,過濾后的溶液保存在20 ℃的冰箱中,備用。接種與未接種AMF下黃花蒿水培液中的根系分泌物樣品分別標記為AM-W、NM-W。
(2)基質中的根系分泌物收集。把盆栽的黃花蒿植株取出,去除盆中培養基質里的殘根,稱取50.0 g的培養基質轉移至150 mL的錐形瓶中,加入去離子水100 mL振蕩浸提24 h,溶液經雙層濾紙過濾2次,再用真空抽濾裝置過0.22 μm的水系濾膜,過濾后的溶液保存在20 ℃的冰箱中,備用。接種與未接種AMF下黃花蒿基質中的根系分泌物分別標記為AM-S、NM-S。1.2.6 ?根系分泌物中可溶性蛋白、可溶性糖和游離氨基酸含量的測定 ?將收集到的根系分泌物用旋轉蒸發儀蒸干,加10 mL滅菌超純水溶解后用于測定可溶性蛋白、可溶性糖和游離氨基酸的含量。可溶性蛋白含量的測定采用考馬斯亮藍G-250染色法[14];可溶性糖含量的測定采用蒽酮比色法[14];游離氨基酸含量的測定采用茚三酮顯色法[14]。
1.2.7 ?根系分泌物中有機酸的測定 ?將收集的根系分泌物過已活化的陽離子交換樹脂柱,收集洗脫液。洗脫液再用旋轉蒸發儀蒸干,加5 mL滅菌超純水溶解,再經0.45 μm水系濾膜過濾。之后采用離子色譜法[15]測定有機酸(乳酸、乙酸、甲酸、蘋果酸、酒石酸、草酸和檸檬酸)的含量。
1.3 ?數據處理
采用R 3.6.0軟件包對數據進行獨立樣本t檢驗并作圖。
2 ?結果與分析
2.1 ?菌根侵染率的測定結果和AMF對黃花蒿生長的影響
盆栽4個月后,AM菌根侵染率為52.8%,NM黃花蒿未被AMF侵染。由表1可知,與NM相比,AM的株高、苗干重和根干重均顯著增加,增幅均達20%以上。接種AMF也改善了黃花蒿的根系形態,除了根系直徑以外,根長增加了87.1%、根表面積增加了97.0%、根體積增加了10.7%、根尖數增加了38.4%、根分叉數增加了75.6%,根系活力提高了19.6%,與NM黃花蒿相比差異均達到極顯著水平(P<0.01)。結果表明,叢枝菌根真菌能與黃花蒿形成良好的共生關系。叢枝菌根共生提高了黃花蒿的生物量,改善了根系形態并提高了根系活力。根系特性的改變會直接影響到根系分泌物的合成與分泌,基于此,黃花蒿根系分泌物的組成成分及含量也可能隨著根系形態的改善與根系活力的提高而發生改變。
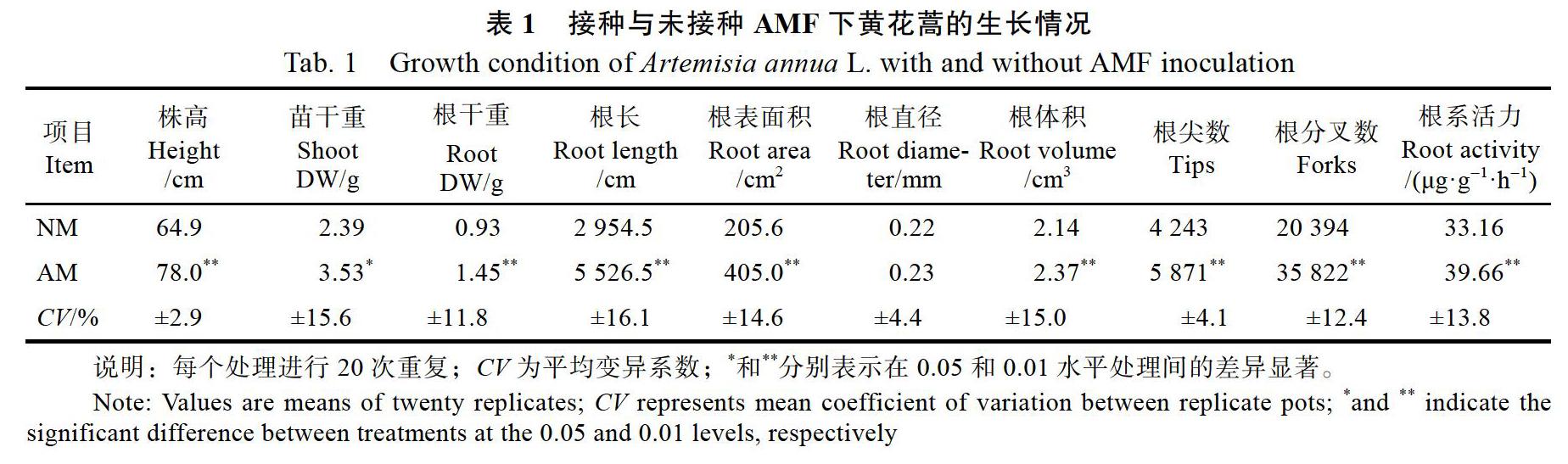
2.2 ?AMF對根系分泌物中可溶性蛋白含量的影響
從圖1可知AMF對黃花蒿根系分泌物中可溶性蛋白含量的影響。接種AMF下黃花蒿水培液中的根系分泌物(AM-W)與未接種AMF下黃花蒿水培液中的根系分泌物(NM-W)相比,可溶性蛋白的含量下降了24.9%,存在極顯著差異(P<0.01);而接種AMF下黃花蒿基質中的根系分泌物(AM-S)可溶性蛋白含量比未接種AMF下黃花蒿基質中的根系分泌物(NM-S)增加了74.38%,二者之間的差異也達到了極顯著水平(P<0.01)。研究結果表明,接種AMF顯著提高了基質根系分泌物中可溶性蛋白的含量,可能會促進黃花蒿根系合成與分泌更多的酶,從而有利于植物從基質中吸收更多的營養物質;在水培條件下,接種AMF對可溶性蛋白含量的影響卻呈現相反的趨勢,原因可能是水培缺氧脅迫對叢枝菌根共生體系極為不利。
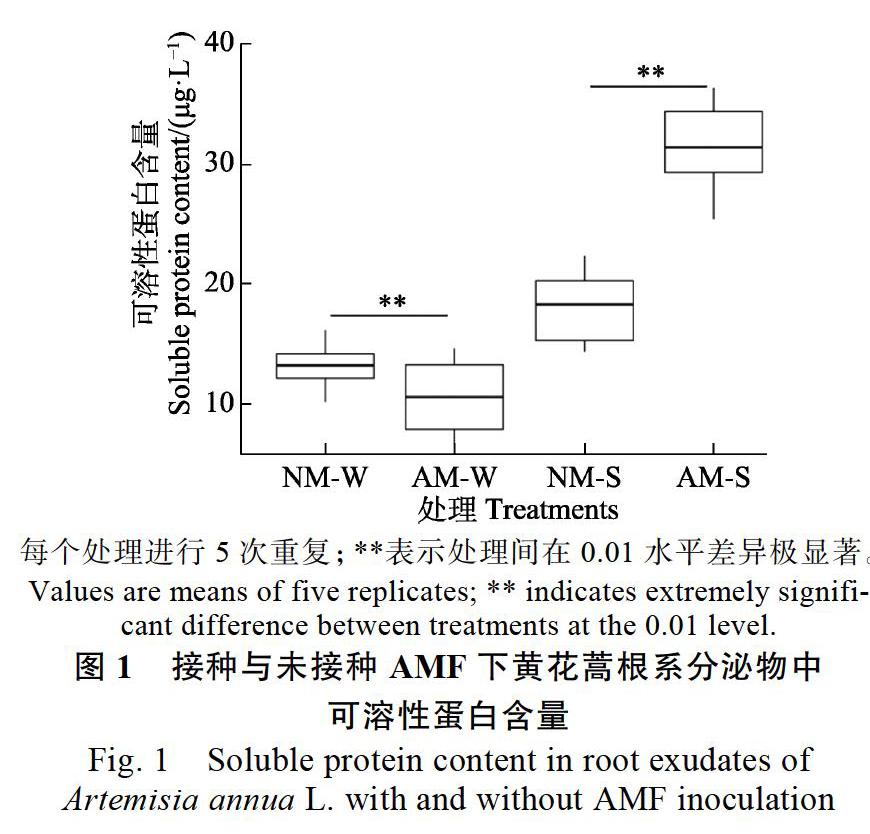
2.3 ?AMF對根系分泌物中可溶性糖含量的影響
由圖2可知,接種AMF下黃花蒿水培液中的根系分泌物(AM-W)可溶性糖含量比未接種處理的(NM-W)少36.83%,兩者存在極顯著差異(P<0.01);而在盆栽條件下,AM-S可溶性糖含量比NM-S多16.13%,兩者之間的差異也達到極顯著水平(P<0.01)。研究結果表明,接種AMF顯著提高了基質根系分泌物中可溶性糖的含量,從而有利于植物向基質中輸送更多的碳源供土壤微生物吸收;而在水培條件下,可能是因為缺氧脅迫對叢枝菌根共生體系不利,導致AM-W可溶性糖含量低于NM-W。
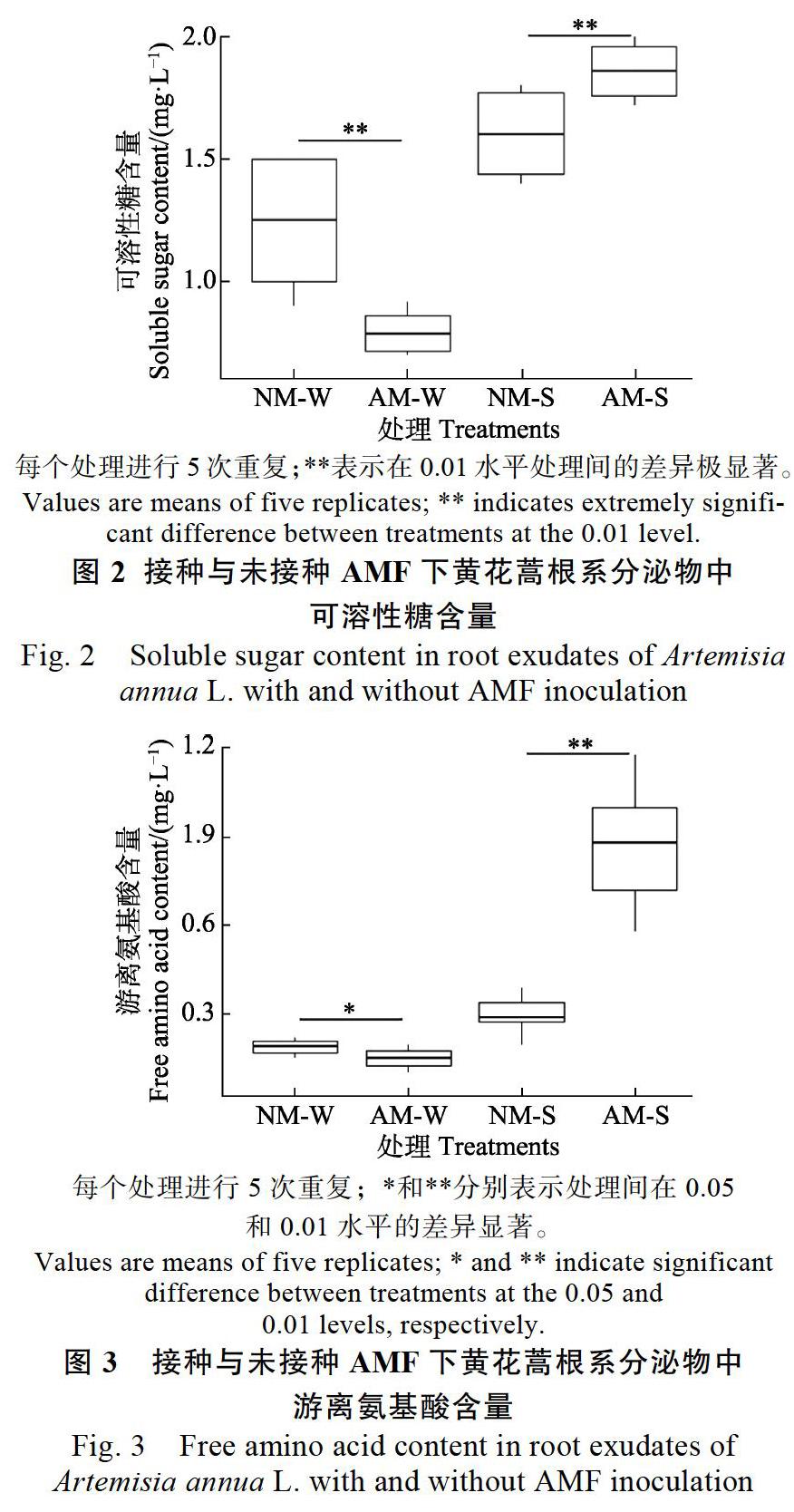
2.4 ?AMF對根系分泌物中游離氨基酸含量的影響
由圖3可知,AM-W游離氨基酸含量比NM-W低3.33%,差異顯著(P<0.05)。而AM-S游離氨基酸含量為NM-S的3.07倍,兩者間的差異達到了極顯著水平(P<0.01)。研究表明,接種AMF顯著提高了基質根系分泌物中游離氨基酸的含量,從而供土壤微生物利用;而在水培條件下,可能是因為缺氧脅迫導致根系分泌物中可溶性糖含量偏低。
2.5 ?AMF對根系分泌中有機酸的影響
從表2可知,黃花蒿接種AMF后,其水培液根系分泌物中有機酸的種類和含量減少;但在盆栽條件下,其基質根系分泌物中有機酸的種類和含量顯著增加,呈現出相反的趨勢。NM-W檢測出7種有機酸,而AM-W只檢測出5種。兩者均檢測到的5種有機酸分別為甲酸、蘋果酸、酒石酸、草酸和檸檬酸,NM-W有機酸的含量均高于AM-W,差異達到了極顯著水平(P<0.01)。有機酸中,草酸的含量最高,NM-W與AM-W的草酸含量分別達72.36、67.65 mg/L。此外,與AM-W相比,NM-W中還檢測到乳酸和乙酸。NM-S只檢測到3種有機酸,而AM-S檢測出4種。兩者均檢測到乳酸、甲酸和草酸,且AM-S中的有機酸含量均高于NM-S,兩者有機酸含量的差異均達到極顯著水平(P<0.01)。AM-S中還檢測到乙酸,而NM-S中未檢測到。結果表明,接種AMF顯著提高了基質根系分泌物中有機酸的含量,有機酸可通過酸化、螯合、離子交換或還原等途徑將難溶性物質轉化為可被植物吸收利用的有效養分,從而提高根際土壤養分的有效性,促進了植物的生長發育。而在水培缺氧的條件下,植物根系分泌大量草酸對根系細胞有毒害作用,AM-W與NM-W相比顯著降低了草酸的含量,表明接種AMF對缺氧脅迫有緩解作用。
3 ?討論
研究表明,植物根系在與鄰近植物和土壤微生物的互作中發揮著重要作用[16]。一方面,根系生物量和形態結構直接影響植物的生長和發育[17-18];另一方面,植物根系也可以合成和分泌化感物質,影響土壤微生物、改變土壤理化性質和抑制周圍其他植物的生長[19-20]。Gealy等[21]利用穩定的13C同位素鑒別分析,發現根尖數和根生物量與水稻根系分泌物含量有重要聯系。Zhu等[22]在車前草根中也觀察到類似的情況,似乎根尖數越多、根系生物量越大越有助于根系分泌物的合成與分泌。在本研究中,黃花蒿接種AMF 4個月后,其根干重、根長、根表面積、根體積、根尖數、根分叉數和根系活力均顯著提高,一方面有利于促進植物對土壤中營養成分的吸收,植株的苗高和苗干重隨之增加,另一方面為根系分泌物的大量合成與分泌提供了基本條件。
可溶性蛋白、可溶性糖和游離氨基酸是植物根系分泌物的重要組成成分,具有調控根系生長以及為土壤微生物提供營養成分和能源物質的功能。AMF能促進植物對土壤中營養成分的吸收,改善根系分泌活動,進而有利于植物的生長、增強植物的抗逆性[8-9]。Feng等[23]研究發現,鹽脅迫下AMF與植物形成共生關系后,顯著增加了根系中可溶性糖的含量,改變了根系的滲透壓,使得植物抵抗鹽害的能力得以增強。包靜[24]研究認為,鹽脅迫的程度以及黃瓜不同的生長時期都會影響根系分泌物中可溶性糖的含量,鹽脅迫同時還會使根系分泌物中氨基酸的含量和種類增加。Ohwaki等[25]研究發現,缺鉀、缺鋅脅迫也會使根系分泌物中的可溶性蛋白、可溶性糖和游離氨基酸的分泌量有所改變。接種AMF可能緩解植物所受的脅迫并提高根系分泌物中可溶性蛋白、可溶性糖和游離氨基酸的含量。本研究發現,接種AMF下的黃花蒿基質根系分泌物中可溶性蛋白、可溶性糖和游離氨基酸的含量均顯著高于未接種AMF處理,這可能是因為AMF與黃花蒿共生后有利于植株吸收更多的營養元素,同時植物根系分泌更多的可溶性蛋白、可溶性糖和游離氨基酸,從而實現了真菌-植物和諧共生。但在黃花蒿水培液根系分泌物中卻呈現出相反的結果,可能是由于水培缺氧的液體環境對植物根系有脅迫作用,且叢枝菌根共生下黃花蒿的根系生物量更大,需氧量更高,受到的脅迫作用更強。其中的原因有待進一步研究。
根系分泌物中的有機酸是良好的金屬活化劑,它們在根際難溶性養分的活化和吸收等方面具有積極作用。在植物根際土壤中,根系分泌物通過酸化、螯合、離子交換或還原等途徑將難溶性物質轉化為可被植物吸收利用的有效養分,從而提高根際土壤養分的有效性,進而促進了植物的生長發育。Dinkelaker等[26]對白羽扇豆的研究中發現,在缺磷時,植物通過形成特殊的排根結構,并在排根處分泌大量的有機酸來活化難溶性磷以滿足自身生長的需要。郭修武等[27]對連作葡萄接種AMF,研究發現AMF對葡萄的生長有促進作用,使葉片中SOD活性增強,MDA的含量降低,根系活力也增強,還提高了葡萄根系分泌物中有機酸的含量。劉進法等[28]研究發現,接種叢枝菌根真菌增加了枳實幼苗根系分泌有機酸的量,有機酸以蘋果酸、檸檬酸和草酸為主。本研究發現,接種AMF下黃花蒿基質根系分泌物中有機酸的含量顯著高于未接種AMF處理,表明接種AMF有利于黃花蒿植株分泌更多的有機酸,從而活化和吸收更多的根際難溶性養分。但在水培液缺氧的液體環境下,草酸的含量顯著升高對黃花蒿根系有毒害作用,而叢枝菌根共生下根系分泌的草酸含量顯著降低,表明AMF有緩解缺氧脅迫的作用。另外,有機酸易降解可能也會對試驗結果產生影響。AMF對黃花蒿根系分泌物的作用機制有待更為深入的研究。
參考文獻
[1] Inderjit, Wardle D A, Karban R, et al. The ecosystem and evolutionary contexts of allelopathy[J]. Trends in Ecology and Evolution, 2011, 26(12): 655-662.
[2] Fernandez C, Monnier Y, Santonja M, et al. The impact of competition and allelopathy on the trade-off between plant defense and growth in two contrasting tree species[J]. Frontiers in Plant Science, 2016, 7: 594.
[3] Zheng Y L, Feng Y L, Zhang L K, et al. Integrating novel chemical weapons and evolutionarily increased competitive ability in success of a tropical invader[J]. New Phytologist, 2015, 205(3): 1350-1359.
[4] Efferth T. From ancient herb to modern drug: Artemisia annua and artemisinin for cancer therapy[J]. Seminars in Cancer Biology, 2017, 46: 65-83.
[5] Li J, Feng W, Lu H, et al. Artemisinin inhibits breast cancer‐induced osteolysis by inhibiting osteoclast formation and breast cancer cell proliferation[J]. Journal of Cellular Physiology, 2019, 234(8): 12663-12675.
[6] Whiteside M D, Digman M A, Gratton E, et al. Organic nitrogen uptake by arbuscular mycorrhizal fungi in a boreal forest[J]. Soil Biology and Biochemistry, 2012, 55: 7-13.
[7] Wipf D, Krajinski F, Tuinen D V, et al. Trading on the arbuscular mycorrhiza market: From arbuscules to common mycorrhizal networks[J]. The New Phytologist, 2019, 223(3): 1127-1142.
[8] Lenoir I, Fontaine J, Lounès-Hadj Sahraoui A. Arbuscular mycorrhizal fungal responses to abiotic stresses: A review[J]. Phytochemistry, 2016, 123: 4-15.
[9] Parihar M, Meena V S, Mishra P K, et al. Arbuscular mycorrhiza: A viable strategy for soil nutrient loss reduction[J]. Archives of Microbiology, 2019, 201(6): 723-735.
[10] Stefanowicz A M, Zubek S, Stanek M, et al. Invasion of Rosa rugosa induced changes in soil nutrients and microbial communities of coastal sand dunes[J]. Science of the Total Environment, 2019, 677: 340-349.
[11] Chen M, Yang G, Sheng Y, et al. Glomus mosseae inoculation improves the root system architecture, photosynthetic efficiency and flavonoids accumulation of liquorice under nutrient stress[J]. Frontiers in Plant Science, 2017, 8: 931.
[12] 黃京華, 譚鉅發, 揭紅科, 等. 叢枝菌根真菌對黃花蒿生長及藥效成分的影響[J]. 應用生態學報, 2011, 22(6): 1443-1449.
[13] 劉潤進, 李曉林. 叢枝菌根及其應用[M]. 北京: 科學出版社, 2000.
[14] 高俊鳳. 植物生理學實驗指導[M]. 北京: 高等教育出版社, 2006.
[15] 曾燕紅. 叢枝菌根真菌共生條件下黃花蒿根系及其分泌物化感作用研究[D]. 南寧: 廣西大學, 2015.
[16] Laliberté E. Below-ground frontiers in trait-based plant ecology[J]. New Phytologist, 2017, 213(4): 1597-1603.
[17] Mallik A U, Biswas S R, Collier L C S. Belowground interactions between Kalmia angustifolia and Picea mariana: roles of competition, root exudates and ectomycorrhizal association[J]. Plant and Soil, 2016, 403: 471-483.
[18] Bardgett R D, Mommer L, De Vries F T. Going underground: Root traits as drivers of ecosystem processes[J]. Trends in Ecology and Evolution, 2014, 29(12): 692-699.
[19] Baetz U, Martinoia E. Root exudates: the hidden part of plant defense[J]. Trends in Plant Science, 2014, 19(2): 90-98.
[20] Tsunoda T, van Dam N M. Root chemical traits and their roles in belowground biotic interactions[J]. Pedobiologia, 2017, 65: 58-67.
[21] Gealy D R, Moldenhauer K A K, Duke S. Root distribution and potential interactions between allelopathic rice, sprangletop (Leptochloa spp.), and barnyardgrass (Echinochloa crus-galli) based on 13C isotope discrimination analysis[J]. Journal of Chemical Ecology, 2013, 39(2): 186- 203.
[22] Zhu X C, Skoneczny D, Weidenhamer J D, et al. Identification and localization of bioactive naphthoquinones in the roots and rhizosphere of Patersons curse (Echium plantagineum), a noxious invader[J]. Journal of Experimental Botany, 2016, 67(12): 3777-3788.
[23] Feng G, Zhang F, Li X, et al. Improved tolerance of maize plants tosalt stress by arbuscular mycorrhiza is related to higher accumulation of soluble sugars in roots[J]. Mycorrhiza, 2002, 12(4): 185-190.
[24] 包 ?靜. 鹽脅迫對黃瓜根系分泌物及土壤微生物的影響[D]. 哈爾濱: 東北農業大學, 2009.
[25] Ohwaki Y, Hirata H. Differences in carboxylic acid exudation among p-starved leguminous crops in relation to carboxylic acid contents in plant tissues and phospholipid level in roots[J]. Soil Science and Plant Nutrition, 1992, 38(2): 235-243.
[26] Dinkelaker B, Romheld V, Marschner H. Citric acid excretion and precipitation of calcium citrate in rhizosphere of white lupin (Lupinus albus L.) [J]. Plant, Cell and Environment, 1989, 12(3): 285-292.
[27] 郭修武, 李 ?坤, 郭印山, 等. 叢枝菌根真菌對連作土壤中葡萄生長及根系分泌特性的影響[J]. 沈陽農業大學學報, 2009, 40(4): 392-395.
[28] 劉進法, 王 ?鵬, 羅 ?園, 等. 低磷脅迫下AM真菌對枳實生苗吸磷效應及根系分泌有機酸的影響[J]. 亞熱帶植物科學, 2010, 39(1): 9-13.

