胡椒瘟病菌Phytophthoracapsici孢子囊誘導及發育過程觀察
高圣風 楊開虎 陸大倩 劉愛勤 茍亞峰 孫世偉 王政 孟倩倩
摘 ?要:孢子囊的產生和發育過程是研究胡椒瘟病菌(Phytophthora capsici)及其病害防控的重要基礎。本研究分析不同誘導條件下胡椒瘟病菌孢子囊的產生情況,并通過光學顯微鏡和共聚焦顯微鏡觀察孢子囊及其內部游動孢子的發育過程。結果發現:(1)3種誘導方法均能誘導出大量孢子囊,其中在V8-A平板上光照和抹傷雙重誘導法獲得的孢子囊數量最多,其次是在V8-A平板上光照誘導法,獲得孢子囊數量最少的是V8液體光照誘導法,但僅差異最大的2個處理間達到顯著水平;(2)顯微鏡觀察發現,孢子囊由氣生菌絲頂端逐步膨大形成,初始為近球形逐漸發育成倒洋梨形,孢子囊成熟后從頂端排出大量游動孢子,偶爾可見孢子囊頂端直接發育出芽管;(3)共聚焦顯微鏡觀察發現,首先孢子囊內部原生質體被膜結構隔裂成大約數十個獨立小格,然后在每個格子中積累數倍于細胞核的DNA,最后每份細胞核DNA發育成一個游動孢子。本研究從微觀角度揭示P. capsici孢子囊發育外觀及內部的形態特征,為胡椒瘟病菌后續致病機制研究和胡椒瘟病田間防控提供技術基礎。
關鍵詞:胡椒瘟病;辣椒疫霉;孢子囊誘導;發育過程
中圖分類號:S432.1 ? ? ?文獻標識碼:A
Abstract: Sporangium is an important basis for the Phytophthora foot rot disease control and the pathogen (Phytophthora capsici) research in black pepper, but the sporangium-inducing methods and the micro development processes have not been reported yet. Three sporangium-inducing methods were tested and the sporangia development processes were observed by light microscope and laser confocal microscope. Abundant sporangia could be detected by all the three methods. The most sporangia were obtained by the method of lighting and glass rod-plastering induction on V8-A plates, followed by the lighting induction on V8-A plates and lighting induction in V8 liquid. Under light microscope, sporangia initially formed at the top of the hypha with the shape of small sphere, and gradually formed into an inverted pear shape. When matured, the sporangia released a large number of zoospores from an apical pore. Interestingly, a few sporangia germinated directly and formed a germ tube. Under laser confocal microscope, the protoplast of a sporangium was separated into dozens of small cells by membrane structure at first, and then multiple nuclear DNA was accumulated in each cell, and finally the multinuclear cell developed into several mononuclear zoospores. The study revealed the morphological characteristics of the P. capsici sporangium development progress would provide sporangium-inducing methods for further pathogenic mechanisms research and field disease management.
Keywords: black pepper phytophthora foot rot; Phytophthora capsici; sporangia induction; development process
DOI: 10.3969/j.issn.1000-2561.2020.09.021
胡椒(Piper nigrum Linn.)是一種經濟價值極高的食品香料作物,是海南省第三大經濟作物。胡椒瘟病具有極強的毀滅性和傳播性,在20世紀70年代曾導致中國胡椒種植面積縮減20%,其病原物是辣椒疫霉菌(Phytophthora capsici)[1-2]。2009—2010年對我國胡椒主產區海南省胡椒病害發生情況調查發現,胡椒瘟病在海南省11個胡椒主要種植市(縣)均普遍發生、危害嚴重[3-4],而且最近幾年胡椒瘟病呈現蔓延加重趨勢,是影響胡椒產業穩定發展的重要瓶頸之一。
孢子囊和游動孢子是P. capsici的再侵染源,可以通過氣流和水流快速傳播,造成病害蔓延流行。孢子囊的產生不僅是P. capsici在田間發生流行的關鍵前提,也是實驗室科學研究的重要基礎,尤其在侵染致病、遺傳操作等相關研究上至關重要。在國外,P. capsici的孢子囊誘導技術報道較多,主要是在V8蔬菜汁培養基上黑暗培養后光照誘導孢子囊產生[5-7]。在國內,除了V8蔬菜汁培養基,黑麥培養基、大豆培養基、胡蘿卜培養基等也被用于誘導P. capsici孢子囊[8-11],其誘導條件也不僅限于單獨光照,蘭成忠等[12]在光照誘導的基礎上提出了抹傷誘導;但是未見研究胡椒瘟病病原菌孢子囊誘導技術的相關報道。受限于孢子囊誘導技術,目前胡椒瘟病的致病性接種也主要采用菌絲塊傷口接種方法[13-14],尚未使用與P. capsici自然侵染一致的游動孢子接種法[6]。國內外通過光學顯微鏡、電子顯微鏡等手段研究發現P. capsici的孢子囊形態主要是倒洋梨形,也常見卵形、長卵形、球形、不規則形等性狀[15-18],但是對其孢子囊發育及其內部游動孢子發育過程尚未見報道。
本研究在前人研究的基礎上,分析不同誘導條件下胡椒瘟病菌孢子囊的產生情況,并通過光學顯微鏡和共聚焦顯微鏡進一步觀察孢子囊和游動孢子的發育過程,從微觀角度揭示胡椒瘟病菌的形態特征,為胡椒瘟病致病機制等相關研究提供基礎。
1 ?材料與方法
1.1 ?材料
1.1.1 ?供試菌株 ?胡椒瘟病菌由本研究室從胡椒病株中分離純化得到,于馬鈴薯葡萄糖瓊脂(PDA)試管斜面培養基中室溫保存。
1.1.2 ?培養基 ?胡椒瘟病菌保藏及活化使用PDA培養基:馬鈴薯200 g,切成小塊,在800 mL去離子水中煮沸15 min,用雙層紗布過濾,濾液中加入葡萄糖和瓊脂粉各20 g,用去離子水定容至1000 mL,121 ℃滅菌20 min[2]。
胡椒瘟病菌孢子囊誘導培養基:(1)10% V8蔬菜汁(V8)培養基,離心后的V8蔬菜汁100 mL, CaCO3 1g,用去離子水定容至1000 mL,121 ℃滅菌20 min[7];(2)10% V8蔬菜汁瓊脂(V8-A)培養基,配制方法與V8培養基基本相同,僅在滅菌前添加瓊脂粉20 g/L[7]。
1.1.3 ?熒光染料 ?激光掃描共聚焦顯微觀察使用2種熒光染料:(1)4,6-二脒基-2-苯基吲哚(4,6-diamidino-2-phenylindole, DAPI),能夠與雙鏈DNA結合,在波長330~405 nm的紫外光下激發出波長461 nm的藍光;(2)苯乙烯染料(N-(3- Triethylammoniumpropyl)-4-(6-(4-(Diethylamino) phenyl) hexatrienyl) Pyridinium Dibromide, FM?4- 64FX),能夠結合細胞質膜,在波長510~570 nm的綠光下激發出波長734 nm的紅光,2種染料均購自賽默飛世爾科技(中國)有限公司。
1.2 ?方法
1.2.1 ?胡椒瘟病菌孢子囊誘導 ?從保藏的試管斜面中挑取少量菌種轉接入PDA培養基中,于28 ℃恒溫培養箱中培養2 d,再次轉接入新的PDA平板中,于28 ℃恒溫培養箱中培養5 d,作為以下孢子囊誘導方法的出發菌種。
V8液體培養光照誘導:將胡椒瘟病菌接種在V8-A平板上,置于28 ℃恒溫培養箱中培養7 d,切成直徑約1 cm的菌絲塊浸入V8液體培養基中,28 ℃條件下暗培養7 d后,挑取菌叢用無菌去離子水清洗后浸入無菌去離子水中,在28 ℃條件下光照培養,24 h后開始取樣,每隔12 h取樣1次,做成臨時裝片,用光學顯微鏡檢測孢子囊數量。
V8-A平板培養光照誘導:將胡椒瘟病菌接種在V8-A平板上,置于28 ℃恒溫培養箱中暗培養7 d,然后在28 ℃條件下光照培養,24 h后開始取樣,每隔12 h取樣1次,用光學顯微鏡檢測孢子囊數量。
V8-A平板培養光照和抹傷雙重誘導:將胡椒瘟病菌接種在V8-A平板上,置于28 ℃光照生化培養箱中培養7 d,用無菌玻璃棒涂抹菌絲后再次置于28 ℃光照生化培養箱中培養,24 h后開始取樣,每隔12 h取樣1次,用光學顯微鏡檢測孢子囊數量。
1.2.2 ?孢子囊光學顯微鏡觀察 ?孢子囊數量分析:在載玻片上滴加無菌去離子水15 μL,挑取少量菌絲平鋪于載玻片上,蓋上蓋玻片后置于奧林巴斯IX71倒置式顯微鏡載物臺上,用200倍視野進行觀察。每個處理設置3個樣本重復,每個樣本制作5個臨時裝片,鏡檢時選取菌絲分布均勻一致的視野利用cellSens Dimension軟件統計單位面積(mm2)中的孢子囊數量。
孢子囊發育過程觀察:在Φ15mm玻底培養皿中加入無菌去離子水50 μL,挑取少量菌絲放入培養皿中使菌絲平鋪于玻底,四周放置吸足無菌水的脫脂棉保濕,蓋上蓋子后置于奧林巴斯IX71倒置式顯微鏡載物臺上,用400倍視野利用cellSens Dimension軟件進行觀察并采集圖像,每20 min采集一次,直至孢子囊成熟或游動孢子釋放。
1.2.3 ?孢子囊染色及激光掃描共聚焦顯微鏡觀察 ?細胞核酸的染色及其觀察:DAPI染料用無菌去離子水配制成終濃度為10 mmol/L的母液,避光保存于-20 ℃冰箱中。將DAPI母液和無菌去離子水按照1∶5000體積稀釋配置成染色液,染色液現配現用。挑取少量待檢測菌絲浸入染色液中5 min,在無菌水中清洗3次后制成臨時裝片,置于Olympus Flv10智能激光掃描共聚焦顯微鏡的載物臺上。選取波長330~405 nm的激發光進行顯微觀察,使用Olympus Fluoview V4.2軟件采集圖像。
細胞膜染色及其觀察:FM?4-64FX染料用無菌去離子水配制成終濃度為164 μmol/L的母液,避光保存于-20 ℃冰箱中。將FM?4-64FX母液和無菌去離子水按照1∶10體積稀釋配置成染色液,染色液現配現用。挑取少量待檢測菌絲浸入染色液中1 min,在無菌水中清洗3次后制成臨時裝片,置于Olympus Flv10智能激光掃描共聚焦顯微鏡的載物臺上。選取波長510~570 nm的激發光進行顯微觀察,使用Olympus Fluoview V4.2軟件采集圖像。
1.3 ?數據處理
采用SPSS 16.0(SPSS Inc., Chicago, IL, USA)軟件進行數據處理,采用單因素方差分析(one- way ANOVA),費雪最小顯著差異檢驗(Fishers least-significant difference test, LSD)(P<0.05)。
2 ?結果與分析
2.1 ?孢子囊誘導效果分析
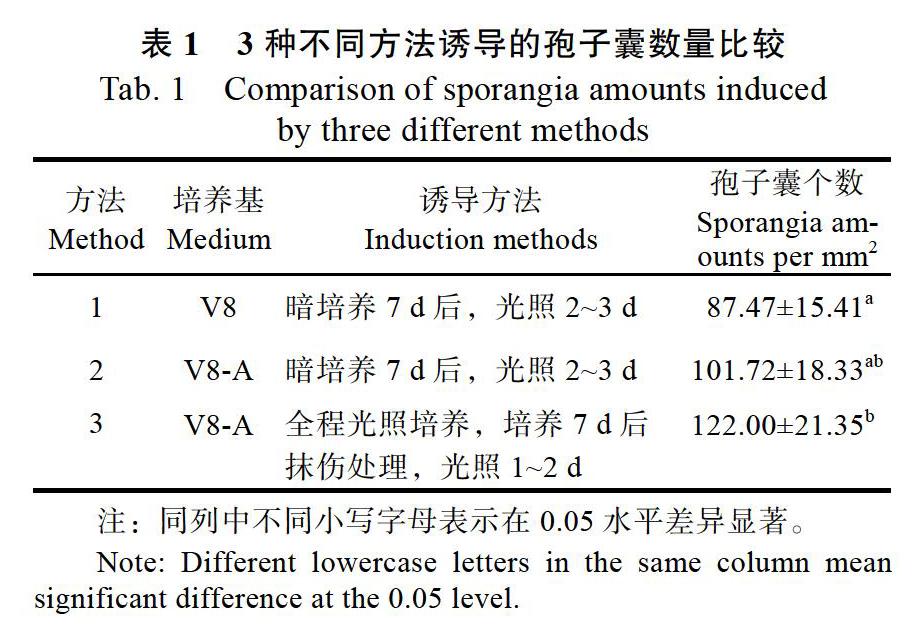
分別采用3種不同的方法開展胡椒瘟病菌孢子囊誘導試驗。顯微鏡下檢測發現,3種誘導方法均能將胡椒瘟病菌誘導出大量孢子囊;其中V8-A平板培養光照和抹傷雙重誘導方法(方法3)獲得的孢子囊數量最多,其次是V8-A平板培養光照誘導方法(方法2)和V8液體培養光照誘導方法(方法1),但是僅方法1和方法3之間有顯著性差異(P<0.05),其他處理間差異均不顯著(表1)。
2.2 ?孢子囊形態及其發育過程觀察
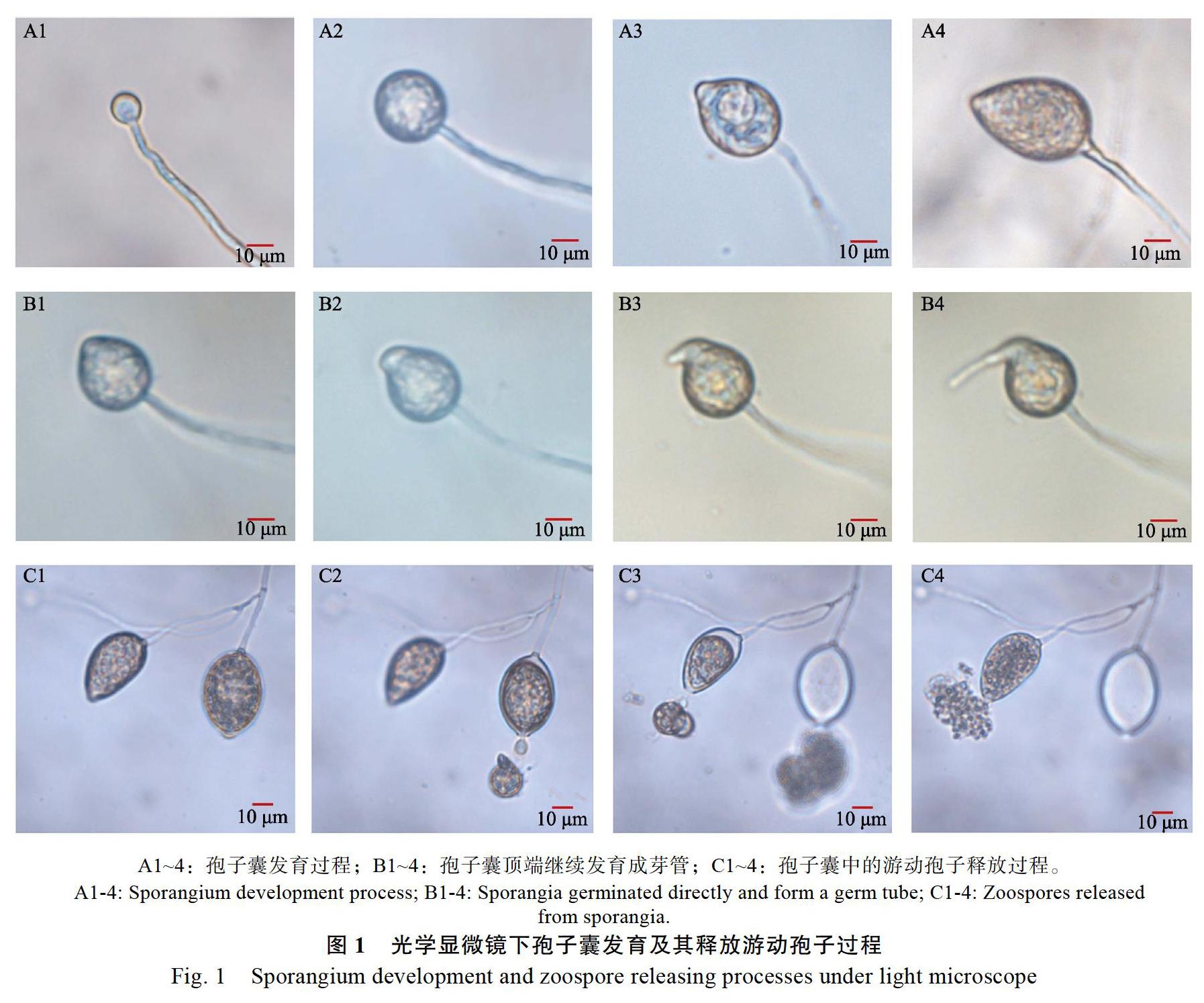
光學顯微鏡下觀察孢子囊的發育過程發現,孢子囊產生于其菌絲頂端,初始為圓球狀并逐漸膨大發育成倒洋梨形的孢子囊(圖1A1~A4);偶爾可見一些孢子囊頂端再次發生形態變化,在排孢孔處向外延伸逐漸發育成形狀類似菌絲的芽管(圖1B1~B4);孢子囊發育成熟后從頂端排孢孔中排出游動孢子,游動孢子數量達上百個甚至數百個,剛釋放的游動孢子初始擁擠成團,然后逐漸向四周分散(圖1C1~C4)。
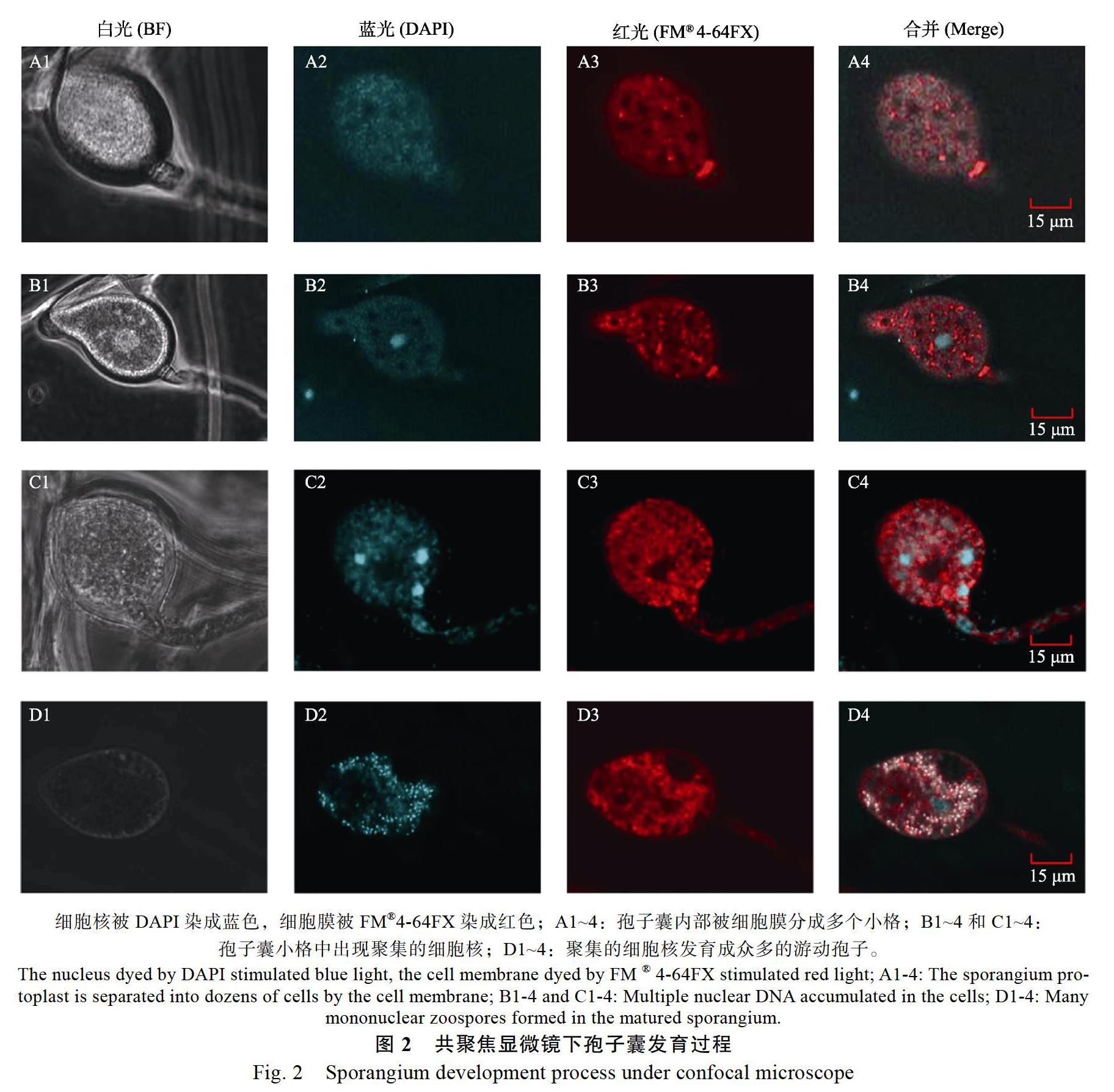
經過DAPI和FM?4-64FX 2種熒光染料染色后,在智能激光掃描共聚焦顯微鏡下可以看到細胞核和細胞膜分別被染成藍色和紅色(圖2)。孢子囊形成初期,其內部原生質體被膜結構隔裂成大約數十個彼此獨立的小格,小格呈蜂巢狀排列(圖2A1~A4);然后,在格子中逐漸累積大量DNA,形成一個體積數倍于細胞核的DNA團(圖2B1~B4,C1~C4);小格內DNA團分散并發育成單核的游動孢子,每個孢子囊內游動孢子數量達上百個甚至數百個(圖2D1~D4)。
3 ?討論
眾所周知,常規培養條件難以獲得大量的P. capsici孢子囊。近年來,P. capsici孢子囊誘導技術日漸成熟,已通過文獻報道或者以專利形式公布了各種方法[8-12]。但是國內外研究的P. capsici菌株主要來源于溫帶的辣椒、茄子等作物,與來源于熱帶的胡椒瘟病菌在遺傳學系統發育樹上歸屬不同的分類亞群[19]。本研究將辣椒疫霉孢子囊誘導方式簡單歸為3類,即液體培養基中光照誘導、固體平板上光照誘導和固體平板上光照、抹傷雙重誘導(表1)。研究發現使用V8或V8-A培養基培養時,3種誘導方法均可以獲得大量的孢子囊,說明來源于熱帶的胡椒瘟病菌與溫帶的P. capsici在孢子囊誘導條件上差異不大。3種方法誘導的孢子囊數量分別為87.47、101.72和122.00個/mm2,總體差距不大,可約略視為同一水平;結合操作難易程度和易污染程度,建議開展遺傳操作等研究時采用不易污染的液體培養基光照誘導方法,開展致病性接種等研究可采用易操作的其他2種方法。此外,在顯微觀察過程中細胞核被DAPI染成藍色,細胞膜被FM?4-64FX染成紅色;A1~4:孢子囊內部被細胞膜分成多個小格;B1~4和C1~4:孢子囊小格中出現聚集的細胞核;D1~4:聚集的細胞核發育成眾多的游動孢子。
發現,同一個玻片樣本中的孢子囊發育進程并不完全一致,會出現不同發育階段的孢子囊混雜的現象(尚未發表);結合多次鏡檢結果,初步認為這3種方法中雙重誘導法的孢子囊發育進程最整齊,但該結果還需要更多統計數據的支撐。
光學顯微鏡觀察發現胡椒瘟病菌的孢子囊形態主要是倒洋梨形,少數為長圓形、不規則形等(圖1),與前人報道結果一致[15-17],但張開明等[18]報道的多數是舟型、少數為梨形或不規則形。本研究觀察發現極少量的胡椒瘟病菌可以在孢子囊頂端發育出菌絲狀結構,在其他P. capsici菌株上尚未發現類似報道;但是在同屬的致病疫霉(P. infestans)、德雷疫霉(P. drechsleri)中均有孢子囊直接萌發芽管的報道[20-21],因此本研究將該菌絲狀結構暫定為芽管。但是,該結構是否像孢子萌發的芽管一樣可以直接侵染植株,還需要更加深入的研究。
通過激光掃描共聚焦顯微鏡觀察發現,胡椒瘟病菌孢子囊內部被膜結構分隔成數十個小格,然后在格子中累積成數倍于細胞核的DNA團,最后DNA團分散并發育成眾多游動孢子(圖2)。該結果在P. capsici中尚未見類似報道。陶愷報道的大豆疫霉(P. sojae)孢子囊內部同樣是先由細胞膜將原生質體分隔成數十個彼此獨立空間;而不同的是,每個獨立空間只有一個細胞核,發育成單個游動孢子[22]。通過反復觀察胡椒瘟病菌的孢子囊及其游動孢子的釋放過程,發現每個孢子囊至少能釋放出約200個游動孢子,遠大于其膜結構分隔出的獨立空間個數,認為胡椒瘟病菌的游動孢子發育過程與大豆疫霉可能存在差異(尚未發表)。但是,是否所有P. capsici的游動孢子發育過程均與胡椒瘟病菌一致,還需要后續更多的研究。
對于胡椒瘟病菌孢子囊發育的時間周期,本研究已做一些探索。通過顯微鏡對視野中的特定菌絲進行長時間定位監測發現,從菌絲末端膨大到發育成一個倒洋梨形的孢子囊大約需要8~12 h;但是完整監測一個孢子囊的發育全程難度極大,成功的樣本數量不多,該結果還需要更多數據支撐。另外,監測到大量的孢子囊釋放過程,發現該過程較為短暫,從游動孢子開始釋放到孢子囊放空僅需要大約15~30 s;但是該過程受環境溫度變化影響較大,迅速降溫可將該過程縮短至10 s以內(尚未發表)。對于顯微鏡觀察結果,值得注意的是,顯微鏡觀測環境與孢子囊誘導環境、自然環境之間的差異可能影響觀察結果。但是生動具體的微觀觀察結果對認識微生物形態變化都具有重要的指導意義。
參考文獻
[1] 劉愛勤. 熱帶特色香料飲料作物主要病蟲害防治圖譜[M]. 北京: 中國農業出版社, 2013: 2-12.
[2] 桑利偉, 劉愛勤, 譚樂和, 等. 海南省胡椒瘟病病原鑒定及發生規律[J]. 植物保護, 2011, 37(6): 168-171.
[3] 桑利偉, 譚樂和, 劉愛勤, 等. 海南省胡椒主要病害現狀初步調查[J]. 植物保護, 2010, 36(5): 133-137, 148.
[4] 桑利偉, 劉愛勤, 譚樂和, 等. 胡椒瘟病田間發生規律觀察[J]. 熱帶作物學報, 2010, 31(11): 1996-1999.
[5] Lewis Ivey M L, Miller S A. Use of the vital stain FUN-1 indicates viability of Phytophthora capsici propagules and can be used to predict maximum zoospore production[J]. Mycologia, 2014, 106(2): 362-367.
[6] Kim M J, Shim C K, Kim Y K, et al. Evaluation of watermelon germplasm for resistance to phytophthora blight?caused by Phytophthora capsici[J]. The Plant Pathology Journal, 2013, 29(1): 87-92.
[7] Hord M J. Effects of physical and chemical factors on the germination of oospores of Phytophthora capsici in vitro[J]. Phytopathology, 1991, 81(12):1541-1546.
[8] 許亞池, 王述彬, 刁衛平, 等. 一種便捷高產的辣椒疫霉菌游動孢子產生方法[J]. 江蘇農業科學, 2015, 43(10): 172-173, 258.
[9] 張 ?榮, 辛光云, 劉愛媛. 辣椒疫霉菌保存及游動孢子誘導技術研究[J]. 安徽農業科學, 2008(20): 8679-8680.
[10] 王曉敏, 鞏振輝, 逯紅棟, 等. 辣椒疫霉菌孢子誘導技術研究[J]. 西北農業學報, 2006, 15(2): 59-62.
[11] 蘭成忠, 劉裴清, 李本金, 等. 辣椒疫霉菌產孢培養基及誘導方法篩選[J]. 熱帶作物學報, 2013, 34(9): 1776-1780.
[12] 蘭成忠, 陳慶河, 李本金, 等. 一種簡便、高效誘導辣椒疫霉菌產生游動孢子的方法[P]. 中國: CN102391980A. 2012-03- 28.
[13] 高圣風, 劉愛勤, 桑利偉, 等. 枯草芽胞桿菌VD18R19在胡椒上的定殖動態及促生作用和對胡椒瘟病的防治效果[J]. 中國生物防治學報, 2017, 33(5): 650-657.
[14] 桑利偉, 劉愛勤, 高圣風, 等. 防治胡椒瘟病生物農藥篩選及其盆栽藥效試驗[J]. 熱帶作物學報, 2017, 38(5): 915-918.
[15] Williams W T, Webster R K. Electron microscopy of the sporangium of Phytophthora capsici[J]. Canadian Journal of Botany, 1970, 48(2): 221-227.
[16] Aragaki M, Uchida J Y. Morphological distinctions between Phytophthora capsici and P. tropicalis sp. nov.[J]. Mycologia, 2001, 93(1): 137-145.
[17] 馮俊濤, 韓立榮, 范瑞娟, 等. 枯茗酸對辣椒疫霉病菌生長發育的影響[J]. 中國農業科學, 2012, 45(13): 2628-2635.
[18] 張開明, 鄭服叢, 黎乙東, 等. 中國胡椒疫霉種及交配型的研究[J]. 熱帶作物學報, 1991(2): 69-76.
[19] Bowers J H, Martin F N, Tooley P W, et al. Genetic and morphological diversity of temperate and tropical isolates of Phytophthora capsici[J]. Phytopathology, 2007, 97(4): 492-503.
[20] 唐德志, 孫毓彬, 何蘇琴. 德雷疫霉侵染甜瓜葉片過程的研究[J]. 西北農業學報, 1992(1): 89-91.
[21] Fry W. Phytophthora infestans: the plant (and R gene) destroyer[J]. Molecular Plant Pathology, 2008, 9(3): 385-402.
[22] 陶 ?愷. 大豆疫霉侵染過程的分子細胞學研究[D]. 南京: 南京農業大學, 2012.

