琯溪蜜柚炭疽病拮抗放線菌的篩選和鑒定
賴寶春 吳振強 戴瑞卿 林明輝 李豐 林德鋒 王家瑞

摘 ?要:為篩選出對琯溪蜜柚炭疽病有防治效果的生防菌,以琯溪蜜柚炭疽病菌(Colletotrichum gloeosporioides)為靶標菌,采用平板對峙法進行初篩,用生長速率法和人工接種法對抑菌效果較好的菌株FX28進行抑菌譜及防治效果測定;通過形態學、生理生化特征,結合16S rDNA序列分析等方法研究其分類地位。結果表明:從25份土樣中共分離到放線菌105株,對琯溪蜜柚炭疽病菌有較好拮抗作用的放線菌有16株,其中菌株FX28抑菌活性最高,其抑菌帶寬度為15.3 mm,抑制率達86.4%,抑菌譜廣,對琯溪蜜柚炭疽病菌、琯溪蜜柚黑點病菌、琯溪蜜柚黑斑病菌等14種供試植物病原菌均有抑制作用;其作用機制表現為菌絲分枝增多、變粗、頂端膨大等,對琯溪蜜柚炭疽病的預防效果和治療效果分別為83.8%和71.1%。根據形態、生理生化特性及16S rDNA序列分析,初步確定菌株FX28為深紅紫鏈霉菌(Streptomyces violaceorubidus)。
關鍵詞:琯溪蜜柚炭疽病;深紅紫鏈霉菌;分類鑒定;生防作用
中圖分類號:S436.66 ? ? ?文獻標識碼:A
Abstract: This study was conducted to screen resources for the biological control of Colletotrichum gloeosporioides which cause anthracnose disease for Guanxi honey pomelo cultivar. An antagonistic actinomycete of C. gloeosporioides was isolated from the soil samples by the plate-confrontation method and growth speed rate method, and the inoculated fruit was treated with the fermented broth. The taxonomic identification of the strain FX28 was carried out using morphological, physiological and biochemistry characteristics and 16S rDNA sequence. From the 25 soil samples, 16 of 105 antagonistic actinomycete isolates showed againstantifungal activity against C. gloeosporioides. FX28 showed an inhibition zone with a diameter 15.3 mm and strongest inhibition rate 86.4%. FX28 had broad-spectrum inhibition activity to all the 14 plant pathogenic fungi such as C. gloeosporioides, Diaporthe citri, Phyllosticta citriasian. FX28 could break down hyphae, turn hyphal thickened, fractured and enlarged. The protection and curation effects of the fermented broth against C. gloeosporioides were up to 83.8% and 71.1%, respectively. Based on the morphological, physiological-biochemical characteristics and molecular analysis, FX28 was identified as Streptomyces violaceorubidus.
Keywords: honey pomelo anthracnose disease; Streptomyces violaceorubidus; taxonomic identification; biocontrol effect
DOI: 10.3969/j.issn.1000-2561.2020.09.022
琯溪蜜柚炭疽病的病原為膠孢炭疽菌(Coll-etotrichum gloeosporioides),該菌在琯溪蜜柚整個生育期及果實采后均可為害[1]。目前,生產上防治該病主要依靠化學農藥,從蜜柚抽發春梢開始至冬季清園結束,果農每隔20 d左右施用一次化學農藥,大量使用化學農藥不僅對生態環境和人畜健康造成危害,也導致果實農藥殘留和病原菌的抗藥性逐年增加。因此,研究安全環保的病害防控方法對琯溪蜜柚的可持續生產具有重要意義。放線菌能產生抗生素及次生代謝產物,極具植物病害防控潛力,在植物病害防治中已得到有效的應用[2]。國內外已有柑橘炭疽病生防方面的相關報道,Lee等[3]研究發現,從八角茴香和荊芥中提取的精油能夠抑制炭疽病菌的生長;汪茜等[4]研究了枯草芽孢桿菌1505菌株對柑橘采后炭疽病的防治效果,采用刺傷接種的防效為48.8%,自然發病的防效為46.3%;劉冰等[5-6]篩選到一株放線菌ML27菌株對柑橘炭疽病菌的抑制率為72.15%;汪文強等[7]利用煙管菌發酵液對柑橘炭疽病菌的抑菌率達71.1%;袁紅旭等[8]從柑橘果實中分離到14株內生細菌可降低柑橘果實炭疽病的發病率;紀兆林等[9]分離到的地衣芽孢桿菌和多粘類芽孢桿菌對柑桔炭疽病菌菌絲有明顯的抑制作用,可延緩柑桔采后炭疽病的發生;黃艷等[10]利用殼寡糖誘導柑橘果實中活性氧的變化來降低炭疽病的發病率。但是在柑橘屬農產品上,尚未發現能抑制炭疽病菌達12 h以上的生物殺菌劑[11]。目前有關琯溪蜜柚炭疽病生物防治的研究報道較少。因此,本研究以琯溪蜜柚炭疽病菌作為靶標菌,從福建省漳州市不同地區的土壤中分離篩選生防效果較好的拮抗放線菌菌株,旨在為該病的生物防治提供更多的微生物資源。
1 ?材料與方法
1.1 ?材料
供試病原菌:琯溪蜜柚炭疽病菌(Coll-etotrichum gloeosporioides)、琯溪蜜柚黑點病菌(Diaporthe citri)、琯溪蜜柚黑斑病菌(Phyllo-sticta citriasiana)、香蕉枯萎病菌4號小種(Fusa?rium oxysporum f. sp. cubense, race 4)、辣椒枯萎病菌(F. oxysporum Schl. f. sp. vasinfectum)、水稻惡苗病菌(F. moniliforme)、玉米穗腐病菌(F. porliferatum)、辣椒疫霉病菌(Phytophthora capsici)、黃瓜枯萎病菌(F. oxysporum f. sp. cu-curmerinum)、番茄枯萎病菌(F. oxysporum f. sp. lycopersici),由本研究室分離、鑒定、致病性測定及保存;番茄葉霉病菌(Fulvia fulva)、多肉黑斑病菌(Alternaria alternata)、榕樹炭疽病菌(C. gloeosporioides)、蘭花莖腐病菌(F. oxysporum),由福建省農業科學院植物保護研究所饋贈。供試土樣采自福建省漳州市龍文區、薌城區、南靖縣、平和縣、云霄縣、詔安縣等地,共25份。
供試藥劑:70%丙森鋅可濕性粉劑,由拜耳作物科學(中國)有限公司生產,為果農防治琯溪蜜柚炭疽病常用藥劑。
1.2 ?方法
1.2.1 ?放線菌的分離、純化 ?采用稀釋涂布分離法[12]分離放線菌。將土樣置于通風干燥處自然風干,稱取5 g土壤倒入放有滅菌玻璃珠的50 mL無菌水中,置于振蕩培養箱(BS-1振蕩培養箱,金壇市鴻科儀器廠)振蕩30 min后,吸取1 mL混懸液,用無菌水梯度稀釋,分別吸取104、105、106稀釋液0.1 mL均勻涂布在高氏一號瓊脂平板上,后置于28 ℃生化培養箱(上海培因實驗儀器有限公司)中培養,挑取培養性狀不同的單菌落轉入高氏一號培養基上純化培養,純化3次后,置于4 ℃冰箱中保存,備用。
1.2.2 ?拮抗放線菌的篩選 ?發酵液制備[2]:將100 mL高氏一號液體培養基加入250 mL三角瓶中,121 ℃高壓滅菌30 min,待冷卻后接入4 mm的菌餅(從1.2.1中純化保存的放線菌)5塊,于28 ℃、150 r/min振蕩培養7 d,在無菌條件下將發酵液吸到滅菌離心管中,8 000 r/min離心30 min,吸取上清液,置于20 ℃冰箱中備用。
拮抗菌的篩選:采用平板對峙法[13]對1.2.1中所分離到的放線菌進行抑菌活性篩選,靶標菌為琯溪蜜柚炭疽病菌。
抑菌譜測定:采用菌絲生長速率法[12]測定1.2.1節篩選獲得的強活性菌株對供試病原真菌的抑菌能力。
孢子萌發抑制試驗:將稀釋10倍的菌株FX28(1.2.1篩選獲得的強活性菌株)發酵濾液和病菌孢子懸浮液滴入凹玻片中,置于28 ℃恒溫培養箱保濕培養,設空白發酵液與無菌水的混合液作為對照。分別于12 h和24 h觀察病菌孢子的萌發情況[14]。
1.2.3 ?防治效果測定 ?取新鮮琯溪蜜柚幼果,用75%酒精表面消毒,無菌水沖洗3次,采用刺傷接種的方法,取菌株FX28發酵上清液5 mL均勻涂抹于幼果傷口及其周圍果面,涂抹后放入塑料盒置于28 ℃恒溫箱中。24 h后在傷口處接種20 ?L炭疽病菌孢子液(105個孢子/mL),接種后放入塑料盒(相對濕度約90%)置于28 ℃恒溫箱,測定菌株FX28的預防效果;將炭疽病菌孢子液20 ?L接種于幼果傷口及其周圍,24 h后在傷口處及其周圍涂抹5 mL發酵上清液,測定菌株FX28的治療效果。設70%丙森鋅300倍液為藥劑對照,設無菌水為空白對照,每處理15個果實,重復3次。接種后每天觀察1次,計算病情指數和防治效果。果實發病程度分級標準參照汪茜等[5]的方法。
1.2.4 ?FX28菌株的鑒定 ?形態特征觀察:采用插片法,待菌絲長上蓋玻片后,取菌絲生長適中的蓋玻片置于光學顯微鏡下,觀察FX28菌株氣生菌絲、基內菌絲、孢子絲和孢子的形態特征[15]。
培養特征和生理生化特征分析:參照關統偉等《放線菌系統分類技術》[16]和中國科學院微生物研究所放線菌分類組編著的《鏈霉菌鑒定手冊》[15]。觀察菌株培養特征的8種培養基見表4。
分子生物學鑒定[13, 17]:采用細菌基因組提取試劑盒提取菌體總DNA,以Ezup柱式抽提試劑盒[生工生物工程(上海)股份有限公司]和細菌通用引物27F: 5-AGAGTTTGATCMTGGCT CAG-3和1492R: 5-TACGGYTACCTTGTTACG ACTT-3,由生工生物工程(上海)股份有限公司合成。25 μL PCR反應體系:Taq PCR Master Mix 12.5 μL,模板DNA 2 μL(100 ng/μL),10 μmol/L引物各1 μL,加ddH2O至總體積達25 μL,陰性對照用ddH2O代替模板DNA。PCR反應條件:94 ℃預變性4 min,94 ℃變性45 s,55 ℃退火45 s,72 ℃延伸1 min,30個循環;72 ℃修復延伸10 min,于4 ℃下保存。在含有GelRed染料的1%瓊脂糖凝膠中回收擴增產物條帶,經連接、轉化和鑒定后,陽性克隆由生工生物工程(上海)股份有限公司測序。將測定的基因序列登錄NCBI(www.ncbi.nlm.nih.gov)進行BLAST比對,并從GenBank數據庫獲得相關分離物的16S rDNA序列,然后用鄰位加入法(Neighbor-joining)構建系統發育進化樹。
1.3 ?數據處理
采用Excel軟件整理實驗數據,采用DPS軟件進行方差分析。
2 ?結果與分析
2.1 ?拮抗放線菌初篩
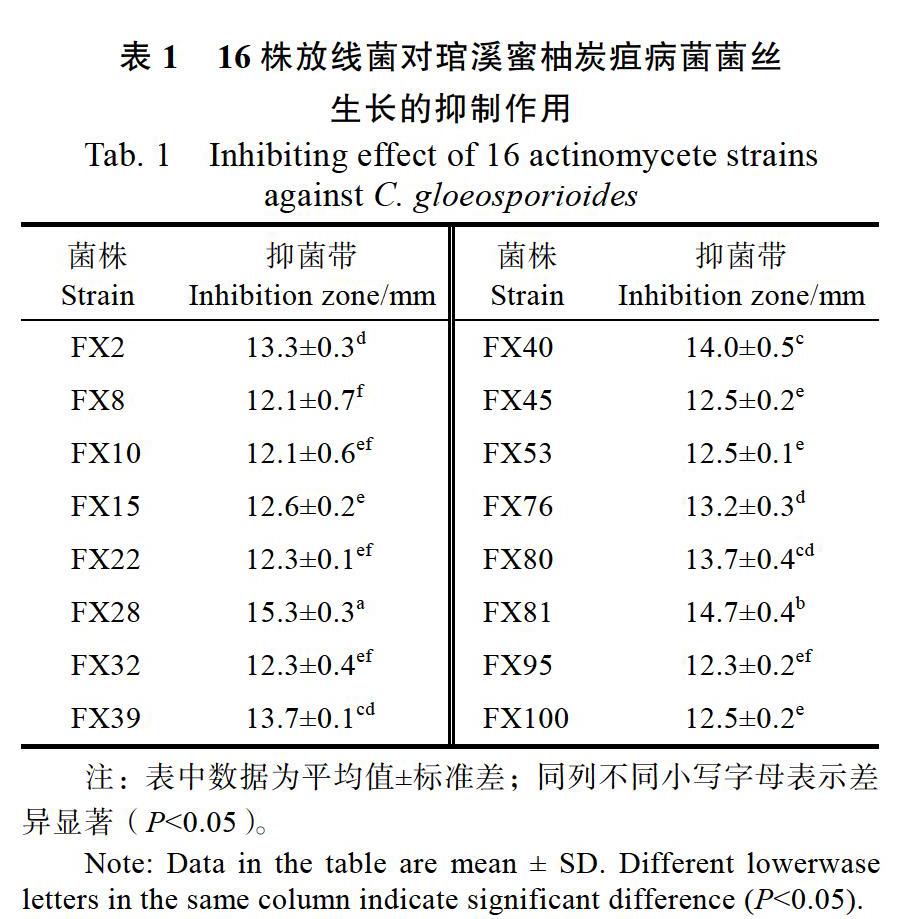
從25份土壤樣品中共分離、純化到105株培養性狀不同的放線菌。拮抗活性試驗結果表明,有16株放線菌對琯溪蜜柚炭疽病菌的抑菌帶寬度大于12.0 mm,其中,7株放線菌的抑菌帶寬度大于13.0 mm,以菌株FX28的抑菌效果最好,抑菌帶寬度達15.3 mm(表1,圖1),因此將其作為后續試驗菌株。
2.2 ?活性菌株FX28的抑菌譜
抑菌譜測定結果表明,菌株FX28對14種供試病原真菌均有不同程度的抑制作用,其中對琯溪蜜柚炭疽病菌、辣椒枯萎病菌和番茄葉霉病菌作用最強,抑制率達85.8%以上;對榕樹炭疽病菌、黃瓜枯萎病菌、番茄枯萎病菌的抑制率分別為74.9%、75.0%、75.0%;對水稻惡苗病菌、玉米穗腐病菌、辣椒疫霉病菌的抑制作用相對較弱,抑制率在23.7%~30.8%之間;且菌株FX28對不同病原菌的抑制作用存在顯著差異(表2)。
2.3 ?菌株FX28對琯溪蜜柚炭疽病菌的抑菌效果
2.3.1 ?菌株FX28對琯溪蜜柚炭疽病菌菌絲的作用機制 ?在光學顯微鏡下檢查被抑制菌絲的變化情況,結果顯示受抑制的琯溪蜜柚炭疽病菌菌絲變粗、分枝增多、頂端膨大、扭曲、易斷裂,且菌絲內原生質凝聚,細胞內含物紊亂(圖2B)。對照的菌絲細長,光滑而均勻(圖2A)。
2.3.2 ?菌株FX28對琯溪蜜柚炭疽病菌孢子萌發的抑制作用 ?孢子萌發抑制結果表明,培養12 h后,對照的炭疽病菌孢子萌發率為91.7%,菌株FX28發酵液處理的孢子萌發率為0,抑制率為100%;24 h后,對照炭疽病菌孢子全部萌發,菌株FX28發酵液處理的孢子少量萌發,萌發率為3.0%,抑制率為97.0%(圖3)。
2.4 ?菌株FX28對琯溪蜜柚炭疽病的防治效果
預防作用測定結果表明,對照大部分果實腐爛,爛果率為91.1%,病情指數為50.1;菌株FX28發酵液處理的果實爛果率為20.0%,病情指數為8.2,其預防效果為83.8%;70%丙森鋅處理的預防效果為85.7%,略高于菌株FX28發酵液處理。治療作用測定結果表明,菌株FX28發酵液處理的果實爛果率為28.9%,病情指數為14.1,其治療效果為71.1%,略低于70%丙森鋅處理,處理間無顯著差異(表3)。但隨著時間延長,對照果實的腐爛面積逐漸擴大,而感病果實經菌株FX28發酵液和70%丙森鋅處理后,果實腐爛面積沒有繼續擴大。
2.5 ?菌株FX28的分類鑒定
2.5.1 ?菌株FX28的形態及培養特征 ?FX28菌株在高氏一號培養基上生長旺盛,菌落多褶皺,不易挑起,直徑為1.5~1.8 cm。鏡檢發現氣生菌絲和孢子絲均高度分枝;孢子鏈較長,孢子絲松敞或緊密螺旋形,時常不規則,叢生或輪生(圖4A),孢子絲成熟后形成串珠狀的孢子鏈,孢子絲斷裂后形成橢球形孢子,表面稍有褶皺,孢子大小0.60~0.75 ?m×0.80~1.05 ?m(圖4-B)。菌株FX28在8種培養基上均生長良好,28 ℃培養36~48 h后開始出現菌落,72~96 h后開始產生孢子,孢子堆顏色淺灰色至深灰色。其培養特征見表4。
2.5.2 ?生理生化特性 ?研究結果表明,菌株FX28可以利用甘油、蔗糖、麥芽糖、肌醇、葡萄糖、D-阿拉伯糖、鼠李糖、D-甘露醇、α-半乳糖、D-木糖作為碳源生長,不能利用棉子糖、D-果糖。可利用L-賴氨酸、甘氨酸、L-組氨酸、精氨酸、天冬酰胺、L-酪氨酸、L-色氨酸作為氮源生長,不能利用L-谷氨酸。能使淀粉水解、明膠液化、牛奶凝固而不胨化,不能使硝酸鹽還原、纖維素和色氨酸分解,也不能產生H2S和黑色素。
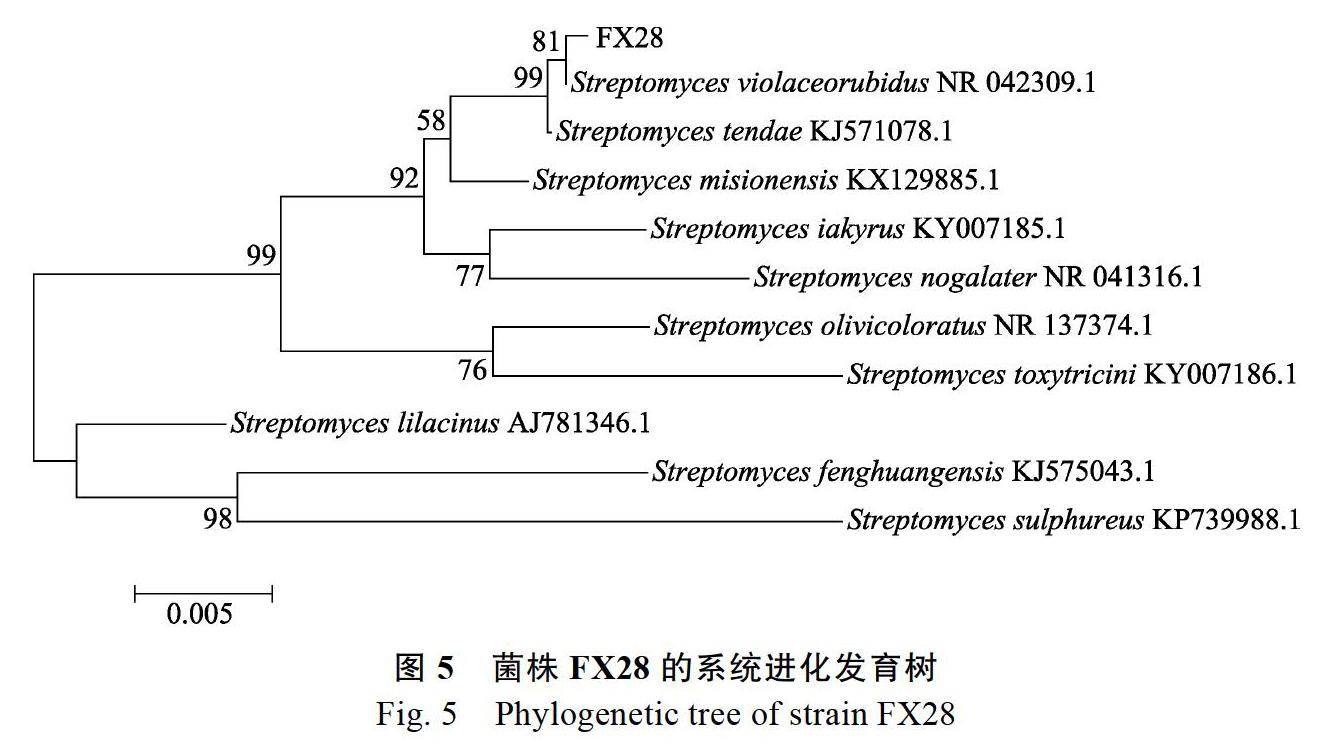
2.5.3 ?16S rDNA序列分析 ?FX28菌株PCR擴增得到1條約1295 bp的條帶。FX28菌株的16S rDNA序列在GenBank數據庫中進行同源性比對,發現FX28菌株與深紅紫鏈霉菌(Streptomyces violaceorubidus)的同源性最高,相似度在99%以上。選擇與菌株FX28同源性較高的10株菌構建系統發育樹(圖5),結果表明,菌株FX28的16S rDNA序列與深紅紫鏈霉菌(S. violaceorubidus)NR 042309.1聚在一個分支,親緣關系最近,結合菌株FX28的形態特征、培養特征、生理生化特性及16S rDNA序列分析結果,初步確定菌株FX28為深紅紫鏈霉菌(S. violaceorubidus)。
3 ?討論
琯溪蜜柚炭疽病不僅在田間引起果實腐爛,而且在貯藏過程中,對琯溪蜜柚的危害也很嚴重。目前,琯溪蜜柚炭疽病的防治主要采用化學殺菌劑,而化學殺菌劑對人畜的毒副作用和殘留問題至今難以有效解決。生物防治對環境友好,且病害不易產生抗藥性,是植物病害防治的發展趨勢。目前,生產上用于防治病害的農用抗生素中大部分是由鏈霉菌屬(Streptomyces)產生[18]。研究結果表明,菌株FX28對琯溪蜜柚炭疽病菌菌絲具有較強的抑制作用,該菌株屬鏈霉菌屬,通過培養特征、形態特征、生理生化特性、16S rDNA序列分析等,初步確定該菌株為深紅紫鏈霉菌(S. violaceorubidus)。該菌株對供試的大部分病原真菌均有較強的抑制活性,能否作為農用抗生素的新來源,還需進一步研究。另外,從應用生防菌的角度而言,需優化該菌株的培養條件,特別是產生抗菌代謝物的培養條件。
目前,國內外已有深紅紫鏈霉菌的相關報道,周璇[19]研究發現深紅紫鏈霉菌具有較強的有機物分解功能,可影響紅壤微生物的數量,提高紅壤呼吸速率的峰值。甘龍站等[20]分離到一株具有極強的抗癌、抗糖尿病活性及中等抗菌活性的深紅紫鏈霉菌。Asmaa等[21]從污水處理系統中分離到3株深紅紫鏈霉菌,可抑制污水中的病原體。Adeline等[22]從油棕的空果殼堆肥中分離到一株能加快堆肥速度且抑制靈芝屬(Ganoderma)致病菌的深紅紫鏈霉菌。Wadetwar等[23-24]從印度那格浦爾(Nagpur)地區土壤中分離到一株深紅紫鏈霉菌,對其發酵工藝優化后可大規模生產胞外抗生素。而深紅紫鏈霉菌應用于防治果樹病害尤其是琯溪蜜柚炭疽病的研究未見相關報道。本研究分離得到的深紅紫鏈霉菌菌株生長繁殖速度快,抑菌譜廣,對琯溪蜜柚炭疽病菌菌絲的抑制率達86.4%,24 h后對孢子的萌發抑制率為97.0%。吳思夢等[14]用黃色鏈霉菌發酵液對柚子炭疽病孢子萌發抑制率為61.54%。研究發現深紅紫鏈霉菌的抑菌作用機制表現為菌絲分枝增多、變粗、頂端膨大、扭曲、易斷裂,且菌絲內原生質凝聚,細胞內含物紊亂,與前人研究結果一致[13]。深紅紫鏈霉菌發酵上清液對琯溪蜜柚炭疽病的預防效果和治療效果分別為83.8%和71.1%,而汪茜等[4]用生防細菌防治柑橘采后炭疽病的防效為48.8%。后續將對深紅紫鏈霉菌在田間的定殖能力、適應性、穩定性以及防治效果等相關方面進行研究。目前國內外未見深紅紫鏈霉菌用于琯溪蜜柚炭疽病防治方面的相關報道。因此,以深紅紫鏈霉菌為菌源開發用于防治琯溪蜜柚炭疽病的新型生防制劑及生物有機肥具有良好的發展前景。
參考文獻
[1] 賴寶春, 吳順章, 鄭春明, 等. 琯溪蜜柚炭疽病病原鑒定[J]. 果樹學報, 2017, 34(9): 1178-1184.
[2] 張 ?寧, 韓立榮, 孫平平, 等. 拮抗茄子黃萎病菌土壤放線菌的分離篩選和鑒定[J]. 植物保護學報, 2012, 39(2): 109-114.
[3] Lee S O, Park I K, Choi G J, et al. Fumigant activity of essential oils and components of Illieium verum and Schizonepeta tenuifolia against Botrytis cinerea and Colletotrichum gloeosporioides[J]. Journal of Microbiology and Biotechnology, 2007, 17(9): 1568-1572.
[4] 汪 ?茜, 胡春錦, 黃思良, 等. 生防細菌1505的鑒定及其對采后柑橘炭疽病的抑制效果[J]. 西南農業學報, 2011, 24(2): 579-585.
[5] 劉 ?冰, 黎 ?園, 丁 ?莎, 等. 柑橘病害生防放線菌的分離篩選及抑菌作用研究[J]. 江西農業大學學報, 2011, 33(5): 889-892.
[6] 劉 ?冰, 宋水林, 劉曉麗, 等. 生防放線菌ML27的鑒定及其抗真菌活性代謝產物的性質研究[J]. 江西農業大學學報, 2014, 36(3): 656-660.
[7] 汪文強, 李 ?勇, 張旭輝, 等. 煙管菌M-1對柑橘炭疽病菌的抑制作用及發酵條件優化[J]. 中國生物防治學報, 2018, 34(3): 423-430
[8] 袁紅旭, 陳勇明, 何財能, 等. 拮抗炭疽病的柑橘內生細菌的分離與篩選[J]. 果樹學報, 2005, 22(5): 510-513.
[9] 紀兆林, 童蘊慧, 凌 ?箏, 等. 拮抗細菌對部分水果產后病原真菌的抑制及防腐作用[J]. 南京農專學報, 2003, 19(4): 23-27.
[10] 黃 ?艷, 明 ?建, 鄧雨艷, 等. 殼寡糖誘導柑橘果實抗病作用中的活性氧變化[J]. 食品科學, 2009, 30(22): 344-349.
[11] 張曉媛, 賴聞玲, 許 ?楊. 防治臍橙炭疽病生防菌的篩選[J]. 江蘇農業科學, 2016, 44(1): 152-154.
[12] 方中達. 植病研究方法[M]. 3版. 北京: 中國農業出版社, 1998: 243-250.
[13] 宋利沙, 蔣 ?妮, 繆劍華, 等. 腫節風炭疽病拮抗細菌的篩選與鑒定[J]. 植物保護, 2018, 44(6): 61-65,72.
[14] 吳思夢, 王文君, 劉 ?冰, 等. 1株柑橘炭疽病生防放線菌對幾種植物病原真菌的抑制作用[J]. 生物災害科學, 2016, 39(2): 84-89.
[15] 中國科學院微生物研究所放線菌分類組. 鏈霉菌鑒定手冊[M]. 北京: 科學出版社, 1975.
[16] 關統偉, 張小平, Rashey S G, 等. 放線菌系統分類技術[M]. 北京: 化學工業出版社, 2016: 70-81.
[17] 王涵琦, 暢 ?濤, 楊成德, 等. 馬鈴薯炭疽病(Colletotrichum coccodes)拮抗菌株的篩選及鑒定[J]. 植物保護, 2014, 40(1): 38-42.
[18] 林雁冰, 陸家賢, 顏 ?霞, 等. 地黃根圈土壤拮抗放線菌篩選、鑒定及發酵條件優化[J]. 植物保護學報, 2010, 37(3): 234-240.
[19] 周 ?璇. 外源腐解微生物對土壤微生物活性及群落結構的影響[D]. 北京: 中國農業科學院, 2018.
[20] 甘龍站, 王 ?幸, 劉 ?楊, 等. 一株藜內生放線菌活性分析及抗生素生物合成潛力的篩查[J]. 微生物前沿, 2016, 5(2): 9-18.
[21] Asmaa B, Yedir O, Lahcen H, et al. Isolation and characterization of wastewater sand filter actinomycetes[J]. World Journal of Microbiology and Biotechnology, 2010, 26(3): 481-487.
[22] Adeline S Y T, Alex H, Ka L P. Indigenous actinomycetes from empty fruit bunch compost of oil palm: Evaluation on enzymatic and antagonistic properties[J]. Biocatalysis and Agricultural Biotechnology, 2014, 3(4): 310-315.
[23] Wadetwar R N, Patil A T. Isolation and characterization of bilactive actinomycetes from soil in and around Nagpur[J]. International Journal of Pharmaceutical Sciences and Research, 2013, 4(4): 1428-1433.
[24] Wadetwar R N, Patil A T. Production of antibiotic from actinomycetes isolated from Nagpur region and optimization of parameters to increase the yield[J]. International Journal of Pharmaceutical Sciences and Research, 2013, 4(8): 3094-3098.

