5,5′-聯四唑-1,1′-二氧鉛鹽的熱分解
楊彩云
摘? 要:以5,5′-聯四唑-1,1′-二氧鈉鹽和硝酸鉛為原料通過復分解反應制備了5,5′-聯四唑-1,1′-二氧鉛鹽([Pb(BTO)(H2O)2]),考察了[Pb(BTO)(H2O)2]的熱分解性能,獲得在絕熱條件下的分解動力學參數,絕熱溫升為2.1 ℃;初始放熱溫升速率為5.13 ℃/min。
關鍵詞:5,5′-聯四唑-1,1′-二氧鉛鹽;合成;絕熱分解
中圖分類號:TJ55? ? 文獻標識碼:A
引言
Niko Fischer等[1]首次報道了多氮化合物5,5′-聯四唑-1,1′-二羥基二水合物(BTO)及衍生物,并對爆炸性能進行預測。王杰群等[2]研究了二水合5,5′-聯四唑-1,1′-二氧鉛鹽[Pb(BTO)(H2O)2]的熱分解性能和非等溫條件下的動力學。關于[Pb(BTO)(H2O)2]的結構和熱性能雖有文獻報道[3],本文采用新方法制備了[Pb(BTO)(H2O)2],利用絕熱加速量熱儀(ARC)等熱分析儀研究[Pb(BTO)(H2O)2]的熱穩定性,為安全生產和使用提供基礎數據。
1.實驗部分
1.1 實驗樣品及儀器
本實驗所使用DSC-TG分析儀由日本島津公司制造,樣品質量約3 mg左右,空氣氛圍,樣品盤采用三氧化二鋁坩堝,參比坩堝使用空坩堝,操作溫度為25~600 ℃,升溫速率為5 ℃/min。
1.2? [Pb(BTO)(H2O)2]的合成
250 mL帶溫度計的三口燒瓶固定在水浴中,向三口燒瓶中加入水100 mL,四水合5,5′-聯四唑-1,1′-二氧鈉鹽2.86 g(10 mmol),開啟攪拌,升溫至80 ℃使料液完全混合均勻。將硝酸鉛5g(15.1 mmol)溶于30 mL水的溶液加入三口瓶,硝酸鉛水溶液加完后保溫1 h,緩慢降至室溫,過濾,濾餅用水洗滌3次。自然晾干得到淡粉白色的[Pb(BTO)(H2O)2]晶體3.5g,收率85.17%。
紅外(IR)(KBr,υ/cm-1):3436(w)、1610(m)、1553(w)、1440(w)、1253(w)、1187(m)、1013(w)、750(s)、667(w);元素分析(w/%):[Pb(BTO)(H2O)2](Mr=411.2),理論值,C 5.83,H 0.97,N 27.24;實測值,C 5.77,H 0.94,N 27.21。
2.結果與討論
加速量熱儀選擇加熱速率以“加熱-等待-探測(H-W-S)”的模式操作,樣品分解反應放出的熱量不僅用于自身的加熱,而且還要加熱樣品球,所以測試結果是樣品和樣品球組成的整個反應系統。
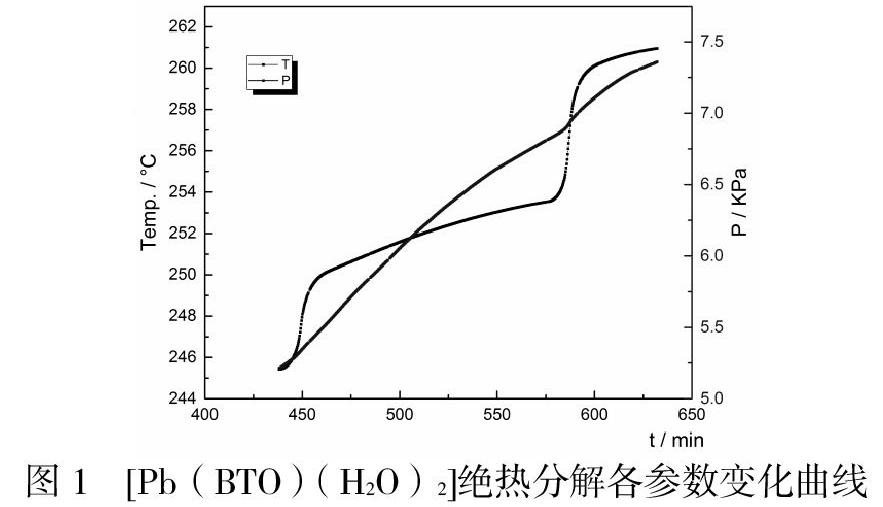
由圖1可知,試樣經過加熱-等待-搜尋的運行周期后在251.40 ℃探測到樣品開始分解放熱反應,[Pb(BTO)(H2O)2]在絕熱分解階段溫度隨著時間的延長而緩慢增加。表1可知,251.40℃時樣品開始分解放熱,對應的溫升速率為0.036℃/min,初始分解壓力為598.57kPa,隨后溫升速率在7.70min內維持0.036℃/min不變,而壓升速率開始緩慢下降,此時溫度與壓力繼續升高,溫度最高升至253.50℃,壓力達到最大值681 kPa。
3.結論
以5,5′-聯四唑-1,1′-二氧鈉鹽和硝酸鉛為原料通過復分解反應制備了[Pb(BTO)(H2O)2],采用紅外光譜、元素分析對結構進行了表征,以ARC研究了[Pb(BTO)(H2O)2]在絕熱條件下的熱行為,絕熱分解過程的初始放熱溫度為251.40℃,絕熱溫升為2.1℃。
參考文獻
[1]? FISCHER Niko,KLAP?TKE Thomas M,REYMANN Marius,et al. Nitrogen-rich salts of 1H,1′H-5,5′-bitetrazole-1,1′-diol:energetic materials with high thermal stability [J]. European Journal of Inorganic Chemistry,2013,2013(12):2167?2180.
[2]? 王杰群,王鵬程,陸明,等.1,1-二羥基-5,5-聯四唑金屬鹽的制備及熱分解動力學[J]. 含能含能材料,2016,24(6):538?543.
[3]? SU Qiang,WANG Xiaojun,SHU Qinghai,et al. Synthesis,crystal structure and properties of energetic complexes constructed from transition metal cations(Fe、Co、Cu and Pb)and BTO2?[J]. Journal of Heterocyclic Chemistry,2017,54(6):3227?3234.

