2013-2019年重慶市脊髓灰質炎實驗室細胞系質量控制情況分析 *
彭靖堯,黃 為,謝武娟,凌 華,張 敏,趙 華
重慶市疾病預防控制中心,重慶 400042
脊髓灰質炎(簡稱脊灰)是由脊髓灰質炎病毒(PV)急性傳染引起,在兒童中發生,以肌肉麻痹為主要癥狀。PV在全球曾廣泛傳播。1988年世界根除脊灰行動開始后,隨著滅活疫苗(IPV)、減毒活疫苗(OPV)在全球范圍內的廣泛使用,迄今為止,全球范圍內脊灰病例已經減少了99%,世界上絕大多數地區已經消除了脊灰[1]。從2000年開始,中國進入“無脊灰”狀態,即沒有脊灰野病毒引起的脊灰病例[2]。但截至目前,我國仍然在廣泛使用OPV,OPV可能導致疫苗衍生脊灰病毒(VDPV)的出現,這是在即將消滅脊灰的現階段工作中所面臨的重要問題[3]。在現階段,檢測PV的金標準仍然是細胞分離,我國脊灰網絡實驗室使用人橫紋肌肉瘤細胞(RD細胞)系和轉人脊灰受體的小鼠肺細胞(L20B細胞)系這兩種細胞系對PV進行細胞分離。因此,保證RD和L20B細胞系對PV的高度敏感性,對所用細胞系進行有效的質量控制,才能及時分離出標本中低水平的PV,以確保不漏檢脊灰野病毒及VDPV[4]。本研究對重慶市疾病預防控制中心脊灰實驗室2013-2019年PV分離所用細胞系的質量控制情況進行分析,現將結果報道如下。
1 材料與方法
1.1材料
1.1.1細胞系 本研究使用的RD細胞系和L20B細胞系均來自中國疾病預防控制中心脊灰實驗室,將所獲得的RD細胞系和L20B細胞系進行傳代,建立細胞庫凍存于液氮罐中,定期復蘇細胞傳代備用。
1.1.2標準毒株 本研究中使用的毒株有細胞敏感性實驗參考株(CSTR)和重慶市實驗室質控株(LQC)。其中CSTR來自中國疾病預防控制中心脊灰實驗室,LQC由重慶市脊灰實驗室按照世界衛生組織(WHO)推薦的標準操作規程進行制備[5]。經歷3次獨立實驗后確定平均滴度值(期望值),LQC確定滴度后分裝于凍存管(每管0.1 mL),超低溫冰箱-80 ℃保存,同時將LQC滴度上報WHO,經反饋認可后用于日常細胞敏感性實驗。
1.2方法
1.2.1支原體檢測 采用聚合酶鏈反應(PCR)法檢測L20B和RD細胞系有無支原體污染。PCR試劑使用寶生生物(Takara Bio)的Prime Script One Step RT-PCR Kit Ver.2,使用引物如下,F1:5′-ACA CCA TGG GAG CTG GTA AT-3′;R1:5′-CTT CAT CGA CTT TCA GAC CCA AGG CAT-3′。引物來自中國疾病預防控制中心脊灰實驗室。PCR反應條件:94 ℃ 3 min;94 ℃ 30 s,50 ℃ 30 s,72 ℃ 80 s,32個循環;72 ℃ 10 min。陽性擴增產物大小約為450 bp。
1.2.2細胞敏感性實驗 分別用已知型別和滴度的LQC進行檢測,具體實驗步驟參照WHO推薦方法,要求每次細胞敏感性實驗中檢測的病毒滴度值在WHO認可的LQC滴度值±0.5以內。病毒滴度采用Karber公式計算。Karber公式:logCCID50=L-d×(S-0.5),L為最低稀釋度log值,d為稀釋梯度log值,S為各個稀釋度中細胞病變孔數所占比例的總和。細胞敏感性實驗中,96孔板每孔通常加入0.1 mL的病毒懸液用于檢測,故細胞敏感性實驗結果常用logCCID50/0.1 mL表示,釋義為每0.1 mL病毒稀釋液對應的半數細胞病變數的對數值。
1.3統計學處理 數據錄入、整理和圖表制作使用Excel2010軟件。
2 結 果
2.1重慶市脊灰實驗室LQC滴度 2013年1月至2019年3月重慶市脊灰實驗室細胞敏感性實驗中使用的3個型別的LQC(SabinⅠ、SabinⅡ、SabinⅢ)為本實驗室2007年制備,標記為LQC2007。2019年4月細胞敏感性實驗使用新制備的LQC,標記為LCQ2019(2016起SabinⅡ型細胞敏感性實驗停止,因此未制備LCQ2019SabinⅡ)。LQC2007、LCQ2019各型別在RD細胞系和L20B細胞系上經WHO認可的平均滴度值見表1。
2.2支原體檢測實驗 重慶市脊灰實驗室于2015年起按中國疾病預防控制中心要求,在每次細胞敏感性實驗前均對L20B和RD細胞系進行支原體檢測。2015年1月至2019年12月,累計進行19次支原體檢測實驗,結果均為陰性。

表1 重慶市脊灰實驗室各型別LQC期望滴度值及可接受波動范圍(logCCID50/0.1 mL)
2.3細胞敏感性實驗 2013-2019年重慶市脊灰實驗室按照WHO推薦標準實驗方法進行了27次細胞敏感性實驗,自2016年起,在全球范圍內三價OPV(含SabinⅠ、SabinⅡ、SabinⅢ)被二價OPV(SabinⅠ、SabinⅢ)代替,WHO宣布消滅二型PV,SabinⅡ標準株的細胞敏感性實驗停止。2013年1月至2019年3月,使用LQC2007進行細胞敏感性實驗,在L20B細胞系上,敏感性實驗滴度分別如下:SabinⅠ為(8.28±0.43)logCCID50/0.1 mL,SabinⅡ為(7.87±0.27)logCCID50/0.1 mL,SabinⅢ為(7.77±0.47)logCCID50/0.1 mL。RD細胞系上,敏感性實驗滴度SabinⅠ、SabinⅡ、SabinⅢ分別為(8.15±0.48)、(7.95±0.50)、(8.23±0.43)logCCID50/0.1 mL。2019年3月后,使用LQC2019進行實驗,在L20B細胞系上,敏感性實驗滴度SabinⅠ、SabinⅢ分別為(7.70±0.04)、(7.10±0.30)logCCID50/0.1 mL,RD細胞系上,敏感性實驗滴度SabinⅠ、SabinⅢ分別為(8.06±0.39)、(7.83±0.13)logCCID50/0.1 mL。L20B細胞系上各型別的LQC2007滴度波動情況見圖1,RD細胞系上各型別的LQC2007滴度波動情況見圖2。由于僅使用LQC2019進行了3次細胞敏感性實驗,故對其結果未進行作圖分析。
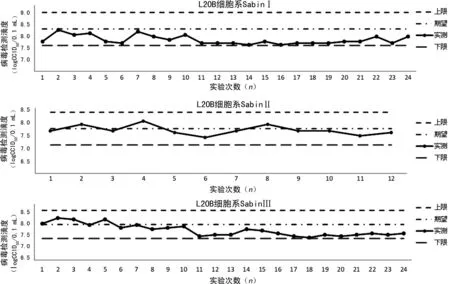
圖1 多次實驗各型別LQC2007在L20B細胞系上的滴度波動情況
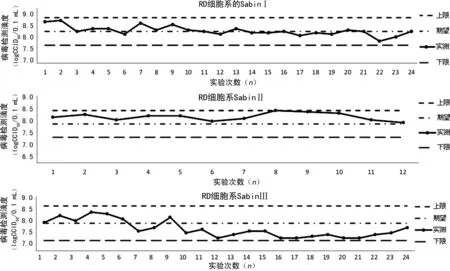
圖2 多次實驗各型別LQC2007在RD細胞系上的滴度波動情況
3 討 論
病毒的細胞分離培養是實驗室檢測的“金標準”,經細胞分離培養得到的高水平和高純度的病毒毒株,可以為后續一系列的病毒鑒定和深入研究打下基礎。相關研究指出,使用L20B細胞系和RD細胞系進行PV分離有較高的靈敏度,其靈敏度不亞于分子生物學方法[6]。WHO從2015年開始,在全球PV檢測實驗室推行了最新版的PV分離流程[7],這樣又進一步提高了PV的分離效率。因此,對PV的細胞分離工作實施質量控制,有著重要意義。
PV分離工作質量控制的核心是保證分離病毒所用細胞系的質量,這是PV監測工作準確性的前提,也是PV診斷工作的基礎。影響細胞系生長的因素眾多,包括培養細胞所需的原材料質量(胎牛血清、培養液、緩沖液等)、細胞生長條件(培養溫度、二氧化碳濃度)、培養液污染(細菌、支原體等)。WHO推薦脊灰實驗室中細胞系質量控制的有效方法是支原體檢測和細胞敏感性實驗[8]。支原體廣泛分布于自然界,其最佳生長溫度是37 ℃[9]。實驗室細胞系極易被支原體污染,被支原體污染的細胞通常不會有細胞病變,或僅引起細微的變化不易被察覺,使用PCR法可以快速、準確地檢測細胞系中的支原體,以確定細胞系是否被支原體污染。PV細胞敏感性實驗結果可直接反映出細胞系對特定型別PV的敏感程度,以此確定細胞系生長狀態是否正常,從而達到對細胞系的質量控制。
2013-2019年重慶市脊灰實驗室累計對細胞培養液進行了19次支原體檢測(2015年開始,按照中國疾病預防控制中心脊灰實驗室要求進行支原體檢測),檢測結果均為陰性,表明這期間細胞系沒有被支原體污染。支原體感染細胞培養液后,會黏附于細胞表面,進而影響細胞運輸機制和細胞膜受體。有研究指出,L20B細胞系被支原體污染后,其細胞膜上的PV受體CD155會被支原體干擾,從而降低對PV的敏感性[4]。當支原體檢測為陽性時,必須追溯整個細胞培養的全過程,如更換細胞系來源、對實驗器具消毒處理、重新配置實驗試劑等,重新檢測支原體陰性后才可以進行細胞敏感性實驗。
從重慶市脊灰實驗室2013-2019年的細胞敏感性實驗結果來看,27次細胞敏感性實驗中,L20B細胞系和RD細胞系上各型別LQC的檢測滴度均在期望值±0.5logCCID50/0.1 mL內,表明這期間重慶市脊灰實驗室所用細胞系對PV有著較高的敏感性,24次LQC2007的細胞敏感性實驗表現出在RD細胞系上各型別LQC的滴度均高于L20B細胞系上的滴度,此結果與黑龍江省的相關研究一致[10]。通過細胞敏感性滴度曲線圖可以看出,截至2019年3月21日(第24次實驗),L20B細胞系上的SabinⅠ型LQC滴度均在期望值以下,并且隨時間延長呈現下降趨勢;SabinⅢ型LQC在RD細胞系和L20B細胞系上均表現出滴度下降趨勢。理想的細胞敏感性實驗結果應該是在期望值上下波動,筆者認為上述現象可能由以下因素導致:(1)2007年制備的LQC在確定其期望滴度值時,所用細胞系傳代代數較低,其后進行細胞敏感性實驗所用細胞系已經過多次傳代,細胞系隨傳代代數增加,對LQC的敏感性可能出現衰退[8]。(2)LQC經過長時間的凍存,其病毒活性可能下降。針對這個問題,重慶市脊灰實驗室于2019年4月重新制備了LQC,使用新的LQC進行的3次細胞敏感性實驗結果均正常,新的LQC可用于代替2007年制備的LQC,用于細胞系質量控制。
綜上所述,重慶市脊灰實驗室所用細胞系對PV保持了較高的敏感性,但仍然存在問題,應加強細胞系的質量控制工作。在消滅脊灰的最后階段,脊灰實驗室細胞系的質量控制必不可少,在實際工作中應結合支原體檢測和細胞敏感性實驗兩種方法對細胞系進行質量控制,及時發現存在的問題,保證PV監測系統的敏感性,確保及時、準確地發現與鑒別PV。

