貝萊斯芽孢桿菌對果蔬土傳病害的抑菌效果研究
崔文會, 炊春萌, 孫 雪, 魏 東, 李保國*, 劉 莉*
1. 上海理工大學醫療器械與食品學院,上海200093; 2. 中國科學院上海高等研究院,上海201210
設施果蔬栽培能充分利用太陽光能,保溫保濕,提高抵抗自然災害的能力,為反季栽培提供了保障,確保了果蔬長年供應,滿足了市場需求。但隨著果蔬生產的發展,設施栽培面積不斷擴大,連作栽培導致設施瓜果蔬菜的土壤鹽漬化、土傳病害日益嚴重,以及果蔬品質差、產量降低,影響設施栽培經濟效益[1-3]。設施果蔬土傳病害防治可采用化學殺菌劑、培育抗病品種、間混套作、嫁接等方法,但這些防治措施各有利弊。化學殺菌劑污染環境,農藥殘留危害人畜健康;培育抗病品種的周期長,成本高;間混套作防效慢,效果滯后;嫁接防治需要大量的人力和物力且果實口感變劣。因此,開發綠色環保、高效安全的微生物制劑已成為近年來防治設施果蔬土傳病害的研究熱點[4,5]。
生物防治是利用活體生防菌及其代謝活性物質來控制病害發生的一種技術,生防菌可在作物植株及根際定殖生長,形成生物屏障保護作物免受病原菌侵害,其代謝活性物質一方面抑制殺死病原真菌,另一方面誘導植株提高病害抗性。另外生防菌所分解和轉化的營養元素又可以被作物加以利用,進而提高作物品質、增加產量[6,7]。貝萊斯芽孢桿菌是2005年發現的芽孢桿菌屬的1個新種,在自然界中廣泛分布且對人畜無害、對環境無污染而且對很多病原微生物有抑制作用[8,9]。目前針對設施瓜果蔬菜土傳真菌病害的生防報道不多,本研究以實驗室前期篩選獲得的貝萊斯芽孢桿菌BacillusvelezensisCX-2菌株為研究對象,研究其對4種瓜果蔬菜土傳病害病原真菌的抑菌效果,并對其抑菌特性及耐鹽、促生特性進行初步研究,為進一步的田間應用提供基礎理論參考。
1 材料與方法
1.1 材料
1.1.1供試菌株
生防菌株:貝萊斯芽孢桿菌CX-2,實驗室前期分離自上海崇明農田土壤。
病原真菌:番茄早疫病菌(Alternariasolani)、香蕉枯萎病菌(Fusariumoxysporumf.sp.)由海南大學熱帶農林學院農藥實驗室提供;辣椒疫霉病菌(Phytophthoracapsici)、西瓜枯萎病菌(Fusariumoxysporumf.sp.)購自中國農業微生物菌種保藏管理中心。
1.1.2培養基
LB培養基:酵母膏5 g/L,蛋白胨10 g/L,NaCl 10 g/L,pH值為7.0。固體培養基時另添加15 g/L~20 g/L瓊脂粉,121 ℃滅菌20 min。
5%氯化鈉的固體LB培養基:酵母膏5 g/L,蛋白胨10 g/L,NaCl 50 g/L,20 g/L瓊脂粉,121 ℃滅菌20 min。
10%氯化鈉的固體LB培養基:酵母膏5 g/L,蛋白胨10 g/L,NaCl 100 g/L,20 g/L瓊脂粉,121 ℃滅菌20 min。
PDA培養基:馬鈴薯浸出液200 g/L,葡萄糖20 g/L。固體培養基時另添加15 g/L~20 g/L瓊脂粉,115 ℃滅菌30 min。
1.1.3試劑
Salkowski試劑:濃H2SO410.8 mol /L,FeCl34.5 mol /L。甘油、酒精、氯化鈉、葡萄糖、酵母膏、蛋白胨、瓊脂粉均為分析純試劑,購自上海國藥集團化學藥劑有限公司。
1.1.4儀器
全自動電熱培養箱:上海智城分析儀器制造有限公司;分光光度計:德國BECKMAN COULTER公司;電子天平:德國Sartorius公司;高壓蒸汽滅菌器:日本三洋公司;S1000-PCR擴增儀:美國BIO-RAD;ZWY-2102C恒溫振蕩搖床:上海智城分析儀器制造有限公司;L550醫用離心機:湖南湘儀實驗室儀器有限公司。
1.2 實驗方法
1.2.1平板對峙法
抑菌活性用平板對峙法測定[10]。將4種病原菌進行活化培養5 d,用打孔器在菌落邊緣區域打孔制成直徑為6 mm的病原菌菌餅,放置到PDA平板中央,同時將分離得到的單菌落點接在距離平板中心25 mm處,每皿接種4個菌株,以只放置病原菌菌餅的PDA平板作為對照,重復3次,30 ℃培養箱中培養至對照組中的病原菌菌絲長滿培養基,觀察對照組平板上是否出現拮抗帶,測量相對生防菌CX-2方向病原菌菌絲生長的直徑(D)和抑菌帶寬度(d),計算抑菌率。
抑制率(%)=(對照菌落直徑-處理菌落直徑)/對照菌落直徑×100%
(1)
1.2.2無菌濾液的抑菌活性
CX-2菌株無菌濾液的制備:將菌株轉接到裝有5 mL液體LB的試管中,30 ℃、200 r/min下培養24 h,吸取3 mL菌液,移入裝有50 mL LB培養液的250 mL三角瓶中,30 ℃、200 r/min下培養96 h,然后將上述發酵液10 000 r/min下離心15 min,取離心后的上清液,用孔徑為0.22 μm的細菌過濾器過濾,得到無菌濾液。
無菌濾液抑菌效果的測定:吸取100 μL無菌濾液均勻涂布于PDA平板上,然后在平板中心放置直徑為6 mm的病原菌菌餅,對照組涂布等體積的無菌水后放置相同直徑的病原菌菌餅,重復3次,5 d后觀察并記錄對照組和實驗組病原菌菌餅的直徑大小,采用菌絲生長速率法計算抑菌率[11]。
1.2.3揮發性氣體的抑菌活性
采用平板倒扣法[12]測定揮發性氣體的抑菌活性,將直徑6 mm的病原菌菌餅放置在PDA培養基平板中央。取100 μL CX-2菌株的發酵液在LB培養基平板上均勻涂布,然后將兩平板對扣,封口膜密封,用100 μL無菌水替代菌株發酵液作為對照組,每個處理設3個重復。5 d后觀察病原菌菌絲的生長情況并測量病原菌菌餅直徑,計算抑菌率。
1.2.4CX-2菌株的生長曲線
將已活化的菌株CX-2按3%接種量接種于裝液量為50 mL/250 mL的LB液體培養基中,分別設置一組平行和空白試驗。30 ℃、200 r/min搖瓶培養30 h,每隔3 h取樣,測定培養液的OD600 nm值[13],繪制生長曲線。
1.2.5CX-2菌株的耐鹽特性
將活化好的CX-2菌株分別在含鹽量為5%和10%的LB平板上劃線,將平板倒置放入30 ℃恒溫培養箱中培養48 h~96 h,觀察其生長情況[14]。
1.2.6CX-2菌株產IAA能力檢測
定性初篩:將分離純化后的菌株接種于質量濃度為100 mg/L L-色氨酸的LB液體培養基中,37 ℃、200 r/min條件下搖床培養24 h,之后將菌液10 000 r/min離心10 min,取2 mL上清液加入等量Salkowski顯色劑進行顯色反應。以加入等體積的液體LB作為陰性對照。避光條件下放置30 min后觀察,顏色變紅表示能夠產IAA[15]。
吲哚乙酸標準曲線的制作:配制質量濃度為10 μg/mL ~60 μg/mL,間隔為10 μg/mL的IAA標準溶液,并按照1:1體積比與Salkowski顯色劑混合,室溫避光30 min,分別在波長530 nm條件下測定其吸光度值,以蒸餾水按照1∶1體積比與Salkowski顯色劑混合液為空白對照,以IAA標準溶液質量濃度為橫坐標,OD530nm值為縱坐標繪制IAA標準曲線,得到標準曲線回歸方程為y=0.041 8x+0.021 9,相關系數為R2=0.932。
IAA含量測定:篩選菌株接種于LB液體培養基中,37 ℃、200 r/min條件下搖床培養24 h后取出,10 000 r/min離心10 min,取上清液4 mL與等體積Salkowski顯色劑混合,25 ℃避光反應30 min,測定OD530nm值[16]。根據IAA標準曲線回歸方程計算菌液中IAA含量。
2 結果與分析
2.1 CX-2菌株對4種病原真菌的抑制作用
通過平板對峙法考察CX-2菌株對4種病原真菌辣椒疫霉病菌、香蕉枯萎病菌、番茄早疫病菌、西瓜枯萎病菌的抑菌效果,結果見表1。由表1可看出,CX-2菌株對4種病原真菌的抑菌率分別為60.44%、64.40%、66.39%和62.78%,均在60%以上,說明CX-2菌株可拮抗病原真菌的生長,病原菌菌絲無法在CX-2菌株附近生長,因此在CX-2菌株周圍形成抑菌帶,從而在平板上起到抑制病原菌菌絲生長的作用。
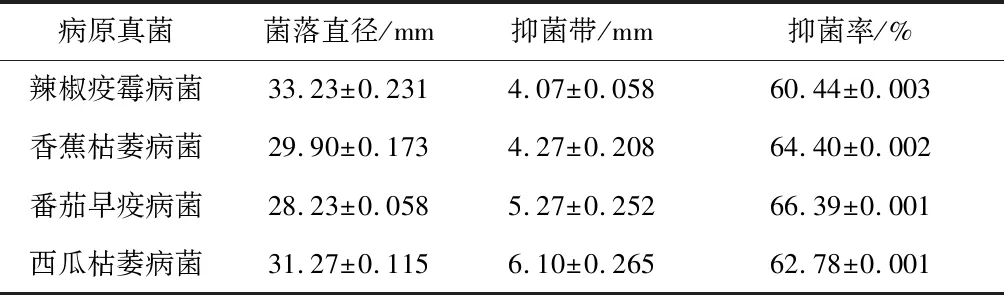
表1 CX-2菌株對4種果蔬土傳病害病原真菌的 抑菌作用
圖1為CX-2菌株對4種病原真菌的平板對峙抑菌效果圖,經過一段時間的培養后,左側未在四周點接生防菌CX-2的病原菌菌絲長滿整個平板,右側為點接生防菌CX-2后的病原菌菌絲生長平板圖,可以看到CX-2可以抑制4種病原菌的生長,在CX-2四周形成了清晰可見的抑菌帶。
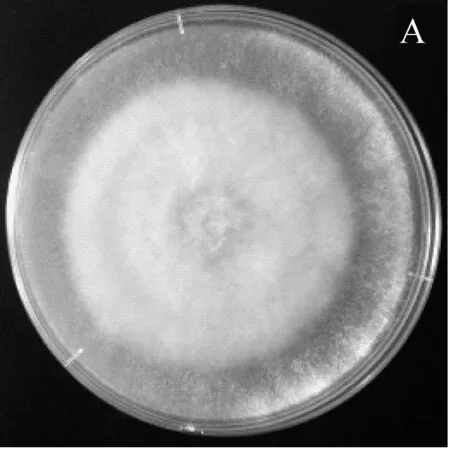
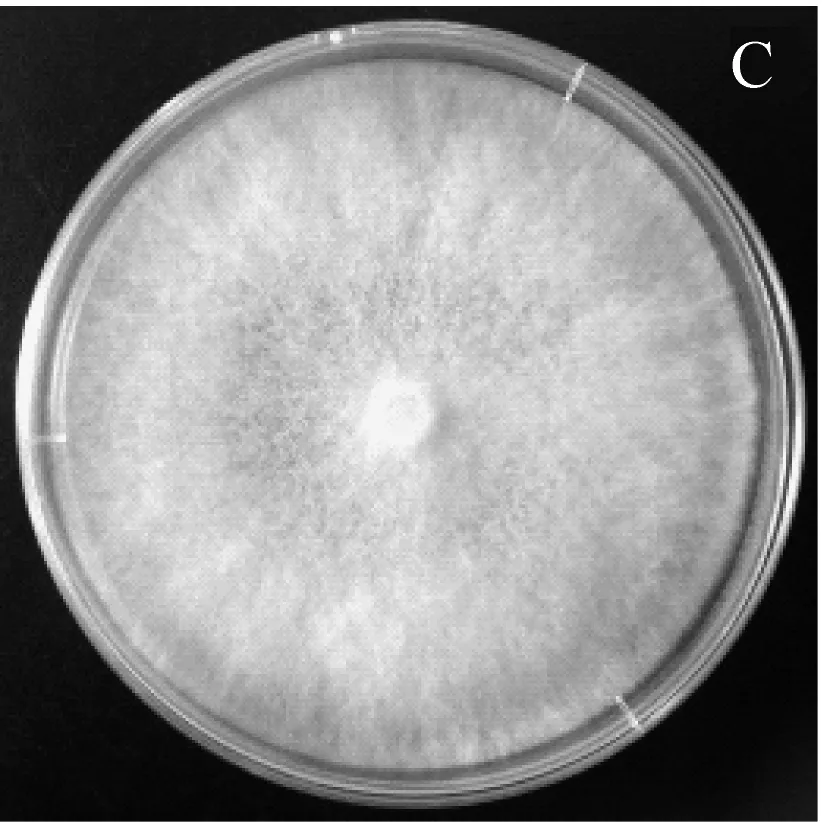
A和a:辣椒疫霉病菌;B和b:香蕉枯萎病菌;C和c:番茄早疫病菌;D和d:西瓜枯萎病菌 其中A、B、C、D為對照組;a、b、c、d為實驗組。圖1 CX-2對4種抑制效果圖
2.2 無菌濾液和揮發性氣體的抑菌活性
CX-2菌株的無菌濾液和揮發性氣體對4種病原真菌的抑菌率如表2所示,CX-2的無菌濾液具有良好的抑菌作用,對4種病原真菌的抑制率均達到了70%以上,對番茄早疫病原真菌的抑菌效果最好,為79.23%。CX-2菌株產生的揮發性物質,也具有抑菌作用,對香蕉枯萎病菌的抑菌效果最大,抑菌率為82.04%。從表2可知生防菌CX-2的無菌濾液和揮發性氣體中均含有可抑制病原菌生長的抑菌活性物質,說明CX-2發揮其生防作用的途徑不止一種,其去除活菌后的無菌濾液仍然可以發揮抑菌作用,另外其揮發性氣體可以抑制病原菌的生長,說明CX-2的抑菌活性物質中含有氣體成分。

表2 CX-2菌株的無菌濾液和揮發性氣體的 抑菌作用
2.3 CX-2菌株的生長曲線
生長曲線可以反映細菌數量、生長狀況和代謝情況,當以獲得大量細菌個體為目的時,可以在細菌的對數期進行操作,以獲得細菌的初級代謝產物為目的時,最好選擇穩定期作為研究對象,若想獲得次級代謝產物,應該選擇衰亡期,此時細菌生長環境惡化,培養液中的次級代謝產物最為豐富。圖2為CX-2菌株的生長曲線,由圖2可知,接種CX-2菌株后,0 h~6 h處于遲緩期,此時菌株生長緩慢,6 h~15 h處于對數生長期,此時菌體數量明顯增多,15 h~27 h為穩定期,菌體數不再增加,在27 h后進入衰亡期,菌體數量開始下降。
2.4 CX-2菌株的耐鹽特性
由于種植設施果蔬的土壤多呈鹽漬化,因此需要考察CX-2菌株的耐鹽特性。利用平板點種法將CX-2菌株分別接種在含鹽量為5%、10%的LB平板上,圖3顯示其生長情況。由圖3可看出,該菌株可以在含鹽量為5%、10%LB平板上正常生長,具有一定的耐鹽特性,可在鹽漬化土壤中生存,因此CX-2菌株可作為開發設施果蔬生防菌劑的功能菌株。
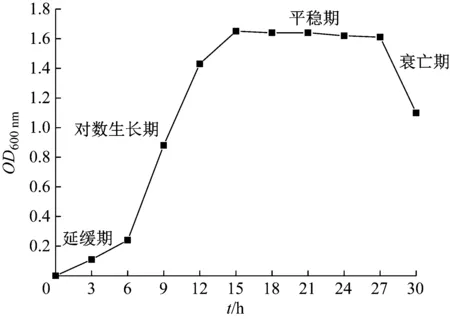
圖2 CX-2菌株的生長曲線
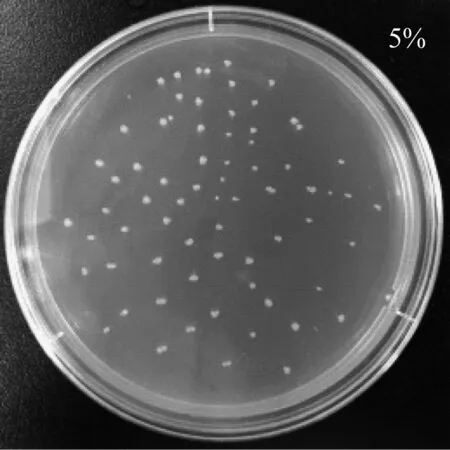
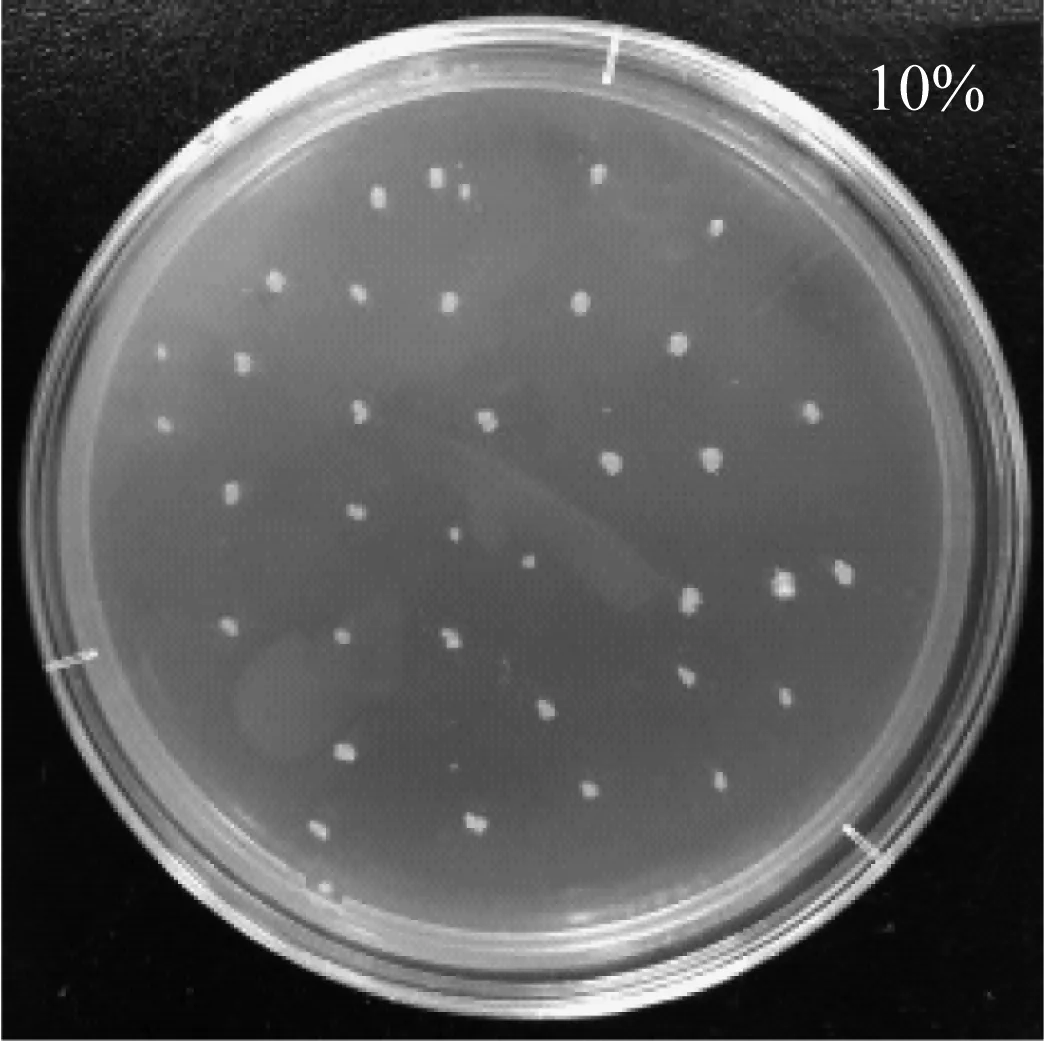
圖3 CX-2菌株在含鹽平板上的生長情況
2.5 CX-2菌株產IAA能力
吲哚乙酸(IAA)是一種植物生長激素,它能夠促進植物的生長,CX-2菌株產IAA的定性檢測結果如圖4所示,左側試管為實驗組,右側試管為陰性對照組,處理后的菌株上清液經Salkowski顯色后,菌株上清液呈現橙紅色,無菌培養基無明顯顏色變化,表明菌株具有產IAA能力。定量檢測CX-2菌株發酵液IAA質量濃度為7.85 mg/L。表明CX-2菌株不僅具備抑制土壤中病原真菌的功能,還可能具備促進植物生長的能力。

圖4 CX-2菌株產IAA能力定性檢測圖
3 結論
為開發設施果蔬土傳病害的生防菌,選取從土壤中分離獲得的貝萊斯芽孢桿菌CX-2菌株,采用平板對峙法和菌絲生長速率法測定其對4種果蔬土傳病害病原真菌的抑菌作用,及其無菌發酵液及揮發性氣體的抑菌效果,進一步研究了該菌的耐鹽特性,及其產IAA的能力,得到如下結論:
(1) 平板對峙實驗證明CX-2菌株對4種果蔬土傳病害的病原真菌:辣椒疫霉病菌、香蕉枯萎病菌、番茄早疫病菌、西瓜枯萎病菌均有拮抗作用,對番茄早疫病菌發揮最大的抑菌作用,抑菌率為66.39%,對其余3種病原真菌的抑菌率也均在60%以上。
(2) CX-2菌株的無菌濾液和揮發性氣體同樣可以抑制病原真菌的生長,其中無菌濾液對4種病原真菌的抑菌率均在70%以上,揮發性氣體對香蕉枯萎病菌抑菌效果最好,抑菌率為82.04%。
(3) CX-2菌株可在含鹽量高達10%的LB平板上生長;CX-2菌株吲哚乙酸的產量為7.85mg/L。表明CX-2菌株可在高鹽環境下正常生長,并且可以產生吲哚乙酸,可能具備促進植物生長的能力。
綜上所述,貝萊斯芽孢桿菌BacillusvelezensisCX-2的活菌、無菌濾液和所產生的揮發性氣體均對所選4種病原菌具有拮抗活性,具有較強的耐鹽和促生能力,可以用于設施果蔬土傳病害的防治,具有開發成生防菌劑的潛力。

