Guselkumab治療銀屑病關節炎療效及安全性meta分析
盧昌佩 景海霞 王潤超 王 恒 羅 亭 步青云
錦州醫科大學十堰市太和醫院研究生培養基地(湖北醫藥學院附屬醫院),湖北十堰,442000
銀屑病是一種較為常見的慢性炎癥性皮膚病,全球患病率約在2%~3%[1],其中有1/3的銀屑病患者有銀屑病關節炎(psoriatic arthritis, PsA)[2],常伴有關節腫痛、僵硬及運動障礙,部分可累及脊柱,嚴重者可造成殘疾,對于患者身心健康產生了嚴重的影響[3]。其發病機制尚不清楚,但是相關研究表明T細胞亞群和其效應細胞因子介導的慢性炎癥對于兩者的發病具有重要意義[4],尤其是最近幾年發現IL-23/Th-17免疫調節通路[5],銀屑病與PsA有著相同的病理生理及臨床特征引起了相關生物制劑的研究[6]。目前關于PsA的治療方案主要為非甾體抗炎藥、糖皮質激素、抗風濕藥物、硫唑嘌呤、維A酸類等,由于療效欠佳及不良反應,臨床上逐漸傾向于生物制劑的研究,腫瘤壞死因子抑制劑經常被選為PsA患者的首選生物療法,但在臨床試驗中,評估的相當大一部分患者并沒有達到美國風濕病學會(ACR)定義的有意義的反應,同時其復雜的安全性,特別是在感染風險方面,進一步限制了臨床應用[7],抗IL-17類生物制劑除了感染風險外,還有可能造成炎癥性腸病的新發或加重[8],其他生物制劑如ustekinumab, 托法替尼等也因安全性使得PsA在藥物選擇上受限[9]。IL-23/Th17細胞通路在PsA的皮膚和關節表現的發生及發展中起關鍵作用[10,11],Guselkumab于2017年7月在美國獲批用于治療中重度斑塊狀銀屑病[12],為一種人源單克隆IgG1抗體,選擇性與IL-23p19結合,抑制IL-23與其表面受體的相互作用,從而阻止IL-23受體介導的信號傳導途徑[13]。近期已有多項臨床試驗證明Guselkumab對PsA有著良好的療效與安全性,本文對Guselkumab治療PsA的療效及安全性進行meta分析,進一步為Guselkumab治療PsA提供依據。
1 資料與方法
1.1 納入標準與排除標準
1.1.1 納入標準 ①研究對象:臨床診斷為PsA≥6個月,年齡≥18歲;② 66個壓痛關節中有3個及以上,68個腫脹關節中有3個及以上,C反應蛋白濃度至少為0.3 mg/dL;③至少有3%的體表面積受到斑塊狀銀屑病的影響;④對標準治療有不良反應或不耐受(≥3個月的抗風濕藥物或≥4周的口服糖皮質激素或非甾體抗炎藥);⑤研究類型:隨機對照試驗(RCT);⑥干預措施:試驗組采用Guselkumab治療,對照組采用安慰劑治療;⑦測量指標:銀屑病關節炎的體征和癥狀改善至少20%患者的例數(ACR 20)、50%的例數(ACR 50)、70%的例數(ACR 70),PASI下降達75%(PASI 75)、90%(PASI 90)的例數,HAQ-D1較基線提高0.35的患者例數,(HAQ-D1即健康狀況評定量表,主要用于評估類風濕關節炎患者的功能狀態,每個問題得分0~3分,得分越高,功能或情緒越差),試驗組和對照組患者發生不良反應(AEs)和嚴重不良反應(SAEs)及其他具體不良反應的例數。
1.1.2 排除標準 ①非RCT;②動物實驗;③研究對象為非PsA患者;④全文中未提供相關結局指標;⑤同一研究,重復發表;⑥質量太差,合并其他疾病的患者。
1.2 檢索策略 檢索Pubmed、Embase、Cochrane Library、萬方數據庫、中國知網及維普數據庫,檢索時間均為建庫起至2020年4月。檢索采用主題詞與自由詞結合的方式。中文關鍵詞為:“銀屑病關節炎和Guselkumab”,英文關鍵詞為“Psoriatic Arthritis和Guselkumab”,納入已經公開發表的文獻。
1.3 資料提取 確定納入文獻后,使用統一設計的數據收集表,由兩位研究者分別對每個隨機對照研究的題目和摘要進行審查和評價,閱讀全文提取數據資料,內容包括:樣本的入選標準和樣本量,受試者的基本信息,治療方案,療效指標等。如資料提取中存在爭議,通過與第三方討論解決分歧。
1.4 文獻質量的評價 采用Cochrane系統評價員手冊所表述的質量評價標準,對納入的文獻進行質量評價。評分標準基于以下6點,主要評價項目包括:(1)研究的隨機方法是否恰當;(2)是否做到分配隱藏;(3)是否正確采用雙盲法;(4)數據是否完整,有無失訪或者退出;(5)是否存在選擇偏倚;(6)是否存在其他偏倚。根據文獻內容是否以及未提及來進行文獻等級劃分,分A、B、C三等。若滿足全部6個條件,則為A等,滿足3個及以上條件為B等,3個以下則為C等。
1.5 統計學方法 采用Review Manager 5.3軟件進行meta分析。算出比值比(risk ratio,RR)及其95%可信區間( confudence interval,CI)。對納入研究間數據行異質性檢驗,判斷異質性大小,如P>0.05且I2<50%則表明無明顯異質性,故采用固定效應模型(fixed model);反之,則有統計學異質性,采用隨機效應模型(random model)進行分析。
2 結果
2.1 納入研究篩選 初檢164篇文獻,采用EndNoteX7軟件排除重復文章31篇,仔細查看文獻標題、摘要后剔除綜述類文獻,與研究不符等110篇,根據納入標準及排除標準,閱讀全文后,最終納入3篇文獻含3個臨床隨機對照試驗進行meta分析,總計納入896例,見圖1。納入對象的用藥方案、年齡、病程、療程等基本特征見表1。
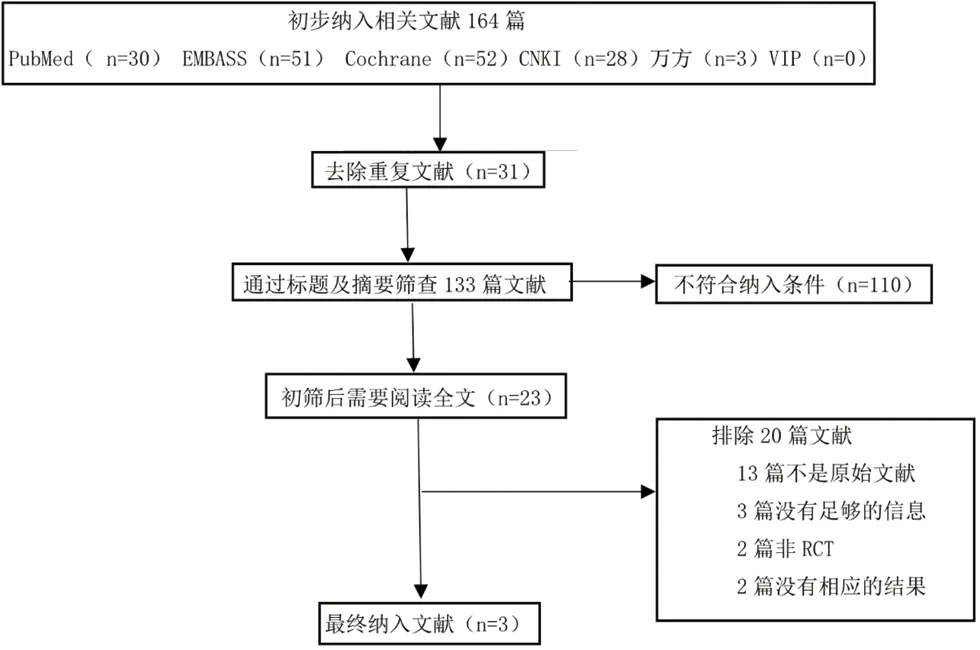
圖1 文獻篩選流程圖
2.2 偏倚風險評估 納入3項研究[14-16]總體質量較高,偏倚風險較低,偏倚風險評估具體見圖2。

圖2 偏倚風險評估圖
2.3 臨床療效
2.3.1 ACR 20 3個研究報道了皮下注射Guselkumab100 mg,每8周1次,治療24周后ACR 20改善的例數與安慰劑比較,各研究間無統計學異質性(I2=25%,P=0.52),故采用固定效應模型合并效應量。結果顯示,兩組差異有統計學意義(RR=2.16,95%CI1.82~2.56),見圖3。
2.3.2 ACR 50 納入文獻均采用皮下注射Guselkumab 100 mg,方案同上,ACR 50改善的例數與安慰劑比較,各研究間輕度異質性(I2=0%,P=0.40),采用固定效應模型合并效應量。結果顯示,100 mg組與安慰劑組比較差異有統計學意義(RR=2.61,95%CI1.94~3.49),見圖4。
2.3.3 ACR 70 同樣試驗組皮下注射Guselkumab 100 mg,每8周1次,對照組安慰劑,時長24周,ACR 70改善的例數與安慰劑比較,各研究間無統計學異質性 (I2=16%,P=0.31),故采用固定效應模型合并效應量。結果顯示:兩組差異有統計學意義(RR=3.80,95%CI2.29~6.30),見圖5。
2.3.4 PASI 75 3項研究均皮下注射Guselkumab 100 mg,每8周1次,治療24周后PASI 75改善的例數與安慰劑比較,各研究間無統計學異質性(I2=47%,P=0.15),故采用固定效應模型合并效應量。結果顯示兩組差異有統計學意義(RR=4.18,95%CI3.28~5.32) ,見圖6。
2.3.5 PASI 90 同樣試驗組皮下注射Guselkumab 100 mg,每8周1次,對照組安慰劑,治療24周后PASI 90改善的例數與安慰劑比較,各研究間無統計學異質性(I2=17%,P=0.30),故采用固定效應模型合并效應量。結果顯示兩組差異有統計學意義(RR=6.67,95%CI4.67~9.52),見圖7。
2.3.6 HAQ-D1 治療24周后HAQ-D1改善的例數與安慰劑比較,各研究間無統計學異質性(I2=0%,P=0.86),故采用固定效應模型合并效應量。結果顯示,兩組差異有統計學意義(RR=1.66,95%CI1.39~1.99),見圖8。
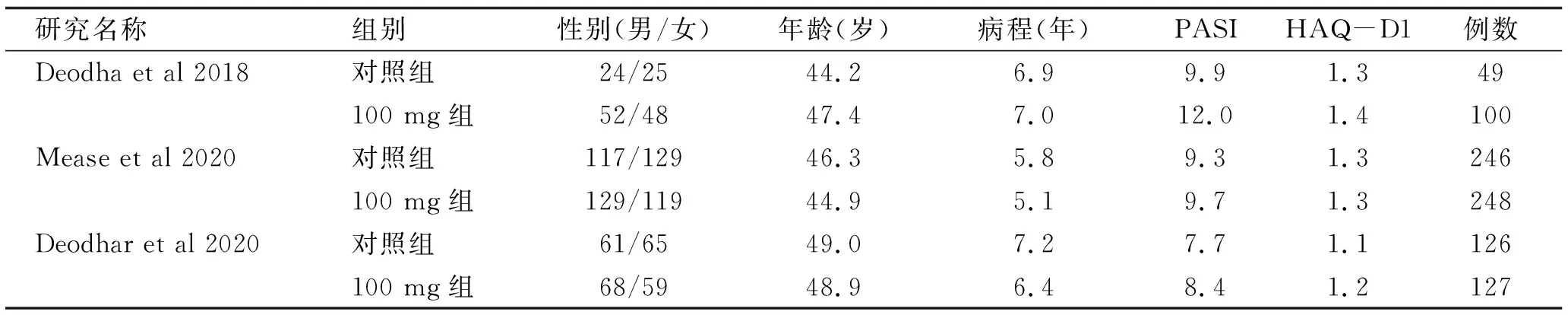
表1 納入文獻基本特征表
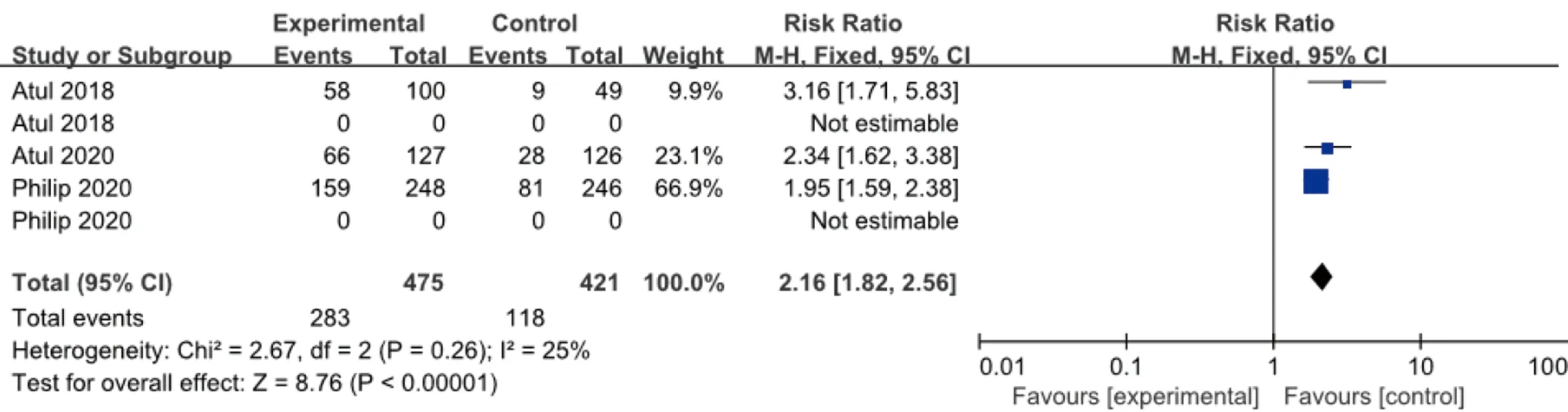
圖3 100 mg組Guselkumab與安慰劑比較達到ACR 20改善例數的meta分析
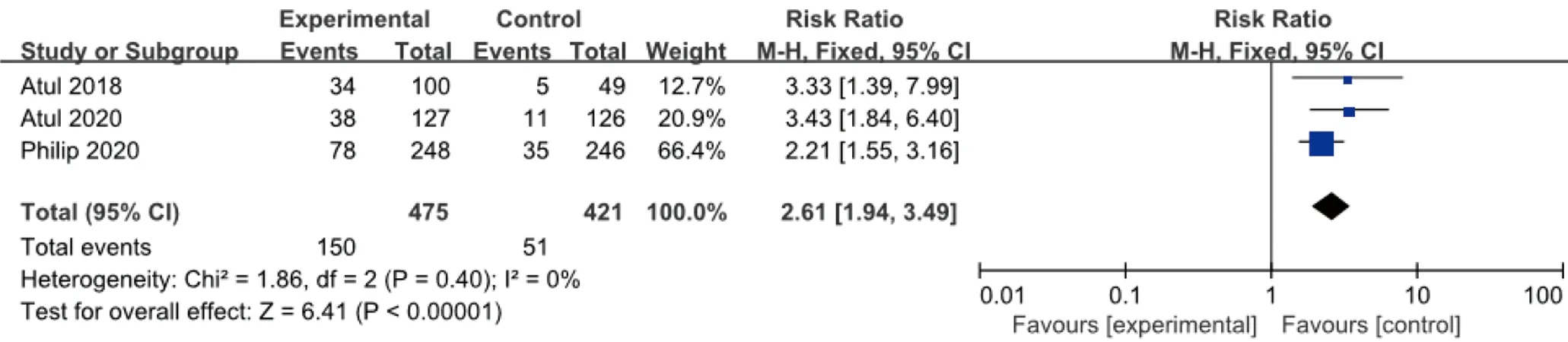
圖4 100 mg組Guselkumab與安慰劑比較達到ACR 50改善例數的meta分析
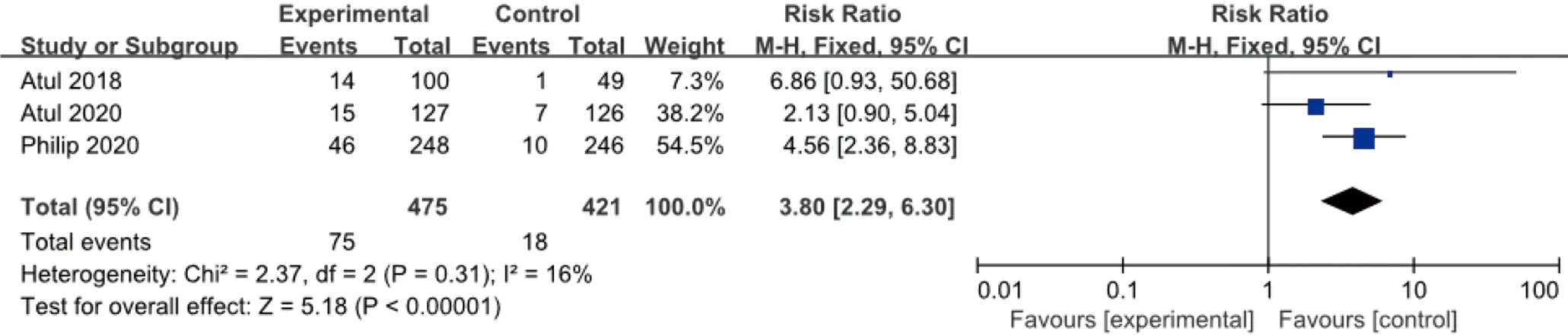
圖5 100 mg組Guselkumab與安慰劑比較達到ACR 70改善例數的meta分析
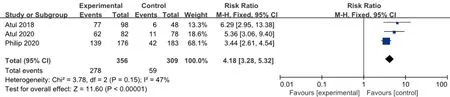
圖6 100 mg組Guselkumab與安慰劑比較達到PASI 75改善例數的meta分析
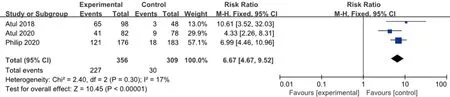
圖7 100 mg組Guselkumab與安慰劑比較達到PASI 90改善例數的meta分析

圖8 100 mg組Guselkumab與安慰劑比較達到HAQ-DI改善例數的meta分析
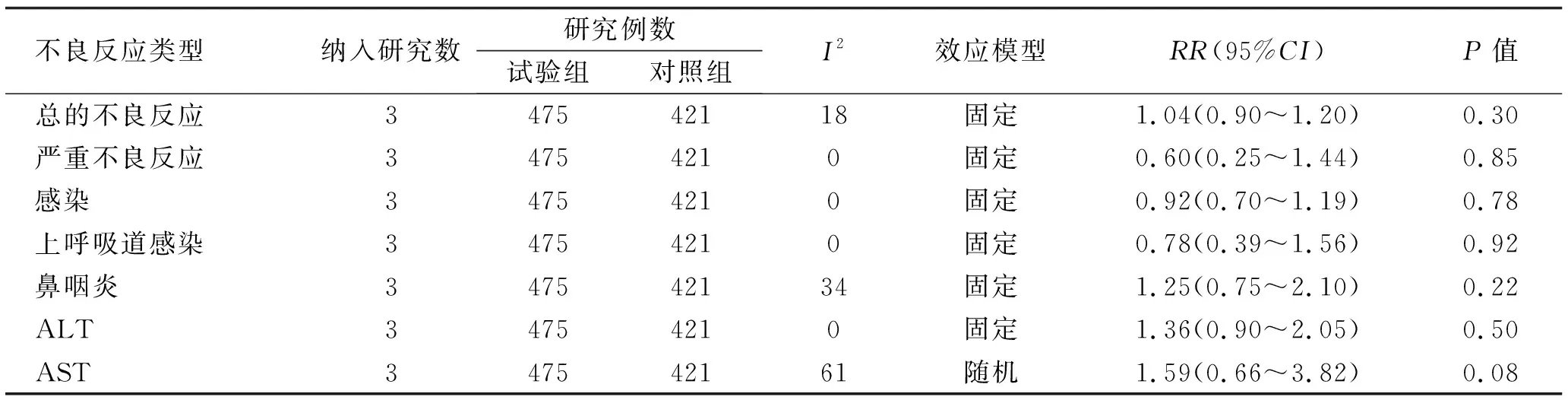
不良反應類型納入研究數研究例數試驗組對照組I2效應模型RR(95%CI)P值總的不良反應347542118固定1.04(0.90~1.20)0.30嚴重不良反應34754210固定0.60(0.25~1.44)0.85感染34754210固定0.92(0.70~1.19)0.78上呼吸道感染34754210固定0.78(0.39~1.56)0.92鼻咽炎347542134固定1.25(0.75~2.10)0.22ALT34754210固定1.36(0.90~2.05)0.50AST347542161隨機1.59(0.66~3.82)0.08
2.4 藥物安全性評價3個RCT均報道了Guselkumab治療組和安慰劑組在治療期間不良反應的發生率。總的不良反應包括研究過程所有的不良反應事件,本研究將導致死亡、危及生命、需要住院治療、導致嚴重殘疾或出生缺陷的不良反應事件定義為嚴重不良反應。3項RCT最常發生的感染事件包括鼻咽炎、上呼吸道感染、肝功能異常,表2可以看出Guselkumab組鼻咽炎(RR1.25,95%CI0.75~2.10),ALT升高(RR1.36,95%CI0.90~2.05),AST升高(RR1.59,95%CI0.66~3.82),以上不良反應的發生率差異均無統計學意義。
3 討論
在過去的十年里,銀屑病的治療發生了革命性的變化。然而,一些患者,包括PsA或對抗腫瘤壞死因子藥物無效的患者,被歸類為難以治療的人群[17,18]。最近發現的IL-23/Th17細胞通路在PsA發病機制中的作用導致了新生物制劑的開發,這些生物制劑在PsA隨機臨床試驗中顯示出較好的耐受性和臨床療效。本文應用meta分析的方法系統評估Guselkumab治療PsA的安全性和有效性。
本研究表明:Guselkumab皮下注射100 mg,間隔時間為0周、4周,以后8周/次,在第24周時顯著提高達到ACR 20、ACR 50和ACR 70的例數;與安慰劑比較,在第24周時能顯著提高達到PASI 75和PSAI 90的例數,與Cameron等[19]的meta分析結果一致;不良反應發生率及嚴重不良反應發生率與安慰劑相比無統計學差異。
本系統評價所納入的研究存在一定的偏倚,但是研究的總體質量較高,且納入的研究比較全面,幾乎都是多中心、研究結果均顯示Guselkumab可以緩解中重度斑塊型銀屑病及PsA患者的癥狀,可能是因為一般陽性結論的文章較容易發表而陰性結論的文章不容易發表,所納入的文獻只是公開發表的,大量未公開發表的文獻沒有檢索到,可能會存在一定的發表偏倚。
綜上所述, Guselkumab治療PsA有良好的效果和較好的耐受性,不良反應與安慰劑對比并未增加,為臨床治療提供了強有力的證據支持,為PsA患者提供了新的治療選擇。由于此次meta分析納入文獻及患者樣本量較少,觀察時間偏短,故今后還需要更大規模、更長時間的臨床試驗來驗證本系統評價的結果。

