IGF2/H19印記基因與男性不育癥相關研究進展*
王 福張愛民杜冠潮趙 豐郭 俊晏 斌** 綜述 郭 軍**審校
1.中國中醫科學院西苑醫院(北京 100091);2.陜西中醫藥大學附屬醫院(陜西咸陽 712000)
基因印記(genomic imprinting)是一種不同于經典孟得爾遺傳定律的現象,指體細胞來源于不同親代的一對等位基因發生的差異性表達;即機體僅表達來自親本其中一方的基因,另一方不表達或較少表達,因而只繼承母源或父源單方的遺傳屬性。如父源印記(paternal imprinting)是指父源等位基因不表達,僅僅母源基因表達,參與該遺傳特性的基因被稱為印記基因[1]。雖然此類基因在基因組中所占百分比較少,但其在生殖發育中發揮重要的作用。胰島素樣生長因子2(insulin-like growth factor-2,IGF2)和H19基因是其中具有代表性基因。兩者定位相近,相互印記,擁有同一調控系統,一起調控人體的生長發育。近年來,隨著科學研究的深入,國內外學者對IGF2和H19的印記調節機制進行了深入的研究,發現IGF2和H19的印記異常與男性不育癥的發生有密切聯系[2,3],本文就此類相關研究最新進展綜述如下。
一、IGF2/H19基因簡介
IGF2為胚胎性生長因子,是分泌的小蛋白質,是一種非常強的有絲分裂原,不受生長激素的調控;其調控諸多生理過程,可促進多種細胞增殖和分化。IGF2基因定位于人體染色體11pl5.5,鼠體7號染色體遠端,是最早發現的內源性印記基因,屬于母源性印記基因,父方表達[4]。在小鼠IGF2基因敲除實驗中,若敲除的等位基因來自母方,則小鼠的生長發育沒有明顯變化,若敲除的IGF2等位基因來自父方,則小鼠相對較小,生長發育受到限制[5]。一般來說,IGF2的表達常常在出生后受到抑制,出生后IGF2主要通過自分泌和旁分泌機制促進局部組織的生長。
H19基因作為一種生長調節基因,在細胞的增殖和分化兩方面具有雙重作用,具有一定選擇表達,在人和鼠的胚胎組織中高度表達。這種現象體現在成人中主要表達部位是骨骼肌、心肌、乳腺等。H19基因位于人體11pl5.5,鼠體7號染色體遠端,與IGF2基因相距僅70kb處,為一單拷貝基因,因其與IGF2基因的連鎖交互性而常放在一起進行研究。與IGF2不同的是,H19基因屬父源性印記基因,母源表達,其只在mRNA水平上發揮作用,最終的表達產物為RNA,不具備表達蛋白質的功能[6]。但與IGF2相同的是,H19基因的表達也在機體出生后明顯受到抑制。
二、IGF2/H19基因印記機制
(一)增強子競爭學說
國外學者提出了增強子競爭學說[7];該學說認為IGF2/H19基因共享H19基因下游位置的增強子(Enhancer);在父源染色體,H19上游的高度甲基化以及猜想中的染色體閉合結構增強子不能作用于H19,使得IGF2激活進而表達;在母源染色體上,由于增強子離H19較近,與H19的親和力更高,使得IGF2沉寂或極少表達,從而激活H19,使之得以表達(見圖1)。
該學說的主要貢獻是通過研究得出H19、IGF2共用一套增強子的結論,奠定了研究H19、IGF2的印記機制的理論基礎。但該學說也有一定的局限性,如對增強子如何選擇IGF2/H19基因的確切機制,并未做出具有高度說服力的解釋等。
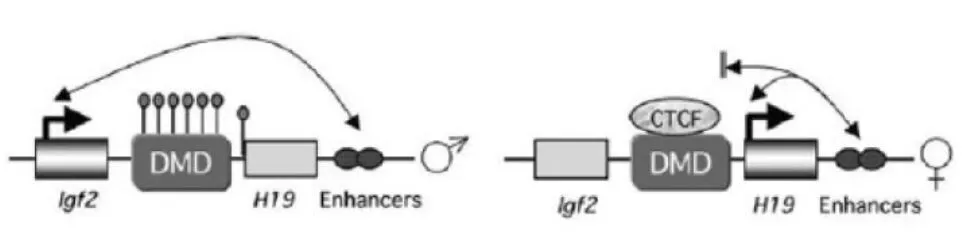
圖1 IGF2/H19基因調控模式圖[8]
(二)CTCF絕緣子學說
根據增強子競爭理論,甲基化使父源H19及母源IGF2保持沉默。尚未明確指出母源IGF2啟動子并未甲基化的原因,根據相關的研究發現,位于H19上游2kb存在差異甲基化區域 (differentially methylated domain,DMD)。DMD即精子與卵子對同一基因具有不同程度的甲基化水平。這個區域有絕緣子(insulator)功能,甲基化控制絕緣子的活動,而DNA甲基化是通過控制CTCF絕緣子蛋白(結合DMD的復合體)起作用的,這是研究H19和IGF2印記機制的突破性進展。
對IGF2/H19基因而言,在父源等位基因上,H19上游及其啟動子CpG島呈甲基化狀態;在母源等位基因上,呈現去甲基化狀態,未甲基化的DMD內絕緣子序列可與CTCF結合形成絕緣子 (CTCF復合體)阻止IGF2基因與其下方增強子相互作用,結果只有H19基因表達。在父源染色體上,DMD內CpG島甲基化導致無法與CTCF結合,從而H19基因下方增強子可以激活IGF2基因啟動子,IGF2基因得以表達;與此同時由于H19啟動子甲基化而保持不表達[9]。可見,DMD在IGF2/H19的印記機制中起了最為關鍵的作用,有學者將此區域亦稱為DMR(differentially methylated region)或印記控制區(imprinting control region,ICR)[10,11]。
(三)其他學說
此外,部分學者還提出了關于IGF2/H19的印記機制的染色質構型學說、轉錄周期學說等相關學說[12,13]。
IGF2/H19基因位于同一印記區域,兩者緊密相連、相互印記。雖然增強子競爭學說及DMD共同調控印記基因IGF2/H19表達是目前較為認同的主要學說,但仍未形成公認。學術界普遍認為IGF2/H19基因的調控機制絕不是單一因素的作用,而應是一個非常復雜的調控系統。
三、IGF2/H19基因與男性不育癥
大量研究表明男性不育癥的發生與IGF2/H19基因表達密切相關。其主要方式是印記松馳(relaxation of imprinting,ROI),即處于印記狀態的基因重新表達從而引起一系列的生理、病理改變,也有學者稱為印記丟失(loss of imprinting ,LOI)[14]。
(一)少精子癥
據Marques CJ等學者[15]研究發現,H19基因的異常甲基化對于男性不育癥的影響主要是影響精子的發生,導致少精子癥。對IGF2/H19基因上47個CpG位點的甲基化進行檢測,精子濃度在20×106/mL以上的男性表現為正常的甲基化水平,其他男性不育癥患者呈現異常甲基化;而精子濃度低于10×106/mL的男性不育癥患者則表現為IGF2-DMD和H19-DMD位點甲基丟失嚴重;該研究表明,H19的異常甲基化與精子發生密切相關。國外另外一篇研究也得出類似的結論,該研究觀察了148名特發性男性不育癥患者以及33名精液正常的對照組IGF2/H19甲基化水平,研究發現對照組IGF2/H19甲基化水平很高。[16]
國內研究也可得出類似研究結果,李建波等[17]通過排除染色體核型分析和Y染色體微缺失等因素干擾,納入18例少精子癥患者(精子濃度<15×106/mL,其余指標均正常)、20例弱精子癥患者 (前向運動精子百分率<32%,其余指標均正常),結果顯示與對照組(20例正常生育男性)甲基化丟失率[(0.30±0.06%]相比,少精子癥患者的H19印記控制區域的LOI顯著增加[(9.19±2.45)%],甚至當精子濃度<3×106/mL時,差異達到極顯著水平(P<0.01)。另外,有研究發現在無精子癥患者中,IGF2基因在睪丸組織中LOI高達52%[18]。
(二)弱精子癥
與IGF2/H19甲基化異常同精子發生異常密切相關的結論相比,其與弱精子癥的相關性存在爭議;董浩等[19]研究發現少精子癥和弱精子癥H19甲基化水平分別是[(75.04±15.35)%]、[(79.48±11.64)%],均顯著低于正常對照組[(89.10±11.23)%],差異具有統計學意義;證實了IGF2/H19甲基化異常除了與少精子癥有關,與弱精子癥也有密切的聯系;但是李建波[17]的相關研究則提示弱精子癥患者H19印記控制區域的DNA甲基化丟失程度與對照組無顯著差異。
(三)畸形精子癥
畸形精子癥與IGF2/H19基因甲基化異常的相關性研究,目前也存在爭議。國外學者發現正常男性精液中的CpG島都呈現高甲基化水平,而在19個畸形精子癥患者中,11人在IGF2 DMR和H19 DMR中的多個CpG位點發生去甲基化,畸形精子癥患者H19表現出多個CpG島低甲基化,該研究證實畸形精子癥可能與IGF2/H19 ICR低甲基化有關[20]。然而董浩等[19]研究發現,畸形精子癥組中的印記基因H19甲基化水平(87.82±12.10)%與正常對照組(89.10±11.23)%的差異無統計學意義。
綜上,弱精子癥、畸形精子癥與IGF2/H19的相關性存在爭議,可能跟弱精子癥、畸形精子癥檢測方法及標準不一致,與樣本量、甲基化檢測方法、種族、地區等相關,弱精子癥、畸形精子癥與H19甲基化異常的相關性需要進一步研究。
四、中醫藥干預IGF2/H19基因表達
隨著IGF2/H19基因與疾病的相關性受到醫學界廣泛關注,其研究相關的思路與技術已逐漸應用到中醫藥研究中。近年來,中醫藥研究主要集中在以下2個方面:(1)IGF2/H19基因甲基化程度的治療前后變化;(2)中醫藥治療對甲基化相關酶的影響。
中醫藥治療男性不育癥,特別是特發性不育癥方面,療效顯著,機制復雜[21,22];但目前國內已有學者關注中藥治療男性不育癥前后IGF2/H19基因表達。研究發現,印記基因H19在腎陽虧虛證類患者的體內表達出現異常,通過補益腎氣的方法予以治療可使H19的表達狀態得到明顯改善。臨床對比顯示,補腎中藥生精方治療腎陽虛患者3個月后,精子密度、(a+b)級精子均較治療前有明顯改善,且治療效果明顯優于對照組;同時,患者的精子H19基因印記丟失率較治療前顯著降低,由 14.71%(5/34)降至 2.94%(1/34);此類研究可證明補益腎氣中藥的作用機理與改善精子DNA印記基因H19表達具有相關性[23]。
五、討論
關于印記基因的DNA甲基化狀態與精液質量關系的研究已然成為生殖領域的熱門研究方向[24]。IGF2和H19作為較早發現的此類基因代表,其印記異常與男性不育癥的發生以及患者病情的發展密切相關。因此,深入研究IGF2/H19基因印記與精子的發生、成熟之間的關系,可能會為男性不育癥的診斷提供新的思路;同時通過更深層次的研究印記基因的DNA甲基化機制,將為男性不育癥的發病機制研究和臨床治療提供新的發展方向。

