TNF-α在調控高糖誘導腎小管上皮細胞程序性壞死過程中的作用
官穎 孟立峰
糖尿病是一組以高血糖為主要特征的代謝性疾病,現已成為我國發病率最高的慢性疾病之一[1]。糖尿病患者由于長期血糖偏高,導致各種組織,尤其是眼、腎、心臟、血管、神經等器官的慢性損害,最終導致器官功能障礙,引發各類疾病[2]。糖尿病腎病在我國糖尿病患者中的發病率呈逐年上升趨勢,目前已成為終末期腎病的第二位原因。糖尿病腎病患者由于體內存在復雜的代謝紊亂過程,一旦疾病發展至終末期,常較其他原因引起的腎臟疾病更嚴重。因此,加深對糖尿病腎病病理過程的研究有利于延緩糖尿病腎病的疾病進程。腫瘤壞死因子-α(Tumor Necrosis Factor-a,TNF-α)作為免疫細胞分泌的主要促炎因子可參與糖尿病腎病演變的全過程。而程序性壞死是受腫瘤壞死因子受體或模式識別受體所調控[3]。本研究通過高糖處理誘導腎小管上皮細胞(normal rat kidney epithelial cell line,NRK52E)程序性壞死的發生并闡明TNF-α 在NRK52E 程序性壞死過程中發揮的作用,加深大眾對于糖尿病誘導的糖尿病腎病病理過程的認知。
1 材料與方法
1.1 細胞 大鼠NRK52E 購自中科院上海細胞庫,用含有10%小牛血清的DMEM 高糖培養液置于37℃、5%CO2、飽和濕度培養箱中培養。
1.2 主要試劑 DMEM(high glucose)、FBS、0.05%胰酶/EDTA 均購自Gibco;無水葡萄糖購于索萊寶公司;Lenalidomide 購于中國selleck 公司;兔抗小鼠TNF-α、RIP1、RIP3 和MLKL 單克隆抗體均購于Abcam 公司;GAPDH 單克隆抗體、辣根過氧化物酶標記羊抗兔IgG 均購于Bioworld 公司;MTS 檢測試劑盒購于伯信生物公司;細胞凋亡與壞死檢測試劑盒購于中國碧云天公司;TNF-α ELISA 檢測試劑盒購于南京建成生物工程研究所。
1.3 細胞活性測定 將NRK52E 以每孔5000 個細胞的濃度接種至96 孔板中。用不同濃度高糖溶液處理NRK52E,通過MTS 檢測試劑盒評估細胞活性。具體方法為:將MTS 染料加入每個細胞孔內并孵育3h。通過評估490nm 處的吸光度來檢測細胞活性。為了實驗結果的一致性,將MTS 測定重復3 次。
1.4 細胞凋亡及壞死染色 將NRK52E 培養于六孔板內,12h 后給予高糖和(或)TNF-α 抑制劑處理。繼續培養48h 后,緩慢吸去原有細胞培養基,向各孔內加入1ml 細胞染色緩沖液、5μl Hoechst 染色液、5μl PI 染色液,混勻,4℃孵育30min,染色后用PBS 洗滌1 次,將六孔板置于熒光顯微鏡下觀察,觀察紅色熒光和藍色熒光強度,評估NRK52E 凋亡和壞死程度。
1.5 酶聯免疫吸附雙聯抗體夾心法 將NRK52E 濃度調整為1×106/L,取1ml 細胞懸液接種于24 孔板中,置于細胞培養箱中孵育12h,12h 后給予高糖和(或)TNF-α 抑制劑處理,繼續培養48h 后,吸取細胞培養基,在12000r/min 的速度下常溫離心20min,將細胞上清液收集于EP 管中,并凍存于-20℃冰箱備用。實驗時取出EP 管,迅速復溶后嚴格按 ELISA 試劑盒說明書進行操作,在酶標儀450nm 處讀取吸光度值,并按照各自標準繪制標準曲線,計算細胞上清液中TNF-α 含量值。
1.6 Western blot 法 檢 測TNF-α、RIP1、RIP3 和MLKL 的蛋白表達水平 將NRK52E 置于PBS 液中洗滌3 次,添加細胞裂解液后置于冰上反應30min,在12000r/min 的速度下冷凍離心20min,收集上清液后應用BCA 法定量蛋白。經凝膠電泳分離和轉膜,5%脫脂奶粉室溫封閉2h,TBST 洗膜后分別加一抗GAPDH(1 ∶5000)、RIP1(1 ∶1000)、RIP3(1 ∶1000)、MLKL(1 ∶1000) 和TNF-α(1 ∶1000),4 ℃孵育過夜,二抗室溫孵育2h,TBST 洗膜3 次后用ECL試 劑 顯 影 曝 光。TNF-α、RIP1、RIP3 和MLKL 以GAPDH 蛋白條帶作為參照,通過Bio-Rad 凝膠成像系統掃描,ImageLab 圖像軟件定量分析每個條帶灰度值。
1.7 統計學方法 采用SPSS 22.0 統計軟件。計量資料以(±s)表示,組間比較采用單因素方差分析(one-way ANOVA),組間兩兩比較采用Bonferroni 校正的t 檢驗,以P<0.05 為差異有統計學意義。
2 結果
2.1 探究含不同濃度葡萄糖的DMEM 高糖培養基對NRK52E 活性的影響 MTS 實驗結果表明,給予含低濃度葡萄糖的DMEM 高糖培養基處理后,NRK52E 的活性無明顯改變,隨著培養基中葡萄糖濃度的增加,細胞活性逐漸降低。在給予含30、60mmol/L 葡萄糖的DMEM 高糖培養基處理后,NRK52E 活性顯著降低,差異有統計學意義(P<0.05,見圖1)。因此,在本研究通過給予含30mmol/L 葡萄糖的DMEM 高糖培養基處理NRK52E 構建糖尿病腎病細胞模型。

圖1 不同濃度葡萄糖處理對于腎小管上皮細胞活性的影響
2.2 高糖培養基可誘導NRK52E 壞死和凋亡改變 為了探究高糖培養基對NRK52E 的損傷作用,本研究通過凋亡和壞死染色試劑盒對細胞進行染色。熒光染色結果表明正常對照組細胞無明顯異常(弱紅色與弱藍色熒光);而給予高糖處理后,NRK52E 出現大量細胞凋亡(弱紅色熒光、強藍色熒光)及壞死(強紅色熒光、強藍色熒光)。
2.3 高糖培養基可誘導NRK52E 程序性壞死相關蛋白表達水平的上調 Western blot 檢測結果表明,與正常對照組比較,給予高糖培養基處理后NRK52E 內程序性壞死相關蛋白RIP1、RIP3 和MLKL 表達水平顯著上調(P<0.05,見圖2)。
2.4 高糖培養基可誘導NRK52E 上清液中及細胞內TNF-α 蛋白表達水平的上調 ELISA 實驗結果表明,與正常對照組比較,給予高糖培養基處理后NRK52E上清液中TNF-α 表達水平顯著上調(P<0.05,見圖3);western blot 檢測結果表明,與正常對照組比較,給予高糖培養基處理后NRK52E 內TNF-α 蛋白表達水平顯著上調(P<0.05,見圖3)。
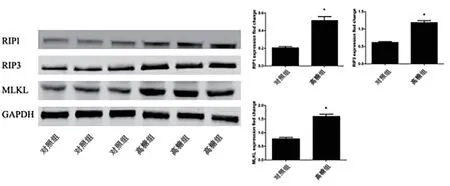
圖2 高糖培養基對于腎小管上皮細胞程序性壞死蛋白RIPI、RIP3和MLKL表達水平的影響
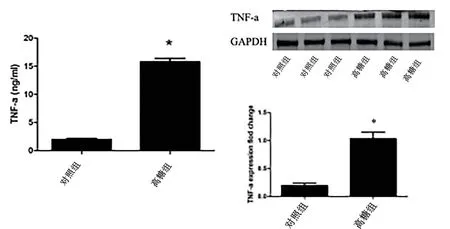
圖3 高糖培養基對于細胞上清液和腎小管上皮細胞內TNF-α蛋白表達水平的影響
2.5 TNF-α 抑制劑處理可下調高糖培養基誘導的NRK52E 程序性壞死 Western blot 檢測結果表明,與糖尿病腎病組比較,給予TNF-α 抑制劑處理可顯著抑制高糖培養基誘導的NRK52E 內程序性壞死相關蛋白RIP1、RIP3 和MLKL 表達水平的上調(P<0.05,見圖4)。

圖5 TNF-α抑制劑對于腎小管上皮細胞內RIPI、RIP3和MLKL蛋白表達水平的影響
3 討論
糖尿病腎病是一種常見的糖尿病并發癥,其主要特征為腎小球肥大和細胞外基質堆積,進而導致腎小球纖維化,最終引起腎功能不全[4]。本研究通過體外實驗構建糖尿病腎病細胞模型從而明確糖尿病腎病的疾病過程,結果表明TNF-α 誘導的程序性壞死在糖尿病腎病的疾病過程中發揮重要的調控作用。
已有大量研究結果表明,程序性壞死在不同疾病過程中發揮重要調控作用,Jun 等[5]的研究表明,程序性壞死可作為腦中風新的治療靶點。Wang 等[6]的研究表明,通過藥物抑制程序性壞死進程可以有效治療脊髓損傷。Coornaert 等[7]的研究表明,通過抑制程序性壞死可以有效延緩動脈粥樣硬化的形成。程序性壞死這種新的死亡模式需要受體相互作用蛋白激酶RIP1、RIP3 和MLKL 的參與,兩者通過結合區相互結合形成誘導死亡信號復合體,從而促進細胞程序性壞死。本實驗通過檢測NRK52E 內程序性壞死相關蛋白RIP1、RIP3 和MLKL 表達水平,從而明確NRK52E 程序性壞死嚴重程度。該研究結果表明程序性壞死在糖尿病腎病的演變過程中發揮重要的調控作用。
有研究表明TNF-α 可通過作用于TNFR 受體激活細胞內程序性壞死過程[8]。在本實驗中,作者通過多種生物學實驗檢測細胞上清液中和細胞內TNF-α 表達水平,結果表明TNF-α 表達水平顯著上調。在給予高糖培養基處理的NRK52ETNF-α 抑制劑處理后,細胞內程序性壞死相關蛋白RIP1、RIP3 和MLKL 表達水平顯著降低。這一實驗結果表明TNF-α 在高糖誘導的NRK52E 程序性壞死過程中發揮重要的調控作用。
綜上所述,本研究發現在給予NRK52E 高糖培養基處理后,細胞上清液中和細胞內炎癥因子TNF-α表達水平以及細胞內程序性壞死相關蛋白表達水平顯著上調。在給予NRK52ETNF-α 抑制劑處理后細胞內程序性壞死相關蛋白表達水平顯著下調。結果表明TNF-α 可通過調控NRK52E 程序性壞死過程促進高糖誘導的NRK52E 損傷,本研究結果為糖尿病腎病治療新的靶點提供了理論依據。

