骨肉瘤干細(xì)胞來源外泌體對(duì)T細(xì)胞增殖及分化的影響
陳思?xì)v楊洪彬*
(1.西南醫(yī)科大學(xué)附屬醫(yī)院骨科,四川瀘州 646000; 2.四川現(xiàn)代醫(yī)院骨科,成都 610041)
骨肉瘤是最常見的原發(fā)惡性骨腫瘤之一,約占原發(fā)性惡性骨腫瘤的1/3,其好發(fā)于兒童和青少年的長(zhǎng)骨干骺端。骨肉瘤的惡性程度極高,早期即可轉(zhuǎn)移,研究報(bào)道約15%~20%的患者在首次出現(xiàn)癥狀時(shí)就已發(fā)生了遠(yuǎn)端轉(zhuǎn)移[1-3]。目前臨床上針對(duì)骨肉瘤的治療方法包括手術(shù)和化療的聯(lián)合治療,但該方法對(duì)已發(fā)生了轉(zhuǎn)移的骨肉瘤患者效果不佳且仍有部分患者在治療后發(fā)生腫瘤的復(fù)發(fā)或遠(yuǎn)處轉(zhuǎn)移[4]。
腫瘤干細(xì)胞(cancer stem cells,CSCs)被認(rèn)為是腫瘤組織中一小部分具有干細(xì)胞自我更新與分化潛能的細(xì)胞亞群[5]。CSCs 的存在是導(dǎo)致腫瘤轉(zhuǎn)移及復(fù)發(fā)的關(guān)鍵因素,這一方面因?yàn)镃SCs 所具有的的干細(xì)胞特性能夠無(wú)限增殖,并通過干細(xì)胞標(biāo)志物如Sox-2、Snail 等促進(jìn)上皮間質(zhì)轉(zhuǎn)化,誘導(dǎo)新生血管形成和招募基質(zhì)細(xì)胞等促進(jìn)腫瘤細(xì)胞的增殖及侵襲;另一方面CSCs 通過與其微環(huán)境中其他細(xì)胞之間相互作用可分泌多種可溶性因子介導(dǎo)免疫抑制,使腫瘤細(xì)胞逃脫機(jī)體的免疫監(jiān)控,進(jìn)而免于受到免疫攻擊[6]。因此,針對(duì)CSCs 及其微環(huán)境的深入研究,對(duì)探尋潛在治療靶點(diǎn)有望解決骨肉瘤早期轉(zhuǎn)移及治療后復(fù)發(fā)的難題。
外泌體(exosomes)是由細(xì)胞分泌的直徑約為30~100 nm 的膜性囊泡,其廣泛存在于多種體液中。研究發(fā)現(xiàn)外泌體內(nèi)包含母體細(xì)胞的蛋白(如CD9、CD63、Hsp70 等 )、DNA、mRNA/miRNA/lncRNA、脂類等多種生物活性成分,故其能夠參與調(diào)節(jié)腫瘤微環(huán)境的形成并在腫瘤細(xì)胞的增殖、免疫逃逸及播散轉(zhuǎn)移等過程中發(fā)揮著重要的作用[7]。而CSCs 作為惡性腫瘤的種子細(xì)胞,對(duì)其外泌體的研究尚鮮有報(bào)道。基于此,本文重點(diǎn)探討骨肉瘤干細(xì)胞來源的外泌體是否影響T 細(xì)胞的增殖及分化,并初步探究其相關(guān)分子機(jī)制。現(xiàn)將結(jié)果報(bào)告如下。
1 材料和方法
1.1 實(shí)驗(yàn)材料
人骨肉瘤細(xì)胞株 MG-63、HOS、U20S、MGHOS均購(gòu)自中國(guó)科學(xué)院細(xì)胞庫(kù)。人外周血由健康志愿者提供。所有志愿者已簽署知情同意書。
1.2 主要試劑
DMEM/F12、RPMI1640、0.25%胰蛋白酶(美國(guó)Hyclone 公司,批號(hào) 8112347、1184655、210175K);胎牛血清(FBS)、青鏈霉素混合液(均為100 U/mL)(杭州四季青生物公司,批號(hào)098N0261、023M755);干細(xì)胞無(wú)血清培養(yǎng)基(加拿大Stemcell 公司,批號(hào)30984);RIPA 裂解液、BCA 蛋白定量試劑盒(美國(guó)Invitrogen 公司,批號(hào) 5571043、044623K);羧基熒光素乙酰乙酸琥珀酰亞胺酯(CFSE)熒光染色(上海麥克林公司,批號(hào) 0122763);OKT3、anti-IL-4、anti-INF-γ、bFGF、EGF、LIF(美國(guó) BioXcell 公司,批號(hào)115848179010、044617K、052723K、c10649、c224616、c779012);IL-2、IL-12、TGF-β(美國(guó) R&D 公司,批號(hào)309316、373528、3136477);CD133/CD3/CD4 細(xì)胞磁珠分離試劑盒、MACS 緩沖液、磁力架、磁珠分選柱(德國(guó)美天旎公司,批號(hào)1045032549、2470848672、MB07512、MB24403);流式抗體 FITC-CD133 mAb(美國(guó) eBioscience 公司,批號(hào) E0947-712);FITCCD3 mAb、PE-CD8 mAb、APC-CD4 mAb、Percpcy5.5- INF-γ mAb、FITC-Foxp3 mAb、PE-cy7-IL-17 mAb (美國(guó) Biolegend 公司,批號(hào) 024137K、277S016、5527190、320186K、077243S,033157K);抗人 T 細(xì)胞表面CD3(OKT3)單克隆抗體(美國(guó)BD Bioscienc 公司,批號(hào) MS-0253L5);ERK、p-ERK、p-STAT1、p-STAT3、p-STAT5、GAPDH、CD63 抗體(美國(guó) Santa Cruz 公司,批號(hào) SC-6641、SC-027、SC-17855-R、SC-02249、SC-44975、SC-559、SC-5227);其他試劑為國(guó)產(chǎn)分析純。
1.3 實(shí)驗(yàn)方法
1.3.1 腫瘤干細(xì)胞球的培養(yǎng)及流式鑒定
常規(guī)復(fù)蘇骨肉瘤細(xì)胞系 MG-63、HOS、U20S、MGHOS 后使用含10% FBS、1%青鏈霉素的DMEM/F12 培養(yǎng)基于37℃、5% CO2恒溫培養(yǎng)箱進(jìn)行培養(yǎng)。待細(xì)胞生長(zhǎng)融合至70%~80%時(shí)用0.25%的胰酶進(jìn)行消化,室溫下 800 r/min 離心 5 min,棄上清,DMEM/F12 重懸細(xì)胞后進(jìn)行傳代。取處于對(duì)數(shù)生長(zhǎng)期的 MG-63、HOS、U20S、MGHOS 細(xì)胞,常規(guī)進(jìn)行消化后,PBS 調(diào)整細(xì)胞密度至1×105個(gè)/孔接種至低粘附細(xì)胞培板中,使用含20 ng/mL bFGF、10 ng/mL EGF 與 10 ng/mL LIF 的無(wú)血清 DMEM/F12 培養(yǎng)基于37℃、5% CO2恒溫培養(yǎng)箱中進(jìn)行培養(yǎng)。經(jīng)無(wú)血清培養(yǎng)基培養(yǎng)10 d 后于顯微鏡下觀察到骨肉瘤細(xì)胞系可形成典型的懸浮生長(zhǎng)骨肉瘤干細(xì)胞球,拍照并計(jì)數(shù)。取無(wú)血清培養(yǎng)的骨肉瘤細(xì)胞系 MG-63、HOS、U20S、MGHOS,培養(yǎng)至第 10 天時(shí)收集細(xì)胞,室溫下300 r/min 離心5 min,取細(xì)胞沉淀用PBS 調(diào)整至細(xì)胞密度為每毫升1×105個(gè),取2 mL 細(xì)胞懸液至流式管中,室溫下300 r/min 離心5 min,棄上清后,加入100 μL 的 PBS 重懸細(xì)胞后,加入抗人 FITCCD133 mAb 抗體,4℃避光孵育30 min,PBS 洗滌細(xì)胞2 次,800 r/min 離心10 min,棄上清,500 mL PBS重懸細(xì)胞后,0.22 μm 濾膜過濾后采用流式細(xì)胞儀檢測(cè)上述培養(yǎng)的腫瘤干細(xì)胞球中CD133+細(xì)胞(即骨肉瘤干細(xì)胞)所占比例。
1.3.2 分離外周血單個(gè)核細(xì)胞(PBMC)
采用Ficoll 密度梯度離心法分離PBMC,簡(jiǎn)述如下:將收集的健康志愿者血液標(biāo)本的抗凝采血管置于離心機(jī)中,常溫下1500 r/min 離心10 min,取下層血細(xì)胞與等體積的PBS 混勻后緩慢勻速加至適量的淋巴細(xì)胞分離液面上,并使其形成界面。將上述得到的分層液體于室溫下在緩升緩降的離心機(jī)中2320 r/min 離心20 min,使其分層,移液管小心吸出中間形成的“云霧層”細(xì)胞,并加入5 倍體積的PBS,室溫下1500 r/min 離心10 min,底層白色沉淀即為分離所需的PBMC,PBS 洗滌細(xì)胞2 次進(jìn)行純化,并細(xì)胞計(jì)數(shù)。
1.3.3 免疫磁珠法分選 CD133+OSCs 與 CD4+T細(xì)胞
應(yīng)用免疫磁珠陽(yáng)選法分別進(jìn)行分選CD133+MG-63 與CD4+T 細(xì)胞,操作參照試劑盒說明書進(jìn)行,分別簡(jiǎn)述如下:①CD133+MG-63 的分選:取生長(zhǎng)狀態(tài)良好的MG-63 細(xì)胞球,4℃、1200 r/min 離心3 min,棄上清,PBS 重懸細(xì)胞后用移液管將細(xì)胞吹打成單細(xì)胞懸液,并計(jì)數(shù)。取 300 μL 約含 1×108個(gè)細(xì)胞的細(xì)胞懸液,并依次加入100 μL 的FcR 阻斷劑與結(jié)合有CD133 單抗的免疫磁珠100 μL,充分混勻后于4℃避光孵育30 min,PBS 洗滌細(xì)胞3 次,4℃、1200 r/min 離心 3 min,棄上清,用 500 μL 的 PBS 重懸并制成單細(xì)胞懸液。按照試劑盒使用說明書進(jìn)行組裝磁力架及分選柱,MACS 緩沖液沖洗分選柱后加入細(xì)胞懸液進(jìn)行分選。待分選結(jié)束后,將分選柱移出磁場(chǎng),加壓收集吸附于分選柱中的細(xì)胞,即為 CD133+MG-63 細(xì)胞。將收集的 CD133+MG-63 于干細(xì)胞無(wú)血清培養(yǎng)基中進(jìn)行培養(yǎng)以備后續(xù)實(shí)驗(yàn)使用,該培養(yǎng)基用于可長(zhǎng)時(shí)間培養(yǎng)干細(xì)胞,并支持細(xì)胞增殖且維持細(xì)胞的多能性。②CD4+T 細(xì)胞的分選:取生長(zhǎng)狀態(tài)良好的PBMC,按前述步驟制成單細(xì)胞懸液后,加入100 μL 的FcR 阻斷劑與結(jié)合有CD4單抗的免疫磁珠100 μL,孵育、洗滌、離心并再次制備單細(xì)胞懸液后,組裝磁力架及分選柱,按前述方法進(jìn)行細(xì)胞分選,最后收集吸附于分選柱中的細(xì)胞,即為CD4+T 細(xì)胞。
1.3.4 骨肉瘤干細(xì)胞外泌體(OSCs-exo)提取及鑒定
取傳至3 代后的 CD133+MG-63 骨肉瘤干細(xì)胞,待細(xì)胞生長(zhǎng)達(dá)70%~80%時(shí)收集培養(yǎng)上清液。按照外泌體分離純化試劑盒說明書方法進(jìn)行提取細(xì)胞上清液中的外泌體,-80℃保存?zhèn)溆谩H?0 μL PBS 稀釋2 μL OSCs-exo,3.5%的多聚甲醛固定后滴加到銅網(wǎng)上,乙酸雙氧鈾負(fù)染,透射電鏡觀察OSCs-exo 形態(tài);用 950 μL PBS 稀釋 50 μL 外泌體,0.22 μm 濾膜過濾外泌體稀釋液后使用納米粒度顆粒跟蹤分析儀進(jìn)行外泌體粒徑檢測(cè);應(yīng)用Western blot 實(shí)驗(yàn)檢測(cè)OSCs-exo 表面特征性蛋白CD63 的表達(dá)。上述實(shí)驗(yàn)單獨(dú)重復(fù)3 次。
1.3.5 T 細(xì)胞增殖檢測(cè)
本研究采取CFSE 染色檢測(cè)OSCs-exo 對(duì)T 細(xì)胞的增殖的影響,實(shí)驗(yàn)步驟簡(jiǎn)述如下:取上述分離純化的PBMC 進(jìn)行細(xì)胞計(jì)數(shù)后,調(diào)整細(xì)胞密度至每毫升 3×107個(gè),加入終濃度為 10 μmol/L 的 CFSE 進(jìn)行混勻,室溫下避光孵育10 min,加入4℃預(yù)冷的10 mL 含10% FBS 的 RPMI-1640 的完全培養(yǎng)基終止反應(yīng),1000 r/min 離心5 min,取下層細(xì)胞沉淀用無(wú)血清的RPMI-1640 洗滌細(xì)胞2 次,1000 r/min 離心5 min,棄上清,用含10% FBS 的RPMI-1640 培養(yǎng)基重懸細(xì)胞,進(jìn)行細(xì)胞計(jì)數(shù)后以備用,整個(gè)操作過程中注意避光。將CFSE 染色的PBMC 分為三組,分別為A 組:接種至預(yù)先用30 ng/mL OKT3 進(jìn)行包被96 孔板中的PBMC,使用完全培養(yǎng)基進(jìn)行培養(yǎng);B組:接種至預(yù)先用30 ng/mL OKT3 進(jìn)行包被96 孔板中的PBMC,并使用終濃度為10 μg/mL OSCs-exo 的完全培養(yǎng)基進(jìn)行培養(yǎng);C 組:接種至未使用OKT3 包被的96 孔板中,使用含10% FBS 的 RPMI-1640 的培養(yǎng)基進(jìn)行培養(yǎng)的PBMC 為對(duì)照。3 組細(xì)胞置于37℃、5% CO2恒溫培養(yǎng)箱中培養(yǎng)5 d,并于第3 天更換各組相應(yīng)的培養(yǎng)基。收集3 組的PBMC,調(diào)整細(xì)胞密度至每毫升1×105個(gè),取2 mL 細(xì)胞懸液至流式管,每管再分為3 份,按照上述流式細(xì)胞步驟加入抗人 FITC-CD3 mAb、APC-CD4 mAb、PE-CD8 mAb 抗體后進(jìn)行檢測(cè) PBMC 中表達(dá) CD3、CD4、CD8 陽(yáng)性的細(xì)胞。上述實(shí)驗(yàn)單獨(dú)重復(fù)3 次。
1.3.6 T 細(xì)胞分化檢測(cè)
取上述免疫磁珠分離獲得的CD4+T,接種至預(yù)先使用1 μg/mL OKT3 包被的48 孔板中,并將細(xì)胞密度調(diào)整至1×106個(gè)/孔。按照實(shí)驗(yàn)?zāi)康膶⒓尤?0 μg/mL OSCs-exo 的CD4+T 設(shè)為實(shí)驗(yàn)組,對(duì)照組為不加OSCs-exo 培養(yǎng)的細(xì)胞,并分別加入含 Th1、Th2、Th17、Treg 誘導(dǎo)分化培養(yǎng)液(Th1 誘導(dǎo)條件:IL-12 15 ng/mL、IL-2 30 ng/mL、anti-IL-4 5000 ng/mL;Th2 誘導(dǎo)條件:IL-12 20 ng/mL、anti-CD28 2 μg/mL、anti-IL-4 10 ng/mL;Th17 誘導(dǎo)條件:IL-6 20 ng/mL、TGF-β 5 ng/mL、anti-IL-4 10 μg/mL、anti-INF-γ 10 μg/mL;Treg 誘導(dǎo)條件:TGF-β 15 ng/mL、IL-2 30 ng/mL、anti-INF-γ 10 μg/mL、anti-IL-4 5000 ng/mL)的DMEM/F12 培養(yǎng)基中,并置于37℃、5% CO2恒溫培養(yǎng)箱中培養(yǎng)5 d,每3 天更換培養(yǎng)基一次。取經(jīng)誘導(dǎo)分化的各組細(xì)胞,棄除原培養(yǎng)基后用含10 ng/mL PMA 與1000 ng/mL 離子霉素的DMEM/F12 于細(xì)胞培養(yǎng)箱中孵育5 h,按上述細(xì)胞流式實(shí)驗(yàn)步驟加入抗人 APC-CD4 mAb、Percp-cy5.5- INF-γ mAb、Percpcy5.5- IL-4、mAb FITC-Foxp3 mAb、PE-cy7-IL-17 mAb 后上機(jī)進(jìn)行檢測(cè) Th1、Th2、Th17 及 Treg 細(xì)胞所占比例。上述實(shí)驗(yàn)單獨(dú)重復(fù)3 次。
1.3.7 蛋白質(zhì)免疫印跡
按照外泌體蛋白提取試劑盒說明方法進(jìn)行提取OSCs-exo 中的蛋白質(zhì),BCA 法進(jìn)行蛋白定量,按照1 ∶4向上清液中加入5×蛋白上樣緩沖液,并于沸水中加熱變性10 min。取30 μg 的蛋白進(jìn)行聚丙烯酰胺凝膠(SDS-PAGE)電泳進(jìn)行蛋白分離,采用濕轉(zhuǎn)法將分離的蛋白轉(zhuǎn)至PVDF 膜上,5%的脫脂牛奶于室溫下封閉2 h 后,分別加入 p-STAT1(1 ∶500)、p-STAT3(1 ∶500)、p-STAT5(1 ∶500)、p-ERK(1 ∶800)、ERK(1 ∶800)、GAPDH(1 ∶2000)、CD63 (1 ∶1000)、Hsp70 (1 ∶1000)一抗,4℃搖床孵育過夜。TBST 溶液清洗3 次,每次5 min,以辣根酶標(biāo)記的二抗(1 ∶5000)室溫孵育 1 h,以 TBST 溶液清洗 3 次,每次5 min。最后均勻滴加ECL 發(fā)光液后于凝膠成像儀進(jìn)行曝光拍照。Image J 軟件測(cè)定條帶灰度值,以目標(biāo)蛋白與內(nèi)參GAPDH 的比值作為其相對(duì)含量。上述實(shí)驗(yàn)單獨(dú)重復(fù)3 次。
1.4 統(tǒng)計(jì)學(xué)方法
采用SPSS 19.0 和 GraphPad Prism 5.0 進(jìn)行統(tǒng)計(jì)分析,數(shù)據(jù)結(jié)果以平均數(shù)±標(biāo)準(zhǔn)差(±s)表示。采用單因素方差分析(One-way ANOVA)進(jìn)行多組間分析,兩組間比較采用獨(dú)立樣本t檢驗(yàn)。顯著性檢驗(yàn)水準(zhǔn) α = 0.05,P<0.05 為差異具有統(tǒng)計(jì)學(xué)意義。
2 結(jié)果
2.1 骨肉瘤干細(xì)胞球的形態(tài)、干性鑒定
采用無(wú)血清懸浮培養(yǎng)法獲取OSCs,細(xì)胞懸浮成球?qū)嶒?yàn)結(jié)果顯示在 4 株骨肉瘤細(xì)胞系 HOS、MGHOS、U20S、MG-63 中,MG-63 的細(xì)胞成球率顯著高于其他三株細(xì)胞系。流式細(xì)胞術(shù)檢測(cè)OSCs 標(biāo)志物CD133 的實(shí)驗(yàn)結(jié)果表明,MG-63 細(xì)胞系中CD133的表達(dá)率(17.1%)明顯高于其他三株細(xì)胞系,見圖1A、1B。光鏡下觀察 MG63 細(xì)胞系分選出的 OSC,可見OSC 呈不規(guī)則球形,表面具有大量棘突伸出,見圖1C。
2.2 OSCs-exo 的形態(tài)及鑒定
選取免疫磁珠分選的CD133+MG-63 OSCs 的外泌體進(jìn)行觀察。透射電子顯微鏡結(jié)果表明,外泌體呈圓形或橢圓形囊泡結(jié)構(gòu);粒徑分析顯示器直徑約為30~100 nm;Western blot 實(shí)驗(yàn)檢測(cè)外泌體標(biāo)志性蛋白CD63、HSP70,結(jié)果顯示在OSCs-exo 中均能高表達(dá) CD63、HSP70。見圖2。
2.3 OSCs-exo 抑制 T 細(xì)胞的增殖
流式細(xì)胞術(shù)檢測(cè)OSCs-exo 對(duì)T 細(xì)胞增殖的影響,結(jié)果顯示與對(duì)照組PBMC 相比,OKT3 可顯著刺激 PBMC 中 T 細(xì)胞增殖(P<0.01),而 OSCs-exo 可顯著抑制OKT3 刺激后PBMC 中T 細(xì)胞的增殖,包括 CD4+、CD8+的 T 細(xì)胞(P<0.05)。見圖3。

圖1 骨肉瘤干細(xì)胞取的形態(tài)及干性鑒定Figure 1 Morphological and phenotypic identification of osteosarcoma stem cells

圖2 OSCs-exo 的形態(tài)結(jié)構(gòu)及鑒定Figure 2 Morphological structure and identification of OSCs-exo
2.4 OSCs-exo 通過下調(diào)ERK 蛋白磷酸化抑制T細(xì)胞的增殖
Western blot 實(shí)驗(yàn)結(jié)果表明與對(duì)照組PBMC 相比,OKT3 刺激后PBMC 中ERK 蛋白的磷酸化水平顯著升高(P<0.05),而OSCs-exo 可明顯抑制OKT3刺激后 PBMC 中 ERK 蛋白的磷酸化水平(P<0.05)。見圖4。
2.5 OSCs-exo 抑制 CD4+T 細(xì)胞的分化
取免疫磁珠分選的CD4+T 細(xì)胞,在不同的培養(yǎng)基中誘導(dǎo)其定向分化后利用流式細(xì)胞術(shù)檢測(cè)OSCsexo 對(duì)CD4+T 細(xì)胞分化的影響,結(jié)果顯示與對(duì)照組細(xì)胞相比,OSCs-exo 可顯著抑制 CD4+T 向 Th1、Th17 的分化,而促進(jìn) CD4+T 向 Th2、Treg 分化,差異均具有統(tǒng)計(jì)學(xué)意義(P<0.05)。見圖5、圖6、表1。
2.6 OSCs-exo 通過 STAT 信號(hào)通路抑制 T 細(xì)胞的分化
Western blot 實(shí)驗(yàn)檢測(cè) OSCs-exo 對(duì) CD4+T 中STAT 信號(hào)通路的影響,結(jié)果顯示與對(duì)照組 CD4+T 細(xì)胞相比,OSCs-exo 能夠顯著抑制細(xì)胞中STAT1、STAT3 蛋 白 的 磷 酸 化 (P< 0.05),而STAT5 蛋白的磷酸化水平無(wú)明顯變化(P>0.05)。見圖7。
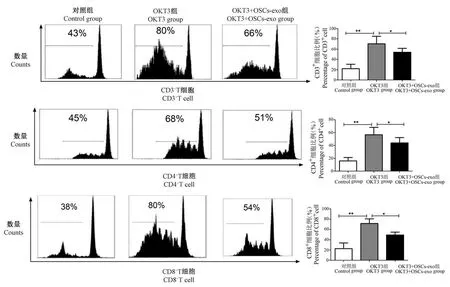
圖3 OSCs-exo 對(duì)T 細(xì)胞增殖的影響Figure 3 Effect of OSCs-exo on T cell proliferation
表1 OSCs-exo 對(duì)CD4+T 細(xì)胞分化影響的結(jié)果分析( ±s,n=3)Table 1 Analysis of the effect of OSCs exo on the differentiation of CD4+ T cells

表1 OSCs-exo 對(duì)CD4+T 細(xì)胞分化影響的結(jié)果分析( ±s,n=3)Table 1 Analysis of the effect of OSCs exo on the differentiation of CD4+ T cells
注:與CD4+T 細(xì)胞組相比,*P<0.05.Note.Compared with CD4+T group,*P <0.05.
組別Groups Th1(%) Th2(%) Th17(%) Treg(%)CD4+ T 細(xì)胞 CD4+ T cell 2.67±1.36 10.17±0.44 2.56±0.17 13.21±1.15 OSCs-exo 與 CD4+ T 細(xì)胞 OSCs-exo+CD4+ Tcell 9.84±0.80* 3.03±0.22* 12.95±1.18* 3.74±0.56*P<0.05 <0.05 0.00 0.00
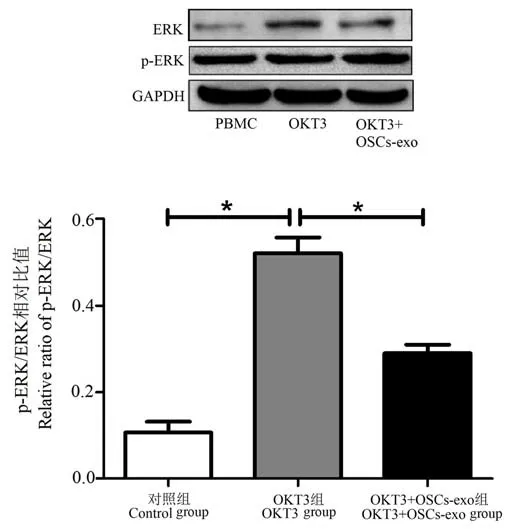
圖4 OSCs-exo 抑制OKT3 所誘導(dǎo)的ERK 蛋白磷酸化水平Figure 4 OSCs-exo inhibits T cell proliferation by down regulating ERK phosphorylation

圖5 OSCs-exo 與CD4+T 細(xì)胞共培養(yǎng)Figure 5 Co-culture of OSCS-EXO and CD4+T cells
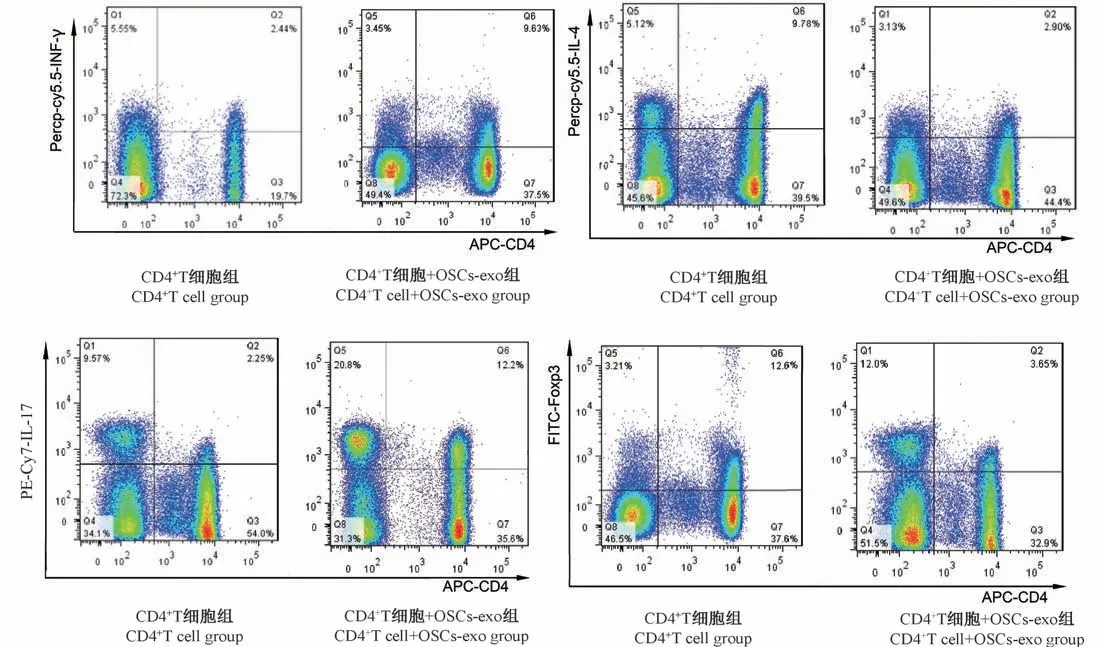
圖6 OSCs-exo 對(duì) CD4+T 細(xì)胞分化的影響Figure 6 Effect of OSCs exo on the differentiation of CD4+ T cells

圖7 OSCs-exo 對(duì) CD4+T 中STAT 信號(hào)通路的影響Figure 7 Effect of OSCs-exo on STAT signaling pathway in CD4+T
3 討論
骨肉瘤是好發(fā)于兒童和青少年的高度惡性腫瘤,復(fù)發(fā)及轉(zhuǎn)移是骨肉瘤預(yù)后不良的主要因素[8]。腫瘤干細(xì)胞是指在腫瘤中少量存在的具有自我更新能力與多向分化潛能的腫瘤細(xì)胞,研究表明其與腫瘤的侵襲、轉(zhuǎn)移、及復(fù)發(fā)密切相關(guān)[9]。因此,探尋靶向骨肉瘤干細(xì)胞的治療方法可能是是改善患者預(yù)后的主要策略。
隨著Gibbs 等[9]于2005 年在骨肉瘤組織中首次發(fā)現(xiàn)并報(bào)道了骨肉瘤干細(xì)胞的存在,相繼有大量學(xué)者從鼠及犬類骨肉瘤細(xì)胞系中分離鑒定出具有干細(xì)胞特性的骨肉瘤類腫瘤干細(xì)胞[10-11]。CD133是一種細(xì)胞膜蛋白,研究發(fā)現(xiàn)其在腦腫瘤、結(jié)腸癌等多種腫瘤干細(xì)胞表明均有表達(dá)[12]。Tirino 等[12]對(duì)SAOS2、MG-63、U20S 3 種骨肉瘤細(xì)胞系中分離出CD133 陽(yáng)性骨肉瘤細(xì)胞,進(jìn)一步實(shí)驗(yàn)證實(shí)該類細(xì)胞能夠表達(dá) Oct3/4、Nanog、Sox-2 等干細(xì)胞基因,并具有向間質(zhì)細(xì)胞分化的能力,且在體外具有很強(qiáng)的腫瘤誘發(fā)功能,因此認(rèn)為CD133 同樣是骨肉瘤干細(xì)胞的特征性表面蛋白。
研究表明CD4+T 細(xì)胞經(jīng)刺激后可分化為不同的亞群,如 Th1、Th2、Th17 及 Treg 細(xì)胞等,其中 Th1細(xì)胞主要通過分泌IL-2、IFN-γ 等細(xì)胞因子介導(dǎo)細(xì)胞免疫,Th2 細(xì)胞主要分泌IL-4、IL-10 等,參與體液免疫[13]。腫瘤免疫主要是細(xì)胞免疫,Th1 細(xì)胞誘導(dǎo)的免疫應(yīng)答能夠抑制腫瘤細(xì)胞的增殖,而Th2 細(xì)胞主要誘導(dǎo)B 細(xì)胞的分化并抑制機(jī)體的細(xì)胞免疫。Th17 細(xì)胞通過分泌 IL-17、TNF-α 等細(xì)胞因子,參與募集中性粒細(xì)胞與促進(jìn)樹突狀細(xì)胞的成熟、協(xié)同刺激Th1 細(xì)胞的活化[14]。
而Treg 細(xì)胞是一群具有免疫抑制作用的CD4+T 細(xì)胞,其主要通過分泌 IL-10 及 TGF-β 并負(fù)向調(diào)控免疫應(yīng)答[13]。近年來,有研究發(fā)現(xiàn)腫瘤干細(xì)胞能夠優(yōu)先通過對(duì)其微環(huán)境中的進(jìn)行免疫調(diào)控以逃逸機(jī)體的免疫攻擊,從而激發(fā)和維持腫瘤的生長(zhǎng)及疾病的進(jìn)展。如在膠質(zhì)瘤中,Di 等[15]研究報(bào)道膠質(zhì)瘤干細(xì)胞能夠抑制來自健康志愿者外周血T 細(xì)胞的增殖并下調(diào)Th1、Th17 亞群細(xì)胞的免疫應(yīng)答。外泌體作為攜帶母體細(xì)胞相關(guān)抗原,如MHC-1 類分子、粘附分子1、共刺激分子86 等免疫信息分子的重要信息傳遞介質(zhì),在參與腫瘤干細(xì)胞對(duì)其微環(huán)境的免疫調(diào)控中發(fā)揮著不可忽視的作用,如 Wang等[16]研究發(fā)現(xiàn)在多發(fā)性骨髓瘤中,骨髓基質(zhì)干細(xì)胞來源的外泌體可激活STAT1 與STAT3 信號(hào)通路促進(jìn)抗凋亡蛋白BCL-1 與MCL-1 的表達(dá),直接誘導(dǎo)骨髓源性抑制性細(xì)胞(MDSC)存活,并進(jìn)一步刺激后者釋放更多的一氧化氮以抑制T 細(xì)胞功能,從而有助于腫瘤細(xì)胞的免疫逃逸。本研究首先通過無(wú)血清懸浮培養(yǎng)與干細(xì)胞標(biāo)志物CD133 流式分選方法成功獲得了人骨肉瘤干細(xì)胞,又通過免疫磁珠分選法對(duì)其進(jìn)行分離純化,采用外泌體分離純化試劑盒收集OSCs-exo,并利用透射電鏡、粒徑分析檢測(cè)及Western blot 進(jìn)行鑒定,實(shí)驗(yàn)結(jié)果表明獲取的OSCsexo 呈圓形或橢圓形囊泡結(jié)構(gòu),直徑約為30 ~100 nm 且高表達(dá)外泌體標(biāo)志性蛋白CD63、HSP70。
研究發(fā)現(xiàn)腫瘤干細(xì)胞免疫逃逸的根源在于腫瘤微環(huán)境中免疫細(xì)胞生物學(xué)行為的改變[9]。而T細(xì)胞的增殖與活化并不偶聯(lián),Dietz 等[17]應(yīng)用抗腫瘤藥伊馬替尼處理經(jīng)PMA 刺激的人初始CD4+T 細(xì)胞發(fā)現(xiàn),伊馬替尼可通過降低ERK 信號(hào)通路的磷酸化水平抑制T 細(xì)胞的增殖,但其并不影響T 細(xì)胞活化標(biāo)志物CD25 與CD69 的表達(dá)。細(xì)胞外信號(hào)調(diào)節(jié)激酶(extracellular signal-regulated kinase,ERK)作為MARK/ERK 通路中的一個(gè)關(guān)鍵成分,廣泛參與調(diào)節(jié)細(xì)胞的分化、增殖、侵襲、凋亡等多種生物學(xué)過程。在細(xì)胞中,被激活的ERK 發(fā)生磷酸化,并由隨后胞質(zhì)轉(zhuǎn)移至細(xì)胞核內(nèi),進(jìn)而活化下游相關(guān)轉(zhuǎn)錄因子,參與細(xì)胞的多種生物學(xué)反應(yīng)[18]。Dumont 等[19]研究表明ERK 信號(hào)通路特異性阻滯劑PD98059 能夠明顯抑制OKT3 刺激后的T 細(xì)胞增殖能力。這提示ERK 信號(hào)通路在T 細(xì)胞的增殖過程中發(fā)揮著重要作用。STAT 是潛在的信號(hào)轉(zhuǎn)錄因子和轉(zhuǎn)錄激活因子,其作為JAK 信號(hào)通路的底物,能夠被后者磷酸化,而磷酸化的STAT 形成二聚體,依賴核蛋白作用因子穿膜進(jìn)入核內(nèi),從而激活或抑制靶基因的轉(zhuǎn)錄,產(chǎn)生生物學(xué)效應(yīng)。其中STAT1/3/5 在免疫細(xì)胞的活化中發(fā)揮重要的調(diào)節(jié)作用[20-21]。為明確OSCsexo 對(duì)T 細(xì)生物學(xué)行為的影響,筆者將OSCs-exo 與健康志愿者來源的PBMC 進(jìn)行共培養(yǎng),CFSE 染色及細(xì)胞流式實(shí)驗(yàn)檢測(cè)其對(duì)T 細(xì)胞增殖的影響,實(shí)驗(yàn)結(jié)果表明 OSCs-exo 能夠明顯抑制 CD3+、CD4+、CD8+T 細(xì)胞的增殖。Western blot 進(jìn)一步實(shí)驗(yàn)檢測(cè)其相關(guān)作用機(jī)制,結(jié)果表明OSCs-exo 可能通過下調(diào)ERK 蛋白磷酸化抑制T 細(xì)胞的增殖。在探究OSCsexo 對(duì)T 細(xì)胞分化的實(shí)驗(yàn)中,本研究發(fā)現(xiàn)OSCs-exo能夠抑制CD4+初始T 細(xì)胞向Th1 及Th17 細(xì)胞的分化,但能夠促使其向 Th2 與 Treg 細(xì)胞的分化,Western blot 實(shí)驗(yàn)結(jié)果表明OSCs-exo 對(duì)CD4+T 細(xì)胞分化的影響可能是通過抑制 STAT 信號(hào)通路中STAT1 與STAT3 蛋白的磷酸化而發(fā)揮作用。
綜上所述,本研究發(fā)現(xiàn)骨肉瘤干細(xì)胞來源的外泌體能夠通過下調(diào)ERK 蛋白的磷酸化抑制T 細(xì)胞的增殖,并降低磷酸化STAT1 與STAT3 蛋白的表達(dá)以誘導(dǎo)CD4+T 細(xì)胞向Th2、Treg 細(xì)胞分化,而抑制其向Th1、Th17 的分化,從而下調(diào)骨肉瘤干細(xì)胞微環(huán)境中的細(xì)胞免疫功能,最終達(dá)到促進(jìn)腫瘤的進(jìn)展目的。然而,上述作用機(jī)制可能僅僅是一個(gè)方面,有關(guān)骨肉瘤干細(xì)胞外泌體的其他作用,尚需進(jìn)一步研究探討。
 中國(guó)比較醫(yī)學(xué)雜志2020年10期
中國(guó)比較醫(yī)學(xué)雜志2020年10期
- 中國(guó)比較醫(yī)學(xué)雜志的其它文章
- 免疫缺陷小鼠和人源化小鼠模型在干細(xì)胞質(zhì)量控制中的應(yīng)用
- 線粒體自噬及功能障礙與帕金森病
- IVC換籠標(biāo)準(zhǔn)操作程序與小鼠病毒病原的傳播風(fēng)險(xiǎn)
- 動(dòng)態(tài)工況下SPF級(jí)實(shí)驗(yàn)兔飼養(yǎng)微環(huán)境模擬分析
- 抗癇增智顆粒調(diào)控TLR4/HMGB1/p-IκB-α信號(hào)通路保護(hù)癲癇幼鼠海馬神經(jīng)元的分析
- 頭針療法聯(lián)合重復(fù)經(jīng)顱磁刺激對(duì)腦卒中大鼠神經(jīng)功能的改善作用及對(duì)PKA/CREB信號(hào)通路的影響
