腔內分流栓在大鼠腹腔異位心臟移植中的應用
鄭偉鋒米 睿郭書棟羅志強王成蕊李 彤
(1.天津醫科大學三中心臨床學院,天津 300170; 2.天津市第三中心醫院,天津 300170;3.天津市人工細胞重點實驗室,天津 300170)
建立大鼠腹腔異位心臟移植模型是研究心臟移植相關問題的重要手段[1]。1964 年,Abbott 等[2]首先完成了大鼠異位心臟移植。1969 年,Ono 等[3]將其改進為端側吻合后使之成為經典術式。然而,在操作中,長時間阻斷腹主動脈造成了遠端組織器官缺血,增加了受體血栓形成、截癱、組織壞死的風險,導致手術失敗率增加[4]。同樣,在血管外科、神經外科及心臟外科中也面臨著類似的問題。Trapp等[5]率先報道了分流技術應用于非停跳冠脈旁路移植術中可減輕了遠端心肌組織的缺血。目前,血管腔內分流栓經過不斷改進已普遍應用于非停跳冠狀動脈旁路移植術中。所以,本研究嘗試將此項技術應用于大鼠腹腔異位心臟移植術中比較其與傳統方法的受體保護方面的作用。
1 材料和方法
1.1 實驗動物
雄性 SPF 級 SD 大鼠,月齡為 2 ~4 月,體重 250~450 g,共40 只。由中國食品藥品檢定研究院(大興)提供[SCXK(京)2017-0005],本研究在實驗動物飼養和實驗過程均在天津市中西醫結合醫院(天津南開醫院)的屏蔽設備中進行[SYXK(津)2015-0007]中完成,飼養環境中的溫度(24±2)℃、相對濕度(50±5)%、換氣次數、明暗周期等均符合中華人民共和國國家標準(GB14925-2010)。實驗動物使用“減少、替代和優化”3R 原則給予人道的關懷,并經天津醫科大學動物倫理委員會批準實驗(DWLL-20191015)。將實驗大鼠隨機分成傳統組及改進組。傳統組供體及受體各10 只,改進組供體及受體各10 只。
1.2 主要試劑與儀器
戊巴比妥鈉粉末(天津中西醫結合醫院實驗動物中心,天津);肝素鈉注射液(每支12500 U,天津生物化學制藥有限公司,國藥準字H12020505);0.9%氯化鈉注射液( 上海百特,國藥準字H10964996);HTK 心臟液500 mL(赫特金TM福州海王福藥制藥有限公司,國食藥監械(準)字2014 第3450187 號);中性福爾馬林固定液(河北同和生物制品有限公司);大鼠血漿乳酸脫氫酶(Lactate Dehydrogenase,LDH)ELISA 試劑盒、大鼠 M 型肌酸激酶(CKM)(Creatine Kinase M,CKM)ELISA 試劑盒(上海酶聯生物科技有限公司);蘇木素尹紅(HE)染色試劑盒(上海威奧生物科技有限公司)。
手術器械包、腹腔撐開器及血管外科顯微器械(上海金鐘);15°Stab 刀(上海晶明);9-0 醫用無損傷帶針尼龍縫合線數根;3-0 及4-0 慕絲縫合線(強生愛惜康 美國);1 mL、5 mL 及10 mL 空針(BD Emerald TM 美國);20G 鈍性灌注針頭 1 枚、TOPOTM傳統型動物呼吸機(Kent Scientific 美國);尼康體視變焦顯微鏡SMZ745T(Nikon 日本);全自動病理脫水機系統(Leica 德國);石蠟切片機(Leica 德國);BX-51 顯微鏡(OLYMPUS 日本);自制分流栓(由材質為環氧乙烷,內徑為1.1 mm,流量為60 mL/min的20GA BD 動脈穿刺套管制成,其長度分別為8 mm、10 mm、12 mm 及 15 mm)見圖1。
1.3 實驗方法
大鼠于術前12 h 禁食,自由飲水。給予2%戊巴比妥鈉(40 mg/Kg)腹腔注射麻醉后仰臥固定于帶加熱板的手術臺上,備胸、腹部皮膚,碘伏消毒后鋪無菌巾單。
1.3.1 獲取供體心臟
經口插入自制氣管插管。分離右側頸總動脈,結扎遠心端并夾閉近心端后插入20G 灌注針頭。正中開胸后迅速接呼吸機機械通氣(10 mL/kg,每分鐘60 次)[6]。去除胸腺組織,充分暴露心臟及大血管。經右頸總動脈插管緩慢推注4℃HTK 液約10 mL 致心臟停搏[7]。游離升主動脈至左側鎖骨下動脈處,結扎其主要分支。結扎并切斷左、右上腔靜脈及下腔靜脈。分離并結扎雙側肺門組織及心底部組織。由近左側鎖骨下動脈處橫斷主動脈,摘取心臟。由主動脈弓再次緩慢推注4℃HTK 至心腔內無明顯血液。小心分離主肺間隔,肺動脈主干應盡可能留長。將供心置于 4℃HTK 液中恒溫保存[8]。

圖1 自制分流栓樣品Figure 1 Self-made intraluminal shunts
1.3.2 改進組手術方法
將受體大鼠麻醉、固定及消毒。上腹部正中切口3~5 cm,開腹后將小腸輕推至左上腹并用生理鹽水濕紗布覆蓋。于右腎動脈至髂總靜脈間游離腹主動脈及下腔靜脈并去除部分脂肪及結締組織,小心分離并結扎部分下腔靜脈背部屬支。分離血管最好由頭至尾方向進行[9]。經右側髂腰靜脈注射肝素(500 U/kg)后將其結扎。用小血管夾將分離出的下腔靜脈分別于右腎靜脈下端水平及髂總靜脈上端水平夾閉。在其中部正中用15°Stab 刀切開一縱行小口[10],精細剪刀沿切口上、下極做長3 ~4 mm 切口。肝素鹽水充腔后,將自制分流栓輕柔置入下腔靜脈內,再次排氣充腔,分流栓兩端用4-0絲線結扎固定。開放遠心端血管夾確認無出血后開放近心端血管夾,可見分流栓內血液流動。腹主動脈切口的中點與下腔靜脈切口上極平齊。根據腹主動脈長度選取適當長度的分流栓,分流栓過長在置入和取出時較困難,而過短則會影響吻合。置入和固定分流栓的方法同前,開放血管夾次序相反。血管吻合于尼康體視變焦顯微鏡下進行。將供體心臟放置于受體右下腹內,鹽水紗布包裹,間斷4℃鹽水降溫[4,9]。用9-0 尼龍線將主肺動脈與下腔靜脈做吻合,再將供心的升主動脈與受體的腹主動脈吻合[11-12],吻合后暫不收線打結。再次夾閉下腔靜脈及腹主動脈,剪開結扎線并輕柔取出分流栓,再次注入肝素鹽水排氣。收緊下腔靜脈吻合口縫線,輕輕開放遠心端血管夾確認無明顯出血后打結后開放近心端血管夾。然后,收緊腹主動脈吻合口縫線輕輕開放近心端血管夾,無明顯出血后打結,開放遠心端血管夾。見圖2。
1.3.3 傳統組手術方法
參照經典腹腔異位心臟移植方法,打開腹腔后游離腹主動脈和下腔靜脈并阻斷,血管前壁做切口與供心升主動脈和肺動脈吻合,待吻合完畢后統一開放[13]。
恢復血流后,供體心臟顏色逐漸轉為粉紅色,并在1~2 min 恢復規律心跳。記錄兩次阻斷腹主動脈。逐層關腹,背部皮下注射溫生理鹽水2 mL 補液。受體大鼠術后分籠飼養并予以保溫促進受體的復蘇。術后3 d 可給予正常飼料及糖鹽水喂養,觀察腹部切口情況,每日觸診腹部心臟搏動情況。兩組均記錄從開腹至關腹完成的總手術時間及阻斷腹主動脈的總缺血時間。
1.3.4 下肢肌肉組織病理
供體心臟開放前,經左側下肢皮膚切口采集約2×3 mm 長度肌肉組織后止血縫合,中性福爾馬林固定保存。制作成病理切片,HE 染色顯微鏡下觀察。
1.3.5 血清肌酸激酶(CKM)和乳酸脫氫酶(LDH)含量
關腹后,經受體大鼠尾靜脈采集血液標本,抗凝后離心,取上清液,-80℃保存。按照試劑盒提供使用說明書測定血漿CKM 和LDH 含量。
1.4 統計學方法
采用SPSS 22.0 軟件分析數據,計量資料以平均數±標準差(±s)表示,檢驗正態性,兩組數據符合正態分布采用t檢驗,不符合正態分布則使用秩和檢驗;P<0.05 差異有統計學差異。
2 結果
2.1 兩組手術總時間及下肢總缺血時間比較
改進組手術成功10 只,供心存活72 h 以上,無下肢缺血及截癱發生,未發現吻合口出血。傳統組手術成功9 只,1 只死于術后吻合口出血。
傳統組的總手術時間及總缺血時間的均數及分別為(86.9±6.3)min、(59.5±7.2)min;改進組的總手術時間及總缺血時間均數分別為(82.4±9.3)min、(21.7±4.7)min。兩組總手術時間比較無統計學差異(P=0.225),而兩組下肢總缺血時間有統計學差異(P<0.05),見表1。
2.2 病理表現
通過比較兩組受體下肢肌肉組織病理切片顯示,改進組下肢肌肉組織細胞基本正常,橫切面未見明顯細胞水腫改變,縱切面可見肌肉組織排列規則,未見明顯排列紊亂及肌絲斷裂表現,血管內未見明顯血細胞堆積和淤滯,見圖3A、3C、3E。傳統組下肢肌肉出現明顯異常,橫切面可見明顯細胞腫脹、飽滿、細胞間隙狹窄;縱切面可見肌肉組織排列不規則,橫紋紊亂及肌絲斷裂,動靜脈內大量血細胞堆積,符合肌肉損傷表現,見圖3B、3D、3F。
2.3 CKM 和 LDH 比較
傳統組中 CKM(32.8±6.5)U/L,LDH(49.5±10.0)U/L,改進組中 CKM(12.8±4.8)U/L,LDH(25.6±9.2)U/L。傳統組中 CKM 及 LDH 水平均升高,兩組比較均有統計學差異(P<0.05),見表2。
3 討論
大鼠異位心臟移植按部位不同主要分為頸部異位心臟移植及腹部異位心臟移植兩種,兩者在手術時間、手術成功率及術后的免疫反應等方面無明顯差別[14]。由于腹腔異位心臟移植有以下優點:血管不易痙攣;腹腔內空間較大,對供心壓迫較小;供心不易受外部環境影響,方便喂養并且能長期存活等,因此其仍然是研究大鼠心臟移植的重要模型。但是,該方法在實施中對術者的操作技術要求高且學習周期較長,所以學者們在不斷嘗試對其改進。例如邵孟平等[15]將供體右肺動脈與受體的下腔靜脈做吻合,王曉亮等[16]采用套管法將供心的升主動脈及主肺動脈與供體的左腎動、靜脈相吻合。這些改進措施使其技術難度相對有所降低,對于供心及受體也起到了一定的保護作用。

圖2 分流栓置入及取出Figure 2 Placement and removal of intraluminal shunts
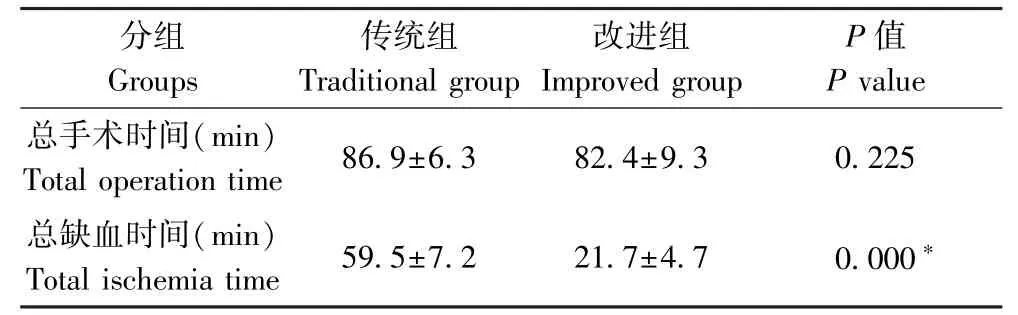
表1 兩組手術總時間及下肢總缺血時間比較(n=10)Table 1 Comparison of total operation time and total ischemia time of lower limbs between the two groups

表2 兩組中CKM 和LDH 的比較(n=10)Table 2 Comparison of CKM and LDH in two groups
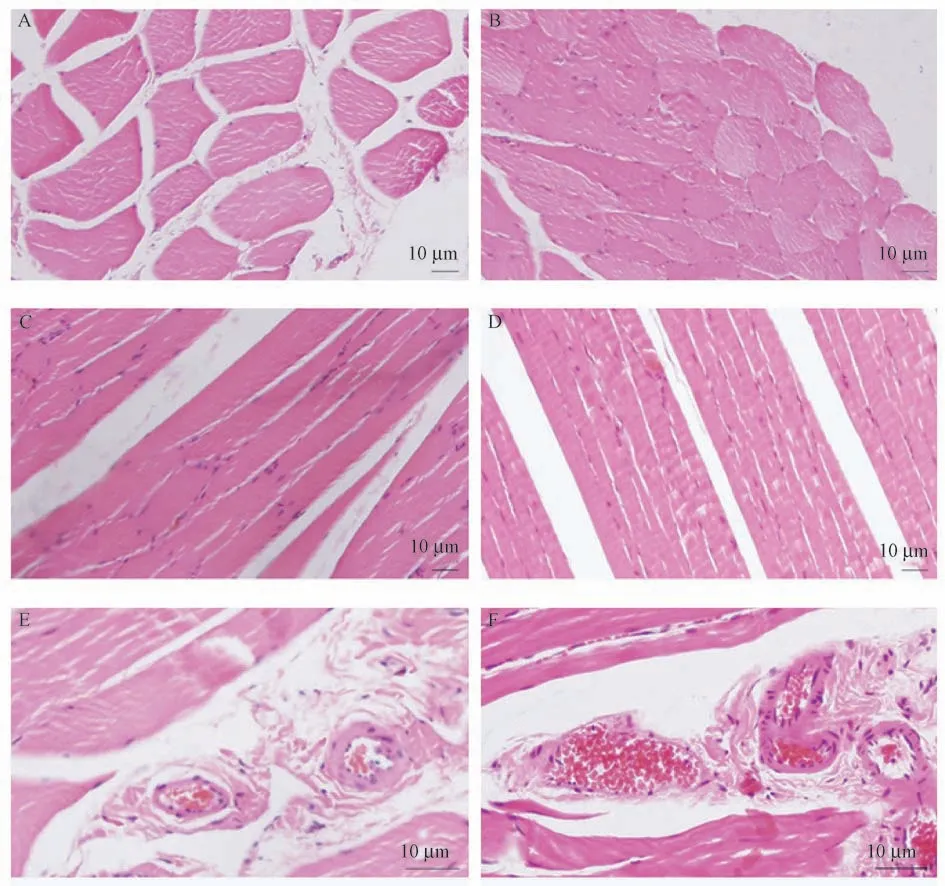
圖3 兩組下肢肌肉組織病理表現Figure 3 Pathological features of lower limb muscle in two groups
然而在建立大鼠腹腔異位心臟移植的模型過程中,受體仍會發生一些并發癥如:截癱、肢體麻痹、下肢血栓形成、腸壞死及酸中毒等。這些并發癥很大程度上是由長時間夾閉腹主動脈所致。采用傳統方法,吻合血管時間長短決定了夾閉腹部大血管時間。但是,被切開的血管壁會發生塌陷,增加了吻合難度使得吻合時間延長。所以,如何縮短夾閉血管時間成為減少并發癥發生的關鍵。
Rivetti 等[17]報道了在非體外循環冠脈旁路移植術中將一段光滑、透明、外拋光的醫用硅膠管作為分流栓放置于切開的冠脈內能夠減輕心肌缺血的程度。許多研究報道了術中應用分流栓可降低術后cTNI 水平,改善左心功能同時還增加吻合口的通暢率[18-22]。目前,經過改進的各種形式的分流栓已普遍的應用心臟外科、血管外科及神經外科中[23-26]。因此,本研究首次嘗試將腔內分流技術應用于大鼠腹腔異位心臟中。研究結果表明,與大多數文獻中報道相符,傳統組完全阻斷腹主動脈的時間為60 min 左右[4],改進組在應用分流栓后可見缺血時間縮短為20 min 左右,并且將一次長阻斷血管時間分割為數次較短的阻斷時間,這不僅降低了缺血損傷的程度,還提高了下肢肌肉組織對缺血的耐受能力[25]。肌紅蛋白作為骨骼肌和心肌組織損傷的標志物之一,其敏感性較高,但特異性不高。本研究中,移植心臟因缺血再灌注損傷而出現肌紅蛋白升高,這可能與受體骨骼肌因缺血再灌注損傷導致肌紅蛋白升高發生混淆。本研究中檢驗大鼠CKM 及LDH,主要分布于骨骼肌,其升高顯示骨骼肌受損的特異性較高。相較于傳統組,由于改進組縮短了腹主動脈阻斷時間,其遠端組織缺血時間顯著減少,下肢肌肉細胞損傷明顯減少,血清中的損傷標志物顯著降低。
在本研究中,從右腎動脈水平至髂總靜脈分叉處分離大鼠腹主動脈及下腔靜脈,根據所分離血管的長度選取不同長度的分流栓。由于術中夾閉了右腎動脈水平的腹主動脈,所以置入分流栓的上端是無法超越此水平面的,更無法到達腹腔干的水平。因此,不存在影響雙側腎動脈和腹腔干血流的問題。
本研究中,結扎固定分流栓的兩端能有效控制吻合口出血并保持術野清晰,這也是應用分流栓的重要優勢之一。血管腔內分流栓還發揮著支撐管壁、保持良好的血管立體形態的作用,不僅降低了吻合血管的難度,還可避免誤傷血管后壁[8]。對于操作者而言,我們改進了技術后可以贏得更多寶貴時間來吻合血管,不僅提高了手術的成功率,而且縮短了操作者的學習曲線。
本研究予以適量的肝素可預防分流栓內及遠端血管內血栓形成,還可以減低吻合口血栓形成的風險,這一點可從肌肉組織的病理切片中得到部分證實。傳統方法不僅存在靜脈淤血和動脈充血情況,而且長時間的缺血還可能破壞血管內皮結構,從而誘發局部嚴重的血栓形成事件。雖然肝素抗凝會增加手術出血量,但是較快的吻合速度及良好的吻合質量足以抵消其帶來的不良影響[27]。
本研究也存在著一些局限性。例如,由于沒有專門的血管分流栓,自制分流栓在直徑上與血管腔不能完全匹配;分流栓在置入及取出過程中可能出現吻合口撕裂;也有報道說血管腔內分流栓可導致血管內皮損傷[28-30]。
總之,在大鼠腹腔異位心臟移植術中,應用血管內分流技術可以使血管阻斷的時間縮短,吻合血管的難度下降,手術的成功率增加。

