胰島素調控miR-34a/Sirt1軸對妊娠糖尿病大鼠內質網應激的影響
王 娟 魏秀玲 鄭素梅 李世丹 張 燕
(諸城市婦幼保健院,山東諸城 262200)
妊娠糖尿病(gestational diabetes mellitus,GDM)是妊娠期間首次發現或發生的以血糖升高為主要表現的代謝性疾病,可導致不良妊娠結局產生[1]。微小 RNA-34a(miR-34a)/ 沉 默 信 息 調 節 因 子(Silent information regulator,Sirt1)軸可調控ERS 及細胞凋亡等生理活動并參與疾病發展過程。本研究通過建立GDM 大鼠模型和設置Sirt1 抑制劑,探討胰島素降低胰島素抵抗改善GDM 的具體分子機制,為臨床合理用藥提供參考。
1 材料與方法
1.1 實驗材料
1.1.1 動物 清潔級同遺傳背景SD 大鼠,體重 200 ~220 g,由廣東省醫學實驗動物中心提供,生產許可證號為SCXK(粵) 2018-0002,動物質量合格證號為廣東省科委2000A027。
1.1.2 主要試劑及儀器 胰島素(美國MP Biomedicals 公司,CAS 號:12584586,規格:1 mg);鏈脲佐菌素(STZ)注射液(北京凱瑞基生物科技有限公司,批號:82342,規格:20 mg/瓶);HE 染色試劑盒(上海名勁生物科技有限公司); Trizol 總RNA 提取試劑盒(上海名勁生物科技有限公司)。
1.2 方法
①選取50 只已受孕大鼠構建大鼠GDM 模型[2]:隨機選取10 只經腹腔注射給予檸檬酸緩沖液,并給予正常飼料喂養作為正常妊娠組(正常組);剩余40 只大鼠造模成功后,隨機分為模型組(GDM 組)、胰島素組(20 U/kg)、塞利司他組(EX527,Sirt1 抑制劑,2 mg/kg,抑制劑組)、胰島素+Sirt1 抑制劑組(20 U/kg+2 mg/kg,聯合組),每組10只。各組大鼠于妊娠第5 d 開始按照相應計量給藥,正常組與GDM 組經皮注射等劑量生理鹽水,各組連續給藥14 d,1 次/d。②各組大鼠末次給藥禁食禁水12 h 后用3%戊巴比妥鈉麻醉后處死,經腹主動脈取血3 mL,離心取上清液,置于-20℃冰箱中保存。快速摘取胰腺組織,經磷酸緩沖鹽沖洗后,取0.5 g 組織,用組織勻漿器勻漿后,離心分離取上清液置于-20 ℃冰箱保存,剩余部分迅速置于4%中性多聚甲醛中固定24 h。
1.3 觀察指標
① 檢 測 FBG、FINS(空 腹 胰 島 素 含 量),HOMAIR=FBG×FINS/22.5。②采用 2-ΔΔCt法計算 miR-34a 相對表達量。③分析 GRP78、caspase-12、Sirt1、UCP-2 蛋白相對表達水平。④觀察并計算被染成棕色的細胞數(凋亡細胞數)及總細胞數,胰島細胞凋亡率=凋亡細胞數/總細胞數×100%。
1.4 統計學分析
以SPSS 22.0 軟件對實驗數據進行統計分析,計量資料以()表示,多組間比較進行單因素方差分析,進一步兩組間比較行LSD-t 檢驗,P <0.05 為差異有統計學意義。
2 結果
2.1 各組大鼠各指標結果比較
GDM 組及聯合組大鼠FBG 含量、HOMA-IR、胰腺組織miR-34a表達、胰島細胞凋亡率均高于正常組(P<0.05);胰島素組各指標均低于GDM 組和聯合組(P <0.05);抑制劑組各指標均高于其他組(P <0.05);GDM 組與聯合組比較,差異無統計學意義(P >0.05),見表1。
2.2 各組大鼠胰腺組織GRP78、caspase-12、Sirt1、UCP-2 蛋白表達結果
GDM 組及聯合組大鼠胰腺組織GRP78、caspase-12、UCP-2 蛋白表達高于正常組(P < 0.05),Sirt1 表達低于正常組(P <0.05);胰島素組上述蛋白表達低于GDM 組和聯合組(P < 0.05),Sirt1 表達高于 GDM 組和聯合組(P <0.05);抑制劑組大鼠上述蛋白表達均高于其他組(P < 0.05),Sirt1 表達低于其他組(P < 0.05)。GDM 組與聯合組比較差異無統計學意義(P >0.05),見圖1、表2。

圖 1 各組大鼠胰腺組織GRP78、caspase-12、Sirt1、UCP-2蛋白表達免疫印跡圖
表1 各組大鼠各指標結果比較()
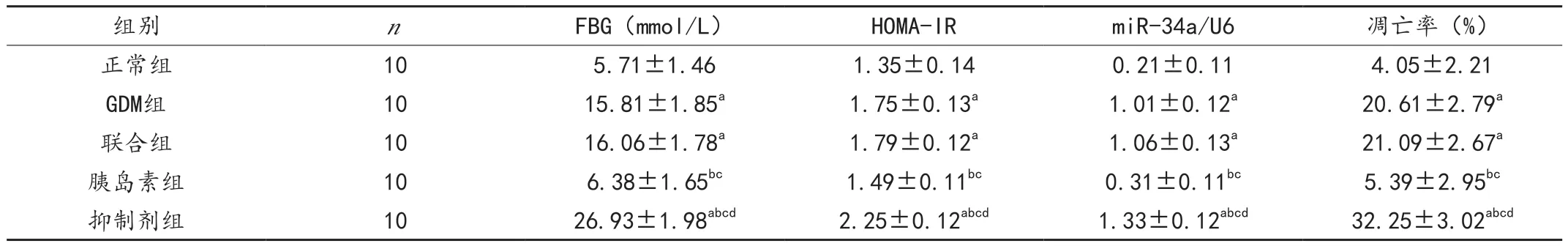
表1 各組大鼠各指標結果比較()
注:與正常組比較,aP <0.05;與GDM 組比較,bP <0.05;與聯合組比較,cP <0.05;與胰島素組比較,dP <0.05。
組別 n FBG(mmol/L) HOMA-lR miR-34a/U6 凋亡率(%)正常組 10 5.71±1.46 1.35±0.14 0.21±0.11 4.05±2.21 GDM組 10 15.81±1.85a 1.75±0.13a 1.01±0.12a 20.61±2.79a聯合組 10 16.06±1.78a 1.79±0.12a 1.06±0.13a 21.09±2.67a胰島素組 10 6.38±1.65bc 1.49±0.11bc 0.31±0.11bc 5.39±2.95bc抑制劑組 10 26.93±1.98abcd 2.25±0.12abcd 1.33±0.12abcd 32.25±3.02abcd
表2 各組大鼠胰腺組織GRP78、caspase-12、Sirt1、UCP-2 蛋白表達比較()
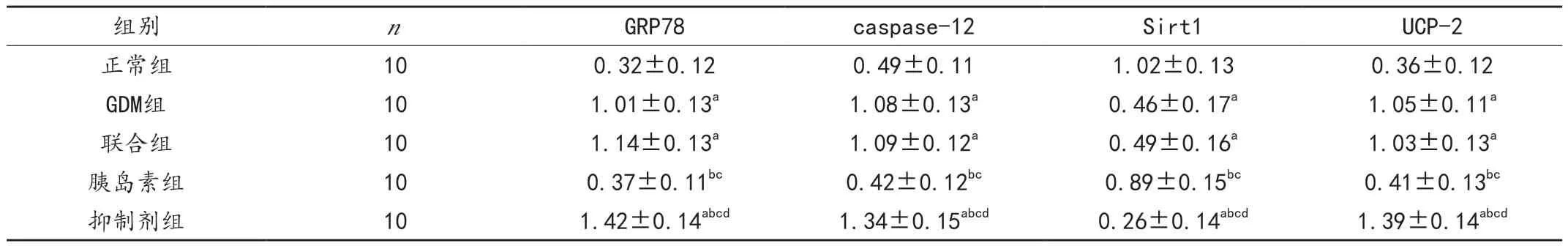
表2 各組大鼠胰腺組織GRP78、caspase-12、Sirt1、UCP-2 蛋白表達比較()
注:與正常組比較,aP <0.05;與GDM 組比較,bP <0.05;與聯合組比較,cP <0.05;與胰島素組比較,dP <0.05。
組別 n GRP78 caspase-12 Sirt1 UCP-2正常組 10 0.32±0.12 0.49±0.11 1.02±0.13 0.36±0.12 GDM組 10 1.01±0.13a 1.08±0.13a 0.46±0.17a 1.05±0.11a聯合組 10 1.14±0.13a 1.09±0.12a 0.49±0.16a 1.03±0.13a胰島素組 10 0.37±0.11bc 0.42±0.12bc 0.89±0.15bc 0.41±0.13bc抑制劑組 10 1.42±0.14abcd 1.34±0.15abcd 0.26±0.14abcd 1.39±0.14abcd
3 討論
GDM 的主要病理特點為胰島素抵抗、血糖升高、胰島細胞凋亡等[3]。本研究結果表明,胰島素可有效控制GDM大鼠血糖水平、減輕胰島素抵抗、改善胰腺組織損傷。有研究發現[4-5],GDM 過程中,胰腺組織會發生ERS(內質網應激),可引起胰島細胞凋亡、胰島功能缺陷和胰島組織損傷。GRP78 是ERS 的特異性標志物之一,caspase-12 是介導細胞凋亡者主要因子[6]。郎麗翔[7]等發現ERS 參與GDM 過程,GDM 大鼠胰腺組織GRP78、caspase-12 蛋白表達升高,ERS 及胰島細胞凋亡、胰腺組織損傷均加重。本研究結果表明,GDM 組大鼠胰腺組織ERS 處于激活狀態,可能與胰腺組織損傷有關。進一步分析發現,胰島素可抑制GDM 大鼠胰腺組織ERS 激活,可能與改善胰腺組織損傷有關,然而其機制并不清楚。
Sirt1 可在胰腺內分泌細胞中表達,并參與胰島細胞功能調節,UCP-2 是線粒體內膜上的轉運蛋白,可直接與Sirt1 結合,共同參與胰島細胞分泌及功能調節。CARLONI[8]等發現腹膜注射退黑素,可抑制miR-34a 表達,上調Sirt1 表達,降低新生兒腦組織ERS 及炎癥損傷。本研究結果顯示GDM 組大鼠胰腺組織中miR-34a 表達上調、Sirt1 表達下調,可能使得Sirt1 對UCP-2 蛋白表達的抑制作用降低,進一步影響胰島素分泌及胰腺組織ERS 損傷。與GDM 組相比,胰島素組miR-34a 表達降低,Sirt1 表達升高,UCP-2蛋白表達均降低,推測胰島素可能通過下調miR-34a 并上調Sirt1 表達,抑制GDM 大鼠胰腺組織ERS,進而抑制胰腺組織損傷及細胞凋亡。為驗證這一推測,本研究同時給予GDM 大鼠胰島素和Sirt1 抑制劑進行治療,發現與GDM 組比較,聯合組大鼠胰腺組織損傷程度、胰島細胞凋亡率及胰腺組織中各蛋白表達差異無統計學意義,提示Sirt1 抑制劑可逆轉胰島素對GDM 大鼠胰腺組織ERS 的抑制作用及對胰腺組織損傷、胰島細胞凋亡的保護作用,進一步提示胰島素可能通過下調miR-34a 并上調Sirt1 表達,抑制胰腺組織ERS,進一步緩解GDM 大鼠胰島組織損傷和胰島細胞凋亡。
綜上所述,胰島素可通過調節miR-34a/Sirt1 信號軸,抑制胰腺組織ERS 表達,緩解GDM 大鼠胰腺組織損傷,為臨床治療GDM 提供一定參考。GDM 胰腺組織ERS 極其復雜,胰島素還可能通過其他途徑治療和緩解GDM 病理癥狀,這有待后續繼續深入研究。

