紅茶菌發酵羅城毛葡萄13種有機酸的同時檢測
郝俊光,陳婉玲,楊 麗,陳霜梅,梁振榮,銀 書,祁 岑,*(.北部灣大學欽州市特色果蔬發酵重點實驗室,廣西欽州 5350;.廣西天龍泉酒業有限公司,廣西河池 546400)
羅城毛葡萄2016年獲國家農產品地理標志認證,其富含氨基酸、維生素、硒、鍶、鋅、白藜蘆醇等營養物質,酸甜適中,具有良好的釀造加工性狀[1]。2019年毛葡萄的種植面積達8萬畝,產量1.5萬噸,已成為當地支柱產業[1],有利于貧困農民脫貧和石漠化土壤改良。豐產后的毛葡萄暴露出了加工銷售能力弱、產業鏈單一的問題,因此需拓寬深加工能力、尋求多樣化應用[1]。傳統的紅茶菌飲料是利用酵母菌、醋酸菌等天然共生菌群發酵茶糖水而制成的民間飲料,其源于中國,經日本和俄羅斯向全球傳播[2-3],其保健作用備受各國人民的關注。目前人們對紅茶菌的發酵機理[4-6]、抗菌作用[7]、保健機理[8-9]、微生物組成[3,10-11]等進行了系列的研究,從中鑒定出茶多酚、葡萄糖醛酸、葡萄糖酸、D-葡萄糖二酸-1,4內酯等有益成分[4-5,9],證明了其具有抗癌[7]、護肝[8-9]、抗炎癥[10-12]、防治糖尿病[12-13]等功效。當前紅茶菌產品不再局限于茶葉發酵飲料,已擴展至對咖啡[14]、谷物[15-16]、水果[17-19]等的開發應用,但尚未應用到毛葡萄,這為毛葡萄的深加工提供了新思路。
紅茶菌類產品是酸性的,主要有機酸是葡萄糖酸、葡萄糖醛酸、乙酸等[20-22]。相關研究多用pH或總酸表征其酸性特征[22-23],即便涉及有機酸也僅限乙酸、琥珀酸、檸檬酸、葡萄糖酸等[17,21-22],檢測有機酸的種類偏少,不能用于多種有機酸組成變化的同時檢測。建立包括葡萄糖醛酸、葡萄糖酸、抗壞血酸等多種有機酸的同時檢測技術,有益于紅茶菌類產品的開發和品控。有機酸的測定方法主要包括氣相法、液相法(紫外法、示差法、質譜法)、離子色譜法、毛細管電泳法,其中液相紫外法和離子色譜法較常用[24],已知離子色譜法不能將氟離子跟紅茶菌最主要的有機酸-葡萄糖酸有效分離[25]。GB/T 15038-2006的實施,引發了學者利用不同反相色譜柱對不同樣品有機酸檢測的方法開發,現已形成了多種有機酸檢測的專用方法,但未見同時檢測紅茶菌特征有機酸包括葡萄糖酸、葡萄糖醛酸的在內的多種有機酸的檢測方法[24,26-27]。Waters Atlantis? T3色譜柱適合保留和分離性強的極性化合物,其在有機酸方法開發中的應用尚未見報道。為明確紅茶菌發酵毛葡萄多種有機酸的同時變化,擬采用T3色譜柱開發包括葡萄糖酸在內的13種有機酸的檢測方法,來分析利用紅茶菌發酵毛葡萄生產酸性功能軟飲品的可行性。
1 材料與方法
1.1 材料與儀器
毛葡萄 2019年市售羅城產毛葡萄,糖度15.5 Bx°,色澤紫黑,飽滿,無霉爛、損傷,購買后在4 ℃冰箱貯存;白糖 市售甘蔗白糖;紅茶菌 好氧菌股份有限公司;0.22 μm SLGP 033RB針頭濾膜 美國Millipore公司;乙腈、磷酸、KH2PO4、L-蘋果酸、乙酸、L-乳酸、L-酒石酸、檸檬酸、琥珀酸、抗壞血酸、草酸、富馬酸、奎尼酸、葡萄糖醛酸、丙酮酸、檸檬酸鈉 色譜純,上海麥克林生化科技有限公司;葡萄糖酸溶液 純度51%,上海麥克林生化科技有限公司。
Waters Alliance 2695HPLC分離單元、2996 PDA檢測器 美國Waters公司;UV-1800紫外可見光分光光度計 島津儀器(蘇州)有限公司;DK-98-II電熱恒溫水浴鍋 天津市泰斯特儀器有限公司;INNOVA43R落地式低溫搖床 上海巴玖實業有限公司;WYT-J手持式折光儀 成都豪創光電儀器有限公司;H1850高速離心機 湖南湘儀實驗室儀器開發有限公司;HE53水分測定儀、ME204E電子天平 梅特勒-托利多儀器(上海)有限公司;Cascada I實驗室超純水系統 美國PALL公司。
1.2 實驗方法
1.2.1 紅茶菌發酵毛葡萄
1.2.1.1 毛葡萄發酵工藝流程 毛葡萄→洗凈除梗→稱量→破碎→加入糖水→混勻→加入菌膜→封蓋→控溫發酵
1.2.1.2 毛葡萄發酵操作要點 破碎:將毛葡萄用清水漂洗,除去壞果、梗枝,瀝干表面水分。用經400 mg/L焦亞硫酸鈉清洗過的對輥粉碎機搗碎。
糖水配制:25 g/100 mL糖水裝于三角瓶中,121 ℃滅菌15 min。
接種:將400 g帶皮葡萄漿倒入已滅菌的2 L三角瓶中,加入400 mL糖水、50 g紅茶菌膜,混勻,使發酵液糖度達到18 Bx°。
發酵:瓶口用8層醫用紗布覆蓋、扎緊,28 ℃發酵。
取樣與檢測:在18個發酵瓶中進行平行實驗,分別在3、5、7、9、14、17 d打開三瓶進行檢測。每個樣品的有機酸檢測三次,結果以平均數和標準偏差形式表示。
1.2.2 有機酸檢測
1.2.2.1 色譜條件的優化和有機酸的定性 配制草酸50 mg/L、葡萄糖醛酸50 mg/L、酒石酸400 mg/L、葡萄糖醛酸2500 mg/L、奎尼酸75 mg/L、丙酮酸75 mg/L、蘋果酸200 mg/L、抗壞血酸10 mg/L、乳酸200 mg/L、乙酸2000 mg/L、檸檬酸100 mg/L、富馬酸4 mg/L、琥珀酸200 mg/L的單標,用于不同有機酸的保留時間、峰形和強弱的確定。上述單標溶液等體積混合后用于色譜條件的優化,色譜峰的辨識基于單標所獲取的峰形、強度和出峰順序)。
色譜條件的優化:首先驗證了210 nm測定有機酸的適應性,接著在其它條件固定的前提下,分別進行了柱溫(25、30、35 ℃)、流動相KH2PO4的濃度(0.01、0.02、0.04 mol/L)、流動相pH(2.4、2.6、2.8、3.0)、流速(0.4、0.45、0.5、0.55 mL/min)的單因素比對實驗,從而得到優化的色譜條件。在優化的條件下確定每個有機酸的保留時間,最終完成有機酸的定性。
1.2.2.2 標準曲線的建立與方法評價 混合標準儲備液的配制:稱取各種標準品適量,用KH2PO4緩沖液溶解并定容至100 mL,得到濃度為葡萄糖醛酸 0.8 mg/mL(用于葡萄糖醛酸和草酸共流出峰的相對定量)、酒石酸3.2 mg/mL、葡萄糖酸20 mg/mL、奎尼酸0.6 mg/mL、丙酮酸0.6 mg/mL、蘋果酸1.6 mg/mL、抗壞血酸0.08 mg/mL、乳酸1.6 mg/mL、乙酸20 mg/mL、檸檬酸1.6 mg/mL、富馬酸0.024 mg/mL、琥珀酸1.6 mg/mL的混合標準儲備液,4 ℃保存。
在優化的色譜條件下進行有機酸標樣的定量檢測。色譜柱:Waters Atlantis?T3色譜柱(4.6 mm×250 mm,5 μm);流動相:KH2PO4緩沖液(0.02 mol/L,pH2.6);等度洗脫;流速:0.4 mL/min;柱溫:30 ℃;進樣量:10 μL;檢測波長:210 nm。
標準曲線的建立:用KH2PO4緩沖液將混合標準儲備液稀釋至所需濃度的混合標準工作液,共六個梯度。在優化的條件下對六個梯度進行檢測,將峰面積(y)和濃度(x)進行強制過原點的線性擬合,建立標準曲線。
定量方法的方法學評估:對最低濃度標準溶液逐步稀釋檢測,取信噪比S/N 3和10時對應分析物的濃度作為檢出限和定量限。向毛葡萄7 d發酵液的5倍稀釋液中加入等體積的梯度4混合標準溶液,平行測定6次,計算出相應組分的加標回收率和相對標準偏差。
1.2.2.3 樣品的檢測 紅茶菌發酵毛葡萄樣品以8000 r/min離心15 min,用去離子水稀釋3~5倍,經0.22 μm針頭微孔濾膜過濾至樣品瓶。在優化的色譜條件下上機檢測,用標準曲線定量。
1.3 數據處理
使用Microsoft Excel 2016軟件對數據進行處理,數據以平均數±標準偏差形式表示。
2 結果與分析
2.1 色譜條件的確定
2.1.1 檢測波長的選擇 利用二極管陣列檢測器PDA對草酸、葡萄糖醛酸等13種目標分析物在190~400 nm范圍內進行掃描,發現各分析物在210 nm均有較大的吸收,且流動相干擾較小,故采用210 nm作為檢測波長。
2.1.2 檢測溫度的選擇 在流動相KH2PO4緩沖液(0.02 mol/L,pH2.6)、流速0.4 mL/min的前提下,對比了25、30、35 ℃檢測溫度對有機酸分離度的影響,結果見圖1。可以發現,隨著溫度的升高,有機酸的保留時間有所縮短。25 ℃條件下,檸檬酸和富馬酸不能有效分離。35 ℃條件下L-酒石酸、葡萄糖酸的分離度較30 ℃差,因此,選擇30 ℃為優化的檢測溫度。草酸/葡萄糖醛酸在所有優化過程中均完全重合,故在下述優化描述中不再重復提及。
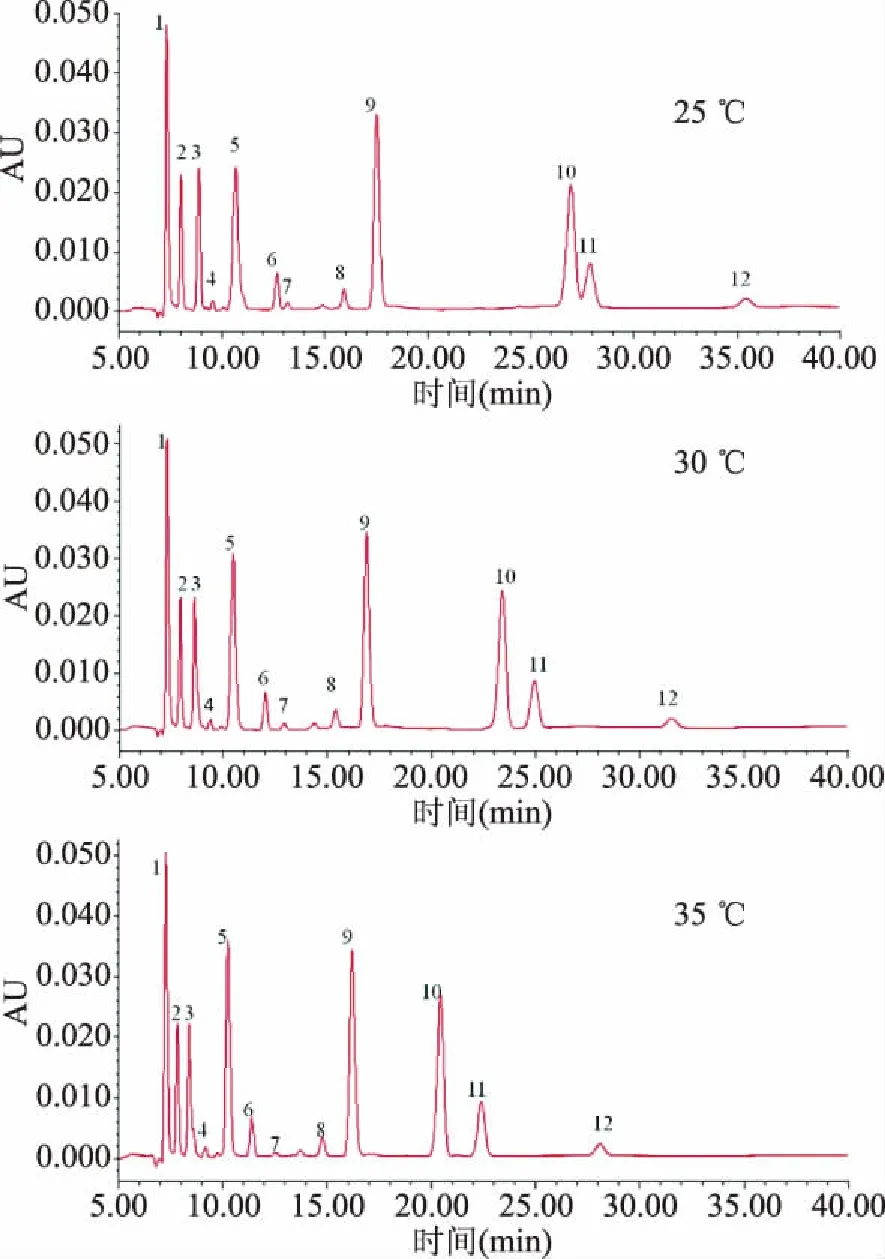
圖1 13種有機酸標樣在不同檢測溫度下的HPLC色譜圖Fig.1 HPLC chromatograms of 13 organic acid standards under different column temperature注:1:草酸/葡萄糖醛酸;2:L-酒石酸;3:葡萄糖酸;4:奎尼酸;5:丙酮酸;6:L-蘋果酸;7:抗壞血酸;8:L-乳酸;9:乙酸;10:檸檬酸;11:富馬酸;12:琥珀酸;圖2~圖5同。
2.1.3 流動相濃度的選擇 用H3PO4滴定,調整0.01、0.02、0.04 mol/L的KH2PO4緩沖液的pH到2.6。在流速0.4 mL/min 30 ℃的檢測溫度下,比對三個濃度梯度對有機酸分離效果的影響,結果見圖2。三個梯度的分離度差異不大,考慮到緩沖溶液的濃度高有利于有機酸分子態的穩定存在以及高濃度的鹽溶液會對泵和柱子的壽命會產生影響,選取0.02 mol/L的KH2PO4溶液做流動相。
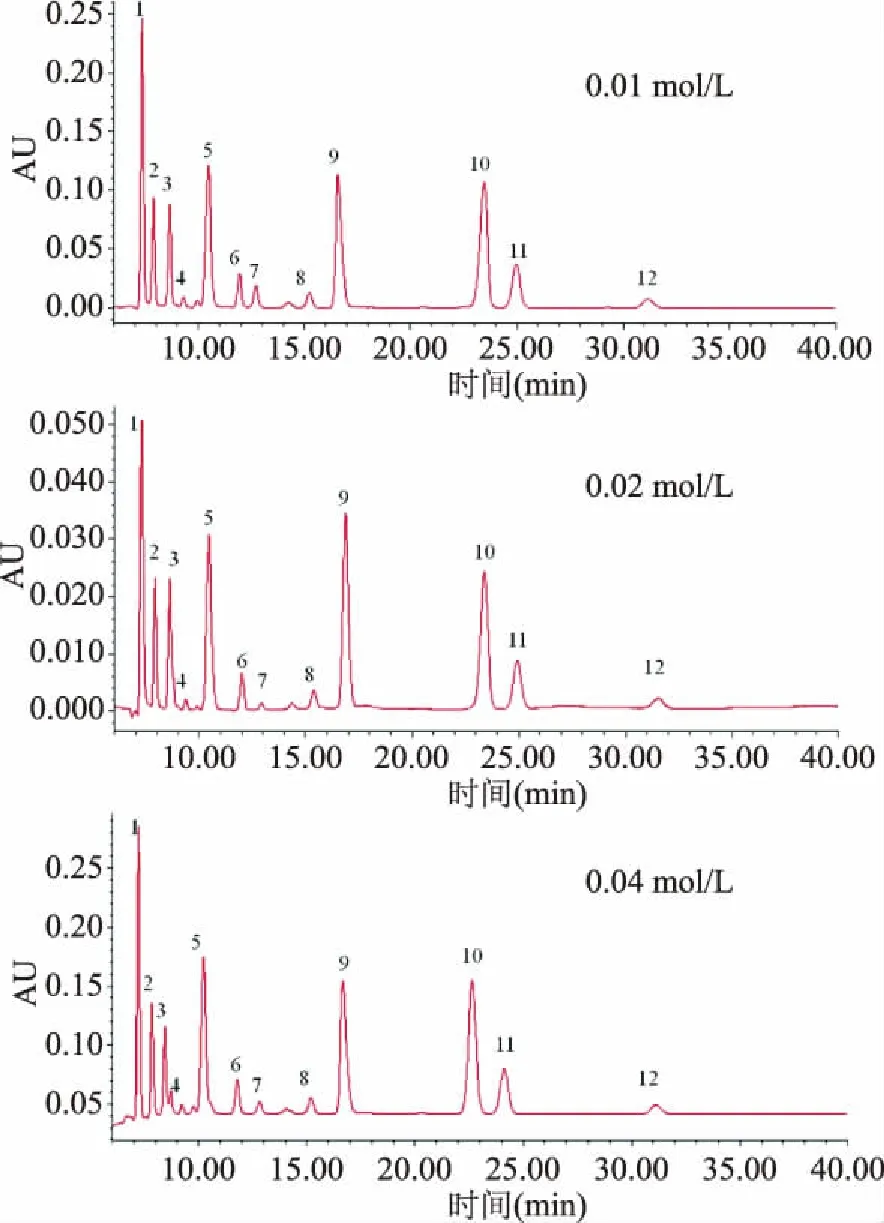
圖2 13種有機酸標樣在不同濃度緩沖鹽作為流動相的HPLC色譜圖Fig.2 Chromatograms of 13 organic acid standards with different concentration of buffer solutions
2.1.4 流動相pH的選擇 用H3PO4滴定調整0.02 mol/L的KH2PO4緩沖液的pH分別達到2.4、2.6、2.8、3.0,在流速0.4 mL/min、30 ℃的檢測溫度的前提下,比對四個不同pH緩沖液對有機酸分離效果的影響,結果見圖3。流動相pH增加時各有機酸的保留時間會縮短,檸檬酸和富馬酸在pH2.8時不能有效分離,在pH3.0時融合、峰形異常。pH2.4、2.6均有較好的分離效果,考慮到低pH流動相對柱子壽命的潛在影響,選擇pH2.6的KH2PO4溶液做流動相。
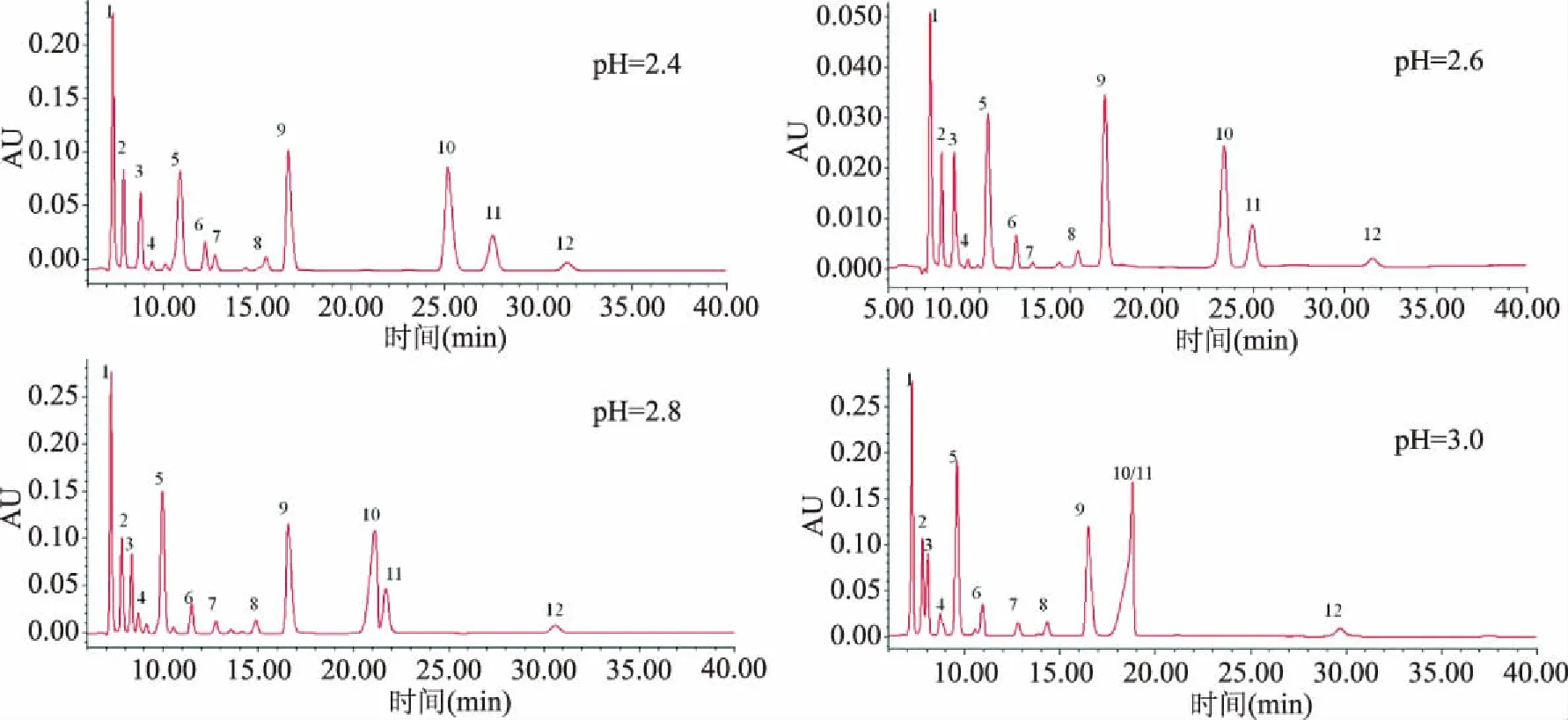
圖3 13種有機酸標樣在不同pH緩沖鹽作為流動相的HPLC色譜圖Fig.3 Chromatograms of 13 organic acid standards with different mobile phase pH
2.1.5 流速的選擇 在流動相KH2PO4緩沖液(0.02 mol/L,pH2.6)、30 ℃檢測溫度的條件下,對比了流速0.40、0.45、0.50、0.55 mL/min對有機酸分離情況的影響,結果見圖4。發現隨著流速的增加,有機酸的保留時間縮短。相對而言,0.40 mL/min條件下各有機酸的分離度均較好,尤其是 L-酒石酸、葡萄糖酸的分離效果優于其它流速,所以選擇流速0.40 mL/min。

圖4 13種有機酸標樣在不同流速下的HPLC色譜圖Fig.4 Chromatograms of 13 organic acid standards with different flow velocity of mobile phase
2.2 有機酸的定性
在優化的條件下確定每個有機酸的保留時間,實現有機酸的定性。圖5為優化條件下13種有機酸的色譜圖,可以看出除草酸和葡萄糖醛酸共流出外,其它有機酸標樣均有較好分離。
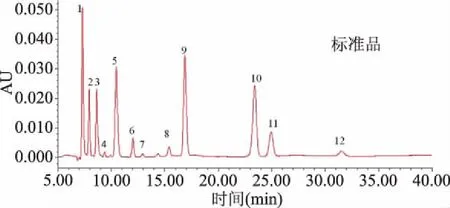
圖5 優化條件下13種混合標準品的HPLC譜圖Fig.5 Chromatograms of 13 organic acid standards under optimum conditions
2.3 標準曲線建立及方法的評價
在上述最優條件下,將紅茶菌發酵毛葡萄7 d發酵液稀釋5倍后進行檢測,色譜圖見圖6。可以發現目標物周圍無明顯的干擾,說明方法適合樣品檢測。由于本研究色譜條件下葡萄糖醛酸和草酸完全重合,只能采用葡萄糖醛酸的標準曲線對共流出峰進行相對定量。目前有采用液相紫外和示差法對葡萄糖醛酸含量絕對定量的報道[4,17-18],但其未同時檢測草酸的情況,不能排除在這些文獻報道的色譜條件下存在草酸對葡萄糖醛酸數據干擾的可能性。相對而言,液相質譜報道的紅茶菌葡萄糖醛酸數據更為可信,因為檢測機理決定著其檢測不受草酸干擾[28]。
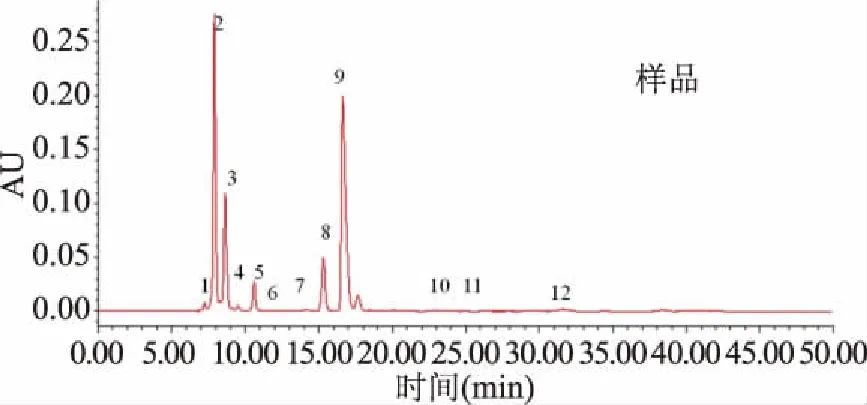
圖6 優化條件下紅茶菌毛葡萄發酵稀釋液的HPLC譜圖Fig.6 Chromatogram of organic acids in fermentative broth ofVitis quinnquangularis Rehd. by the kombucha consortium under optimum HPLC conditions
在優化的條件下對6個混合標準梯度進行檢測,將峰面積(y)和濃度(x)進行強制過原點的線性擬合,建立標準曲線,并進行方法評價。標準曲線及其線性范圍與R2、檢出限、定量限、加標回收率、RSD等結果見表1。結果顯示,線性范圍較寬,標準曲線線性相關系數分布范圍0.990~0.996,線性良好,適合紅茶菌稀釋3~5倍后進行檢測;檢出限范圍0.024~0.080 mg/L,定量限范圍0.080~4.789 mg/L,加標回收率92.68~107.35%,相對標準偏差<5%,說明該方法精密度良好,準確度高,可滿足實際樣品的檢測。
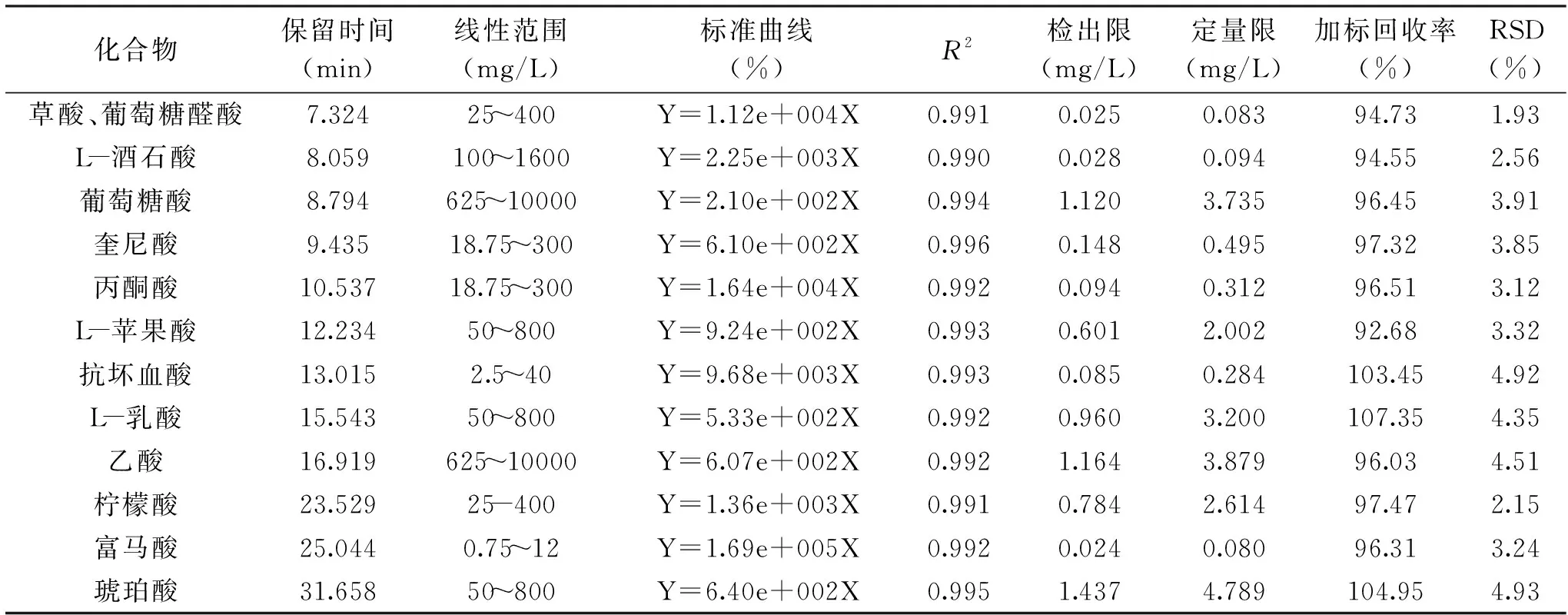
表1 有機酸組分的保留時間、線性范圍、標準曲線、相關系數、檢出限、定量限、加標回收率、標準偏差Table 1 Retention time,linear range,regression equation,correlation coefficient,limit of detection,limit of quantitation,recovery,RSD of organic acids by HPLC
2.4 紅茶菌發酵過程有機酸的變化
紅茶菌發酵毛葡萄漿的有機酸變化見圖7。葡萄糖酸、乙酸是主要的有機酸,在17 d的發酵液中濃度分別是138795和37841 mg/L,占所測有機酸總量的75.03%和10.46%。在17 d發酵液中有機酸濃度由大到小的順序依次是:葡萄糖酸>乙酸>L-酒石酸>奎尼酸>L-蘋果酸>L-乳酸>丙酮酸>琥珀酸>檸檬酸>草酸/葡萄糖醛酸>抗壞血酸>富馬酸。
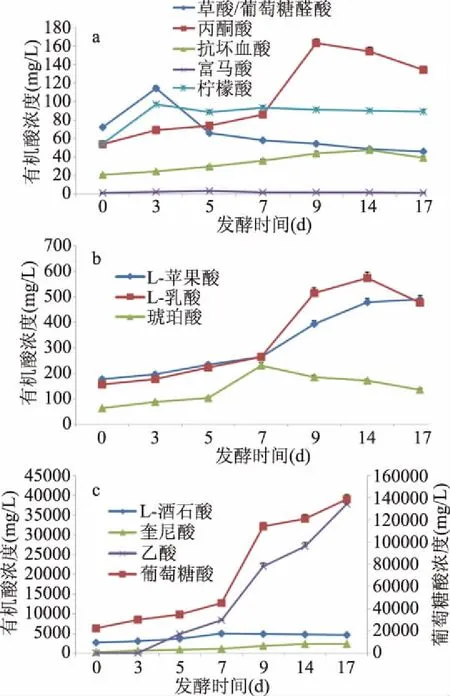
圖7 毛葡萄紅茶菌發酵過程13種有機酸的變化情況Fig.7 The changes of 13 organic acids in fermentative broth of Vitis quinnquangularis Rehd. during the process fermented by the kombucha consortium
從發酵過程的變化趨勢上看,除葡萄糖酸、蘋果酸、乙酸一直增加外,其它組分均呈現先升后降的趨勢且各自出現濃度峰值的時間不同。葡萄糖醛酸/草酸共流出物相對含量的峰值出現最早,而其下降或許與草酸容易形成鹽沉淀有關。葡萄糖醛酸因其解毒功能而備受人們重視[18,29-30],但葡萄糖醛酸/草酸共流出物相對含量在17 d的發酵液中含量僅為46.1 mg/L,再次印證了其在紅茶菌發酵液中含量不高。酒石酸在葡萄汁中初始含量相對較高,發酵過程未呈現大幅增加,跟葡萄酒發酵過程的表現類似[24]。奎尼酸是自然界普遍存在的多羥基化合物[31],在發酵過程增加明顯,與酚酸的報道趨勢一致[14,17]。乳酸由紅茶菌菌群的乳酸菌代謝生成[22,28],但它不是紅茶菌的主要有機酸。抗壞血酸在前14 d的發酵過程中一直增加,在17 d時有所下降,其發酵過程含量的提升與文獻報道一致[2]。琥珀酸在發酵過程中緩慢增加后緩慢降低,檸檬酸的變化不顯著,而富馬酸含量極少。與初始發酵液對比,僅17 d草酸/葡萄糖醛酸共流出物的濃度下降,降幅為0.36倍;而其它有機酸均增加,增幅由大到小依次是乙酸(945.1倍)、奎尼酸(6.8倍)、葡萄糖酸(5.2倍)、L-乳酸(2.1倍)、L-蘋果酸(1.7倍)、丙酮酸(1.5倍)、琥珀酸(1.1倍)、抗壞血酸(0.85倍)、檸檬酸(0.65倍)、富馬酸(0.33倍)。葡萄糖酸和乙酸是紅茶菌的主要有機酸,是醋酸菌分別作用葡萄糖和乙醇所生成的產物[32],它們的濃度和比例決定著發酵液的酸度和酸感。葡萄糖酸的酸味純正柔和[30]、酸度約為檸檬酸和乳酸的1/3~1/4[33],預示著利用紅茶菌發酵羅城毛葡萄制作酸性功能飲料將較葡萄醋的口感更佳。
3 結論
通過對檢測波長、流動相pH、流動相濃度、柱溫和流速進行優化,建立了高效液相色譜同時測定毛葡萄紅茶菌發酵液中13種有機酸的分析方法。在優化的條件下,葡萄糖醛酸和草酸完全重合(只能用葡萄糖醛酸的標準曲線相對定量),而葡萄糖酸、奎尼酸、抗壞血酸等其它11種酸組分在樣品中均能有效分離。該方法線性寬、檢出限低、回收率高、精密度好,不僅適用于毛葡萄紅茶菌發酵液組分的檢測,也已在火龍果、百香果、桑葚以及米酒發酵液的有機酸檢測中得到成功應用。
通過對毛葡萄紅茶菌的發酵過程進行跟蹤,明確了各有機酸的協同變化規律。葡萄糖酸、乙酸是主要的有機酸,分別占所測有機酸總量的75.03%和10.46%。有機酸濃度由大到小的順序依次是:葡萄糖酸>乙酸>L-酒石酸>奎尼酸>L-蘋果酸>L-乳酸>丙酮酸>琥珀酸>檸檬酸>草酸/葡萄糖醛酸>抗壞血酸>富馬酸。與初始發酵液對比,僅17 d草酸/葡萄糖醛酸共流出物的濃度下降,其它有機酸均增加,且乙酸、奎尼酸、葡萄糖酸、L-乳酸的增幅在2倍以上。蘋果酸、葡萄糖酸、乙酸在發酵過程中一直增加,而其它酸類均呈現先升后降的趨勢、各自出現濃度峰值的時間也不同。鑒于葡萄糖酸的純正柔和口感、弱酸度,意味著用紅茶菌發酵羅城毛葡萄制作酸性功能飲料將比葡萄醋的口感更佳,這為羅城毛葡萄深加工提供了一條新思路。

