Cu@CNT在甲醇裂解反應中構效關系的DFT研究
宮亞玲,龐 可,任瑞鵬
(太原理工大學 煤科學與技術教育部與山西省共建重點實驗室,太原 030024)
甲醇裂解反應是其高效利用不可避免的重要步驟,該反應過程中催化劑扮演了重要的角色,但是催化劑的積碳和CO中毒問題制約了甲醇高效利用。ZSM-5分子篩被認為是甲醇裂解反應的有效催化劑,但存在石墨碳覆蓋活性位點和多環芳烴堵塞孔道等積碳問題,影響了分子篩催化劑的工業化應用[1-3]。為了提高分子篩催化劑在甲醇裂解過程中的催化性能,研究者采用金屬對分子篩催化劑進行改性,金屬改性后多環芳烴的形成明顯減少[4],但是仍無法避免酸性位被覆蓋。SAPO-34分子篩也是甲醇裂解的有效催化劑,目前影響其工業化應用的原因主要是積碳失活,積碳主要來源于反應過程中碳的聚集[5-6]。此外貴金屬鉑也是甲醇裂解中出色的單金屬催化劑,甲醇在金屬鉑上裂解的主路徑為CH3OH→CH3O→CH2O→CHO→ CO,反應過程中不會造成碳的積聚,但鉑的活性催化位點容易被CO覆蓋造成中毒[7-9]。綜上所述,可以發現:催化劑積碳形成的原因主要為甲醇裂解過程中生成的碳聚集覆蓋在催化活性位點;CO中毒的原因則為CO因其吸附能過大難以從催化劑表面解吸,沉積在表面引起中毒。因此,甲醇高效利用的前提是開發出活性中心與反應介質隔離且CO容易脫附的穩定催化劑。
研究表明,限制在碳納米管通道內的金屬納米顆粒與沉積在碳納米管管壁的相同金屬具有不同的催化活性以及穩定性[10-14]。CUI et al[15]發現,將碳化鉬納米顆粒封裝在單壁碳納米管中用于析氫反應,封裝于碳納米管內的碳化鉬比分散在碳納米管外壁上的碳化鉬納米顆粒表現出更高的催化活性和穩定性。ZHANG et al[16]將Pt簇封裝在碳納米管通道中用于甲苯氧化反應,研究發現:碳納米管的封裝作用可以保護Pt簇免受氧氣的影響;與沉積在碳納米管外壁和炭黑載體表面的Pt簇相比,碳納米管封裝的Pt簇具有更高的活性和穩定性;碳納米管缺乏強酸位點,避免了反應過程中的碳沉積和孔道堵塞。顯然,碳納米管封裝納米金屬顆粒(M@CNT)做催化劑可以將活性中心與反應介質隔離,提高金屬催化劑的活性和穩定性。基于碳納米管封裝金屬的這一特性,M@CNTs催化劑可能是甲醇裂解的優選催化劑。
有關甲醇裂解的金屬催化劑種類有很多,其中Cu基催化劑被認為是甲醇裂解的有效催化劑[17-19]。MEHMOOD et al[20]探索了甲醇在Cu4簇上的裂解,發現甲醇在Cu4簇上首先通過C—H鍵斷裂生成CH2OH,隨后通過C—H鍵斷裂最終生成CO,CO的吸附能為-1.71 eV,其易從催化劑表面解吸,反應過程中無CO中毒問題。Garcia-Muelas et al[17]研究了甲醇在Cu(111)、Ru(0001)、Pt(111)和Pd(111)表面的分解,其中Cu(111)優先生成CH2O,而Pt(111)、Pd(111)和Ru(0001)最初生成大量的CO,可能會毒化表面。CO在這些金屬催化劑表面的吸附能分別為-0.25 eV、-2.78 eV、-3.21 eV和-2.04 eV,可見與其他金屬相比,Cu基催化劑具有優異的CO耐受性。CO在Cu表面的低吸附能是催化劑抗中毒的主要原因。
本文運用密度泛函理論研究了甲醇在Cu@CNT上的裂解機理,并探索了該催化劑的抗積碳性及CO耐受性。
1 計算模型及方法
1.1 計算模型
關于碳納米管的選擇,XIAO et al[21]發現封裝金屬的碳納米管管徑對催化活性的影響呈火山型曲線關系,內徑約1.0 nm的碳納米管應為最佳碳納米管。本文構建了直徑為0.93 nm的(12,0)碳納米管,并將Cu原子封裝在碳納米管管道內。優化后的構型如圖1所示,封裝的Cu原子與碳納米管管壁的C原子成鍵,C—Cu鍵長為0.208 7 nm.催化劑表面有四種不同的吸附位點,分別為與Cu原子成鍵的C原子的頂位(T1)、T1鄰位C原子的頂位(T2)、橋位B和穴位H。
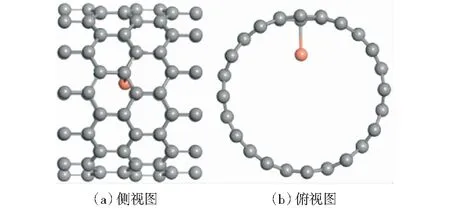
圖1 Cu@CNT催化劑最優結構的側視圖和俯視圖Fig.1 Side view and top view of the optimal structure of Cu@CNT catalyst
1.2 計算方法
本研究中所涉及到的所有計算均采用基于密度泛函理論的VASP軟件包(Vienna abinitio simulation package)進行[22]。采用綴加投影波函數(PAW)來描述電子-離子的相互作用[23],并使用廣義梯度函數(GGA)PEB計算交換相關能[24]。平面波截斷能和布里淵區K點分別設置為270 eV和3×2×2.通過計算甲醇及其裂解過程中涉及到的中間體的吸附能來確定各物種的最佳吸附位點。吸附能Eads使用以下定義式計算:
Eads=ECu@CNT+adsorbate-ECu@CNT-Eadsorbate.
(1)
式中:ECu@CNT+adsorbate是催化劑Cu@CNT和吸附物的總能量,ECu@CNT是Cu@CNT催化劑的能量,Eadsorbate是吸附物的能量。通常Eads為負值時表示該吸附過程為放熱吸附或穩定吸附,且Eads絕對值越大表示被吸附物與催化劑Cu@CNT表面之間的相互作用越強,Eads為正值時則相反[25]。采用NEB法搜索甲醇在Cu@CNT表面裂解過程中所有基元反應的過渡態(TS),并通過虛頻計算進行識別[26-27]。活化能壘(Ea)的計算公式為:
Ea=ETS-EIS.
(2)
式中:ETS、EIS分別為各基元反應中過渡態(TS)和初始態(IS)的能量。速率k可通過傳統過渡態理論計算,k值與指前因子(A)和活化能(Ea)有關[28],如式(3).R和T為氣體常數和溫度(本文中為298 K),kB和h是普朗克常數和玻爾茲曼常數,QIS和QTS分別為初始狀態和過渡狀態的分配函數。
(3)
2 結果與討論
2.1 甲醇及其他中間體的吸附
通過研究甲醇及其他中間體在幾個不同吸附位點的吸附情況,確定了各物種的最優吸附位點。吸附能和吸附構型的相關結構參數列于表1中,構型圖如圖2所示。
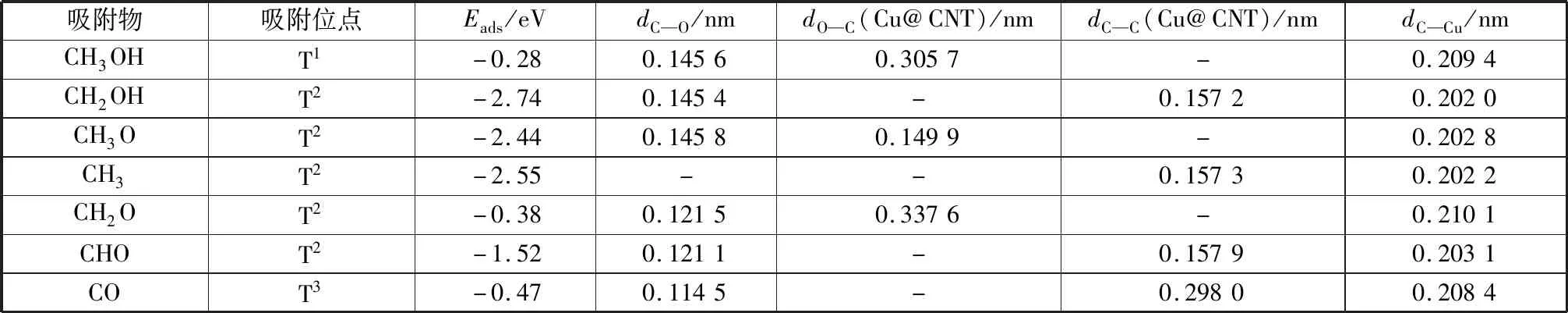
表1 Cu@CNT表面甲醇裂解過程中各物種的吸附能及結構參數Table 1 Adsorption energies and structural parameters of various species during methanol decomposition on Cu@CNT
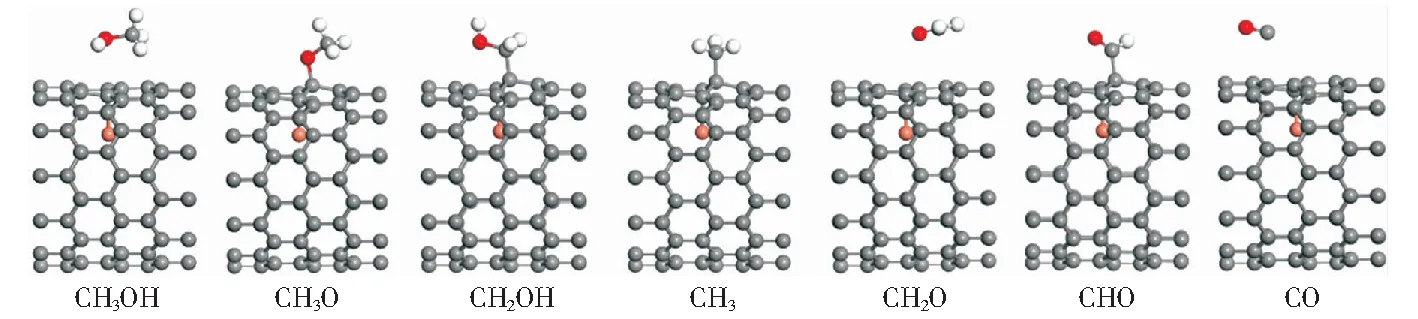
圖2 Cu@CNT表面甲醇裂解過程中各物種的穩定吸附構型Fig.2 Most stable adsorption configurations of various species during methanol decomposition on Cu@CNT
2.1.1CHxOH(x=2,3)
計算結果表明,甲醇的最穩定吸附構型是通過O原子穩定吸附在Cu@CNT面的T1位點,其吸附能為-0.28 eV,甲醇在Cu(110)[29]、Cu(100)[30]和Cu(111)[31]表面的吸附能分別為-0.49 eV、-0.44 eV、-0.36 eV。此外,氣相中甲醇的O—H鍵、C—O鍵和C—H鍵的鍵長分別為0.096 1 nm、0.142 5 nm和0.111 0 nm,吸附后甲醇的O—H鍵和C—O鍵伸長到0.096 6 nm和0.145 6 nm,而C—H鍵縮短到1.105 nm,可見吸附后甲醇變化較小,表明甲醇在Cu@CNT表面的吸附較弱。羥甲基(CH2OH)是甲醇裂解過程中的重要中間體。CH2OH更傾向于通過C原子吸附在Cu@CNT面的T2位點,吸附能為-2.74 eV,而CH2OH在Cu(110)[29]和Cu(100)[30]表面的吸附能分別為-1.97 eV和-1.83 eV.C—O鍵和C—C鍵的鍵長分別為1.454 nm和1.572 nm.
2.1.2CHxO(x=0,1,2,3)
如圖2所示,CH3OH經O—H鍵斷裂形成的甲氧基(CH3O)優選通過O原子吸附在Cu@CNT面T2位點,吸附能為-2.44 eV.CH3O中的O原子與Cu@CNT表面的C原子形成的C—O鍵與管軸方向垂直,鍵長為0.149 9 nm.此外,吸附物CH3O中C—O鍵鍵長(0.145 8 nm)比自由基CH3O中的C—O鍵(0.139 6 nm)長0.062 nm.CH2O由CH3O中C—H鍵斷裂形成,其最穩定的吸附構型是通過O原子吸附在Cu@CNT表面的T1位點,吸附能為-0.38 eV.此外,CH2O中C—O鍵平行于催化劑管軸方向。CHO的最優吸附位為T2位,吸附能為-1.52 eV,CHO在Cu(110)[29]面和Cu(100)[30]面的的吸附能分別為-1.52 eV和-2.23 eV.C—O鍵和C—H鍵的長度分別為0.121 1 nm和0.112 9 nm.此外C—O—H所形成的鍵角為122°.CO優選以通過C原子吸附在Cu@CNT面的T2位點,吸附能為-0.47 eV,而CO在Cu(110)面[29]、Cu(100)面[30]和Cu(111)面[31]的吸附能分別為-1.21 eV、-1.04 eV和-0.98 eV.
如表1所示,CH3OH、CO及CH2O的吸附能遠低于其他物種的吸附能,產生此結果的原因是自由基中間體中具有未成對電子,與Cu@CNT的相互作用強于分子中間體。此外,CO的吸附能為-0.47 eV,有助于其從催化劑表面脫附,提高催化劑對CO中毒的耐受性。Cu@CNT催化劑中C—Cu鍵基本穩定在0.208 7 nm左右,表明該催化劑構型是穩定的。
2.2 甲醇裂解反應
本部分討論了甲醇在Cu@CNT催化劑作用下的裂解機理。甲醇的裂解是從其以氣態形式吸附到Cu@CNT催化劑表面開始的。甲醇有三種可能的裂解路徑,如圖3所示:路徑1,甲醇通過O—H鍵斷裂生成CH3O中間體,最終生成CO或C;路徑2,甲醇通過C—H鍵斷裂生成CH2OH中間體,最終生成CO或C;路徑3則為甲醇通過C—O鍵斷裂生成CH3中間體,隨后通過C—H鍵斷裂產生C.各基元反應的反應熱、活化能壘及速率如表2.主反應路徑中各基元反應的構型圖如圖4所示。
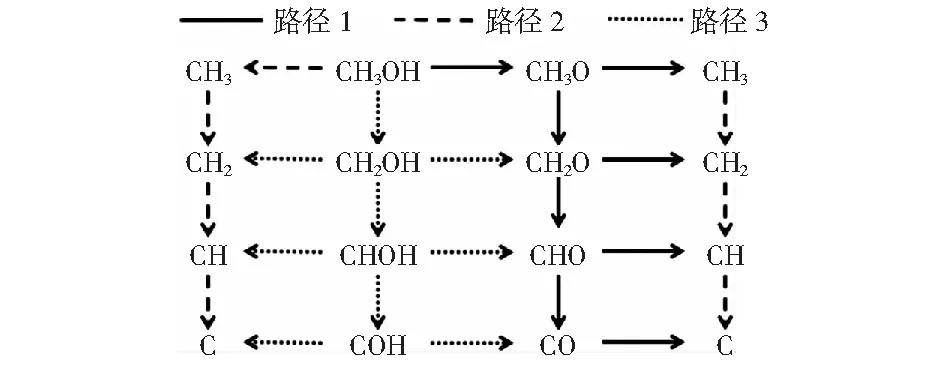
圖3 Cu@CNT表面甲醇裂解的可能路徑Fig.3 All possible paths of methanol decomposition on Cu@CNT
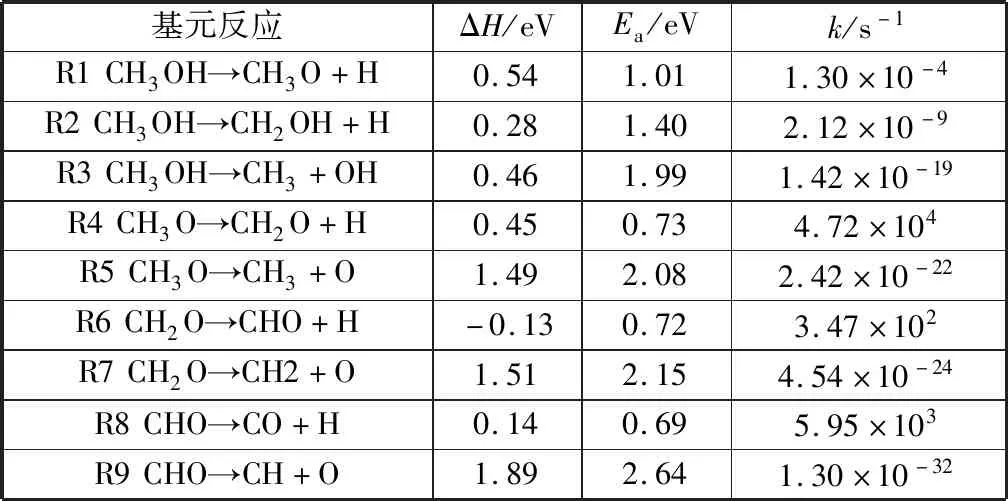
表2 Cu@CNT表面甲醇裂解過程中各基元反應的反應熱ΔH、活化能壘Ea和在298 K下的速率kTable 2 Reaction energy ΔH, activation energy barrier Ea, and rate constant k at 298 K for the elementary steps involved in methanol decomposition on Cu@CNT
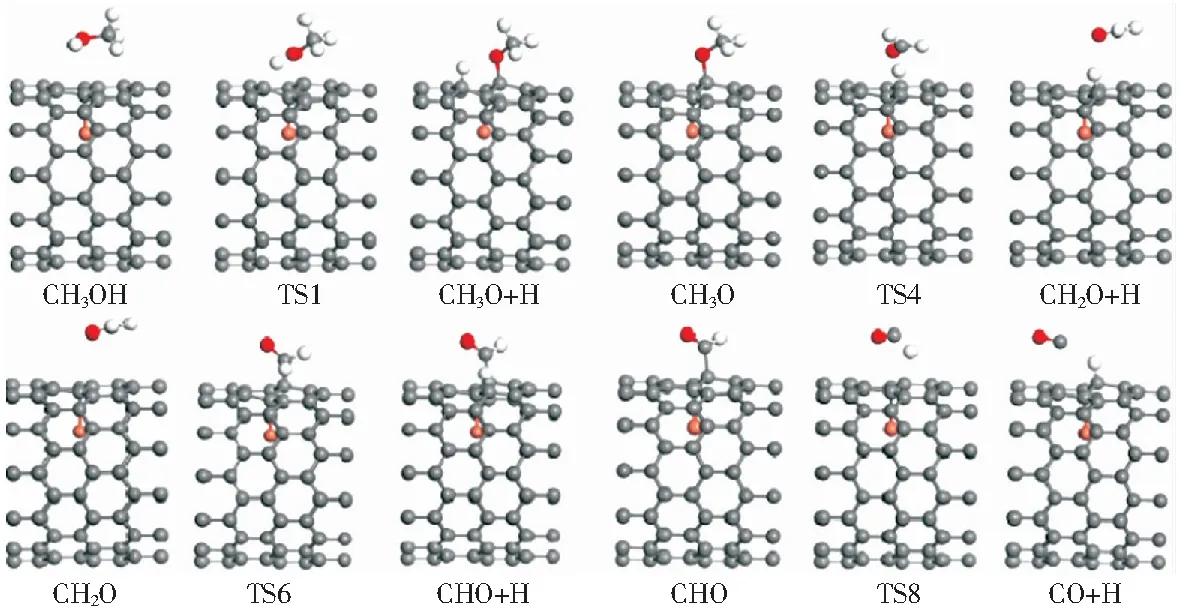
圖4 Cu@CNT表面甲醇裂解主路徑反應的IS,TS和FS的優化構型Fig.4 Optimized configuration of IS, TS, and FS for methanol decomposition reaction on Cu@CNT
2.2.1CH3OH的裂解
甲醇初始裂解有以下三種不同的路徑:分別為O—H、C—H和C—O鍵斷裂。路徑1始于吸附在T1位的CH3OH,終于通過O原子吸附在T2位的CH3O和吸附于T1鄰位的H.在TS1中,O—H鍵長從IS中的0.096 6 nm增加到0.119 7 nm.該過程的活化能為1.01 eV,反應熱為0.54 eV.而在Cu(100)表面CH3OH中C—H鍵斷裂的活化能為1.60 eV[30].在路徑2中甲醇通過C—H鍵斷裂生成CH2OH和H.通過O原子吸附于T1位的CH3OH作為IS,吸附于T2位點CH2OH和吸附于T1位的H原子作為FS.C—H鍵長從IS的0.110 8 nm伸長到TS中的0.164 2 nm.計算結果表明該基元反應的活化能為1.40 eV,反應熱為0.28 eV.CH3OH還可通過C—O鍵斷裂生成CH3和OH,CH3OH中C—O鍵被活化生成通過C原子吸附于T2位點的CH3和垂直吸附于T2對位的OH.該基元反應的活化能為1.99 eV.
甲醇初步裂解的勢能圖如圖5所示。比較甲醇初始裂解的三種不同的路徑發現,CH3OH通過O—H鍵斷裂形成CH3O和H,比通過C—H鍵斷裂形成CH2OH和H和通過C—O鍵斷裂形成CH3和OH具有更低的活化能,因此甲醇初步裂解優選通過O—H鍵斷裂生成CH3O.此外,O—H鍵斷裂(1.30×10-4s-1)的速率遠大于C—O鍵(1.42×10-19s-1)和C—H鍵(2.12×10-9s-1)的斷裂速率。因此后續只討論路徑1.
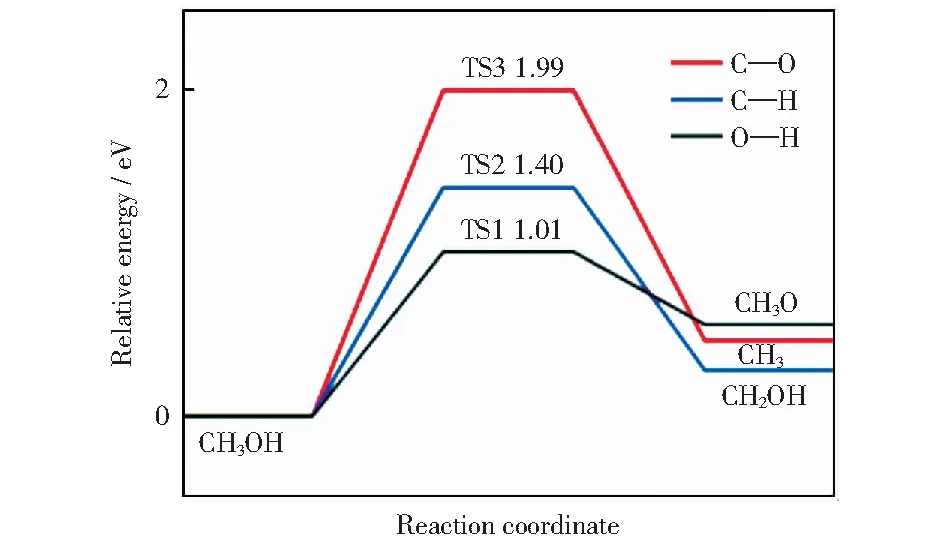
圖5 Cu@CNT表面甲醇初始裂解的勢能圖Fig.5 Potential energy profile of methanol initial decomposition on Cu@CNT
2.2.2CH3O的裂解
CH3O的后續裂解存在兩種路徑。一種是CH3O脫氫形成CH2O,另一種則是通過C—O鍵斷裂形成CH3和O,勢能圖如圖6所示。
對于CH3O脫氫,吸附于T2的CH3O作為IS.在FS中,CH2O從表面上升,并且H原子移動至T1鄰位。C—O鍵逐漸向Cu@CNT表面傾斜(角度α從IS的28°增大到TS的69°),使得C—H鍵更加靠近催化劑表面以促進其活化。該過程的反應熱和活化能分別為0.45 eV和0.73 eV.而CH3O在Cu(100)表面和Cu (111)表面C—H鍵斷裂的活化能分別為3.08 eV[30]和1.85 eV[31].對于C—O鍵的斷裂,活化能為2.08 eV,遠高于C—H斷裂的活化能,表明對于CH3O難以發生C—O鍵的斷裂。此外,在298 K時C—H鍵和C—O鍵斷裂的速率分別為4.72×104s-1和2.42×10-22s-1.
2.2.3CH2O的裂解
如圖6所示,在Cu@CNT表面,CH2O的不同分解路徑會生成兩種不同的中間體,分別為CH2和CHO.CH2O通過脫氫反應可生成CHO和H原子,在過渡態TS6中C—H鍵長從IS中的0.112 7 nm延長到0.128 7 nm,FS中CHO和H原子分別吸附在T2位和T1鄰位。該反應過程的活化能為0.72 eV,同時反應熱為-0.13 eV.而CH2O在Cu(100)表面和Cu(111)表面C—H鍵斷裂的活化能分別為0.85 eV[30]和1.15 eV[31].使CH2O通過C—O鍵斷裂生成CH2和O需要克服2.15 eV的活化能,同時反應熱為1.51 eV.由此可知,與C—H鍵斷裂相比,C—O鍵斷裂不是CH2O裂解的可能路徑。此外反應速率結果顯示C—H鍵斷裂的速率(3.47×102s-1)是C—O鍵斷裂速率(4.54×10-24s-1)的1026倍。
2.2.4CHO的裂解
CHO在T2位點生成后,可進一步通過C—H斷裂生成CO和H,或通過C—O鍵斷裂生成CH和O,勢能圖如圖6所示。對于C—H鍵的斷裂,該過程從吸附在T2位點的CHO中C—H鍵的伸縮振動開始。C—H鍵長從IS中的0.112 9 nm伸長到TS中的0.130 0 nm,O—C—H鍵角從IS中的122.55°增大到TS中232.55°.在FS中,H原子吸附于T2位點,而CO移動到T3位點。該過程的活化能為0.69 eV,反應熱為0.14 eV.而CHO在Cu(100)表面C—H鍵斷裂的活化能為0.84 eV[30]。此外,C—O鍵斷裂的活化能為2.64 eV.與CHO脫氫相比,由于C—O鍵斷裂的活化能遠高于C—H鍵斷裂的活化能,CHO更易發生脫氫反應。CHO中C—H鍵和C—O鍵斷裂的速率分別為5.95×103s-1和1.30×10-32s-1.
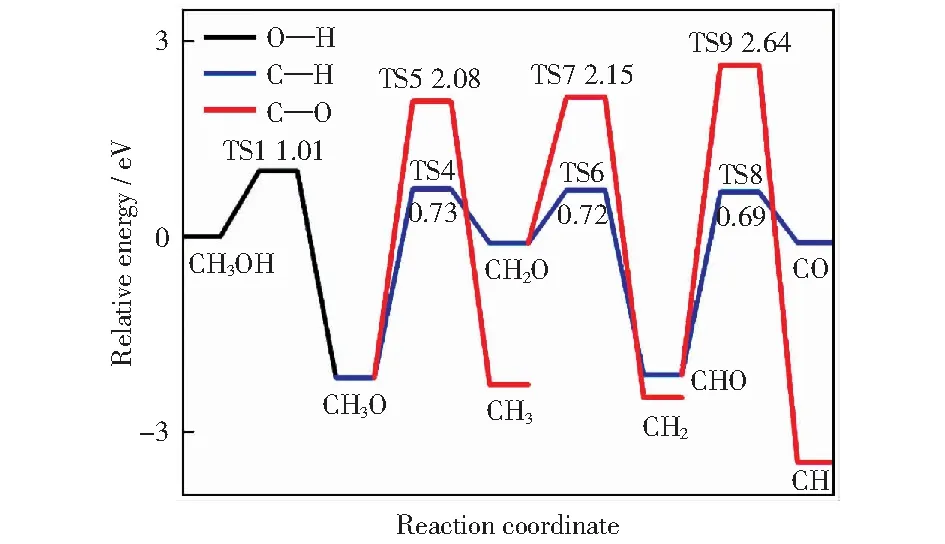
圖6 Cu@CNT表面CH3O后續裂解的勢能圖Fig.6 Potential energy profile of CH3O subsequent decomposition on Cu@CNT
綜上所述,甲醇在Cu@CNT上裂解的最優路徑是CH3OH→CH3O→CH2O→CHO→CO,限速步驟是CH3OH→CH3O.
3 結論
本文運用密度泛函理論探索了甲醇在Cu@CNT表面的裂解反應機理,得到以下結論:甲醇穩定吸附于T1位點,其他物種則穩定吸附于T2位點。對于甲醇的初始裂解,其更易通過O—H鍵斷裂生成CH3O,其后CH3O逐步脫氫最終生成CO,其中O—H鍵的斷裂是限速步驟。且在Cu@CNT表面,甲醇裂解主反應路徑中各基元反應的活化能分別為1.01 eV、0.73 eV、0.72 eV和0.69 eV.甲醇在Cu(100)表面裂解的主路徑與甲醇在Cu@CNT表面裂解的主路徑相同,各基元反應的活化能分別為1.60 eV、3.08 eV、0.85 eV和0.84 eV,故可知Cu@CNT催化劑的催化活性高于Cu(100)催化劑的催化活性。此外,甲醇裂解的最終產物CO在Cu@CNT和Cu(100)表面的吸附能分別為-0.47 eV和-1.04 eV,故Cu@CNT具有更高的CO耐受性。不同于活性位點裸露于反應介質中的Cu(100)催化劑,Cu@CNT催化劑中碳納米管的封裝作用使活性中心和反應介質隔離,反應過程中無積碳的生成。由此可知,碳納米管封裝金屬粒子有效地增強了金屬催化劑的活性和穩定性,是甲醇裂解的高效穩定催化劑。

