翠云草葉綠素代謝途徑及其關鍵酶
楊露露 李林


摘? ?要? ?通過比較藍色葉翠云草、紅色葉翠云草和綠色葉小翠云三者葉綠素合成途徑中11種產物的含量變化,分析翠云草葉綠素代謝途徑及其關鍵酶,為深入研究翠云草葉色變化內在機制奠定基礎。結果顯示,“原卟IX→鎂原卟啉IX”“原葉綠酸酯→葉綠酸酯a”這兩個環節是翠云草葉綠素代謝途徑的關鍵環節,鎂離子螯合酶(CHLH)、光依賴的原葉綠酸酯氧化還原酶(LPOR)是相應的兩個關鍵酶。基于對翠云草葉綠素代謝途徑的分析,推測翠云草中葉綠素a轉化為葉綠素b的效率大于其反向轉化的效率,導致葉綠素a/b值小于2,以適應翠云草生長的蔭蔽環境,滿足其葉綠素需求。
關鍵詞? ?翠云草;葉綠素;代謝途徑;關鍵酶
中圖分類號:S68? ?文獻標志碼:A? ? DOI:10.19415/j.cnki.1673-890x.2020.25.001
彩葉植物尤其是藍色葉植物在園林景觀應用中較為少見。卷柏科(Selaginellaceae)卷柏屬(Selaginella)的翠云草(Selaginella uncinata)是一種藍色葉的蕨類植物,極具觀賞價值[1]。其葉片如羽毛般柔軟,在蔭蔽條件下呈現藍色,在全光照下變為暗紅色,葉色變化呈現的景觀效果很獨特,具有廣闊的園林應用前景。
迄今為止,國內外對翠云草的研究主要集中在基因組學、栽培繁殖、化工及藥理學方面。Tsuji等[2]、Smith[3]、Oldenkott等[4]對翠云草進行了基因組學方面的研究。H Bant等研究了卷柏屬的藤卷柏(S. willdenovii)和翠云草,利用透射電子顯微鏡觀察其葉片橫切面的組織構造,認為翠云草的藍色葉與其葉片上層表皮的外側細胞壁內兩層薄膜干涉濾器引發光的薄膜干涉有關[5]。鄭俊霞等[6]、邱宏聰等[7]、賴紅芳等[8]對翠云草的化學組成、提取工藝、藥理作用等進行了研究。黃莉潔[9]、張旭樂等[10]、楊俊杰[11]總結了翠云草的引種人工栽培和繁殖技術。李林等[12]、LI L等[13]、張水木等[14]從翠云草葉色變化及其分子機理等方面探討了翠云草呈色變化機制。
本研究通過比較三種植物材料(藍色葉翠云草、紅色葉翠云草和綠色葉小翠云)葉綠素合成途徑中11種中間產物含量的變化,探討翠云草葉綠素代謝途徑的特點及關鍵酶,為深入研究翠云草葉色變化的內在機制,最終實現人工調控葉色奠定基礎。
1 材料與方法
1.1 試驗材料
試驗基地位于廣西大學林學院苗圃(22°50′N,108°17′E)。盆栽(株齡均為6個月)翠云草和同屬的小翠云(S. kraussiana)購自廣西花鳥市場,參照李林等[12]的方法對所用植物材料進行預處理,得到全光照下栽培的紅色葉翠云草(圖1B),用于和放在三層遮蔭條件下栽培的藍色葉翠云草(圖1A)和綠色葉小翠云(圖1C)進行對比試驗。
1.2 試驗方法
隨機采集植株各個方向正常生長的成熟葉片,測定葉綠素生物合成各產物的含量。
1.2.1 葉綠素合成前體物質的測定
利用全自動波長酶標儀測定葉綠素合成前體物質的吸光值,其中δ-氨基酮戊酸(ALA)、膽色素原(PBG)、尿卟啉原Ⅲ(Urogen Ⅲ)、糞卟啉Ⅲ(Coprogen Ⅲ)、原卟啉IX(Proto IX)、鎂原卟啉IX(Mg-Proto IX)和原葉綠酸酯(Pchlide)含量的測定參照宗學鳳[15]、趙明輝等[16]、王平榮等[17]、楊海蕓[18]的方法,并適當調整,單位均采用nmol·g-1。
1.2.2 葉綠素及其衍生物含量的測定
利用高效液相色譜法(WATERS E2695 HPLC系統)對葉綠素及其衍生物含量進行測定,根據標準曲線,利用保留時間和峰面積確定樣品中的物質種類和含量。標準品葉綠素a(Chl a)和葉綠素b(Chl b)購于Sigama公司。標準品葉綠酸酯a(Chlide a)和葉綠酸酯b(Chlide b)利用翠云草葉片中葉綠素酶(Chlase,參照Costa[19]的方法提取)分別以標準品Chl a和Chl b為底物發生反應得到,所得的Chlide a和Chlide b僅可進行定性,無法測定標準樣中Chlide a和Chlide b的具體含量,因此在結果分析中以樣品中檢測出的峰面積相對比較三種植物材料葉片中Chlide a和Chlide b含量情況。
葉綠素及其衍生物的HPLC分析參照程紅艷等[20]的方法,略加改進。取0.15 g植物葉片迅速加入5 mL甲醇溶液充分浸泡,并用超聲波機器震蕩15 min至無色,過濾待測。檢測條件為柱型C18(4.6 mm×250 mm,德國Nucleodur色譜柱),檢測波長430 nm,流動相為A(甲醇、水的體積比為80∶20)和B(乙酸乙酯)。梯度洗脫為:0~20 min,A 100%~50%,B 0%~50%;20~40 min,A=50%,B=50%。流速設置為0.8 mL·min-1,進樣量為10 μL。
1.3 數據整理
利用Word 2010、Excel 2010進行數據處理、制圖、制表,利用SPSS 20.0進行方差分析和相關性分析。
2 結果與分析
2.1 葉綠素合成前體物質含量分析
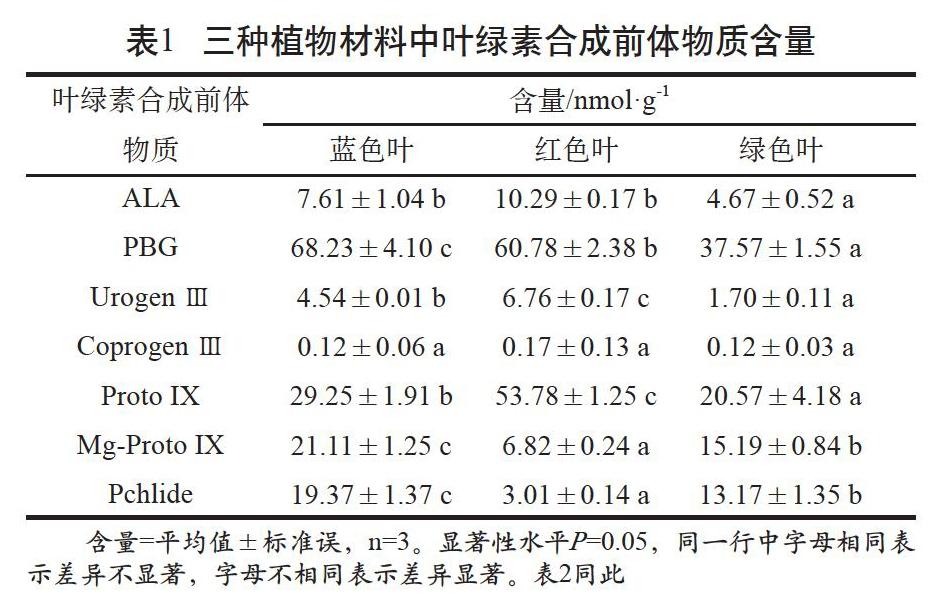
從表1可以看出,除Coprogen Ⅲ外,其余各產物含量在三種葉色中都具有顯著性差異,但其大小的變化趨勢在三種葉色中不一致。
2.2 葉綠素及其衍生物分析
2.2.1 葉綠素及其衍生物HPLC圖譜
圖2為三種植物材料在430 nm處的葉綠素及其衍生物HPLC色譜圖。各主要物質的出峰時間分別為:Chl a,29.846 min;Chl b,26.169 min;Chlide a,11.788 min。除Chlide b以外,另外3種物質在三種植物材料中均可以檢測到。此外,三種葉色都在17.669 min處檢測到脫鎂葉綠素a(Pheide a)。
2.2.2 葉綠素及其衍生物含量分析
表2顯示,除葉綠素a/b外,三種植物材料中Chl a、Chl b、Chl a+b和Chlide a都存在顯著差異。Chl a、Chl b、Chl a+b的大小變化趨勢相同,都是藍色葉>綠色葉>紅色葉,且3種葉色中都是Chl a>Chl b。Chlide a的大小變化則是綠色葉>藍色葉>紅色葉。葉綠素a/b值均小于2,大小依次為紅色葉>綠色葉>藍色葉。
2.3 葉綠素合成產物相對含量比較
為了便于更直觀地分析和描述,將藍色葉中各物質含量設定為100,與紅色葉和綠色葉進行比較,且分別將葉綠素合成過程ALA→PBG→Urogen III→Coprogen Ⅲ→Proto IX→Mg-Proto IX→Pchlide→Chlide a→Chl a→Chl b命名為階段①~階段⑨,結果見圖3(參考楊露露[21]并做了一些改動)。
1)在階段①,紅色葉中合成的前體物質由原來藍色葉的135.25%下降到89.09%,緊接著在階段②又上升到148.99%,在階段③和階段④中,紅色葉>藍色葉的趨勢不變,但到了階段⑤,紅色葉中的合成產物急劇下降為藍色葉的32.39%,其后一直保持低于藍色葉的趨勢。根據以上藍色葉和紅色葉的比較分析,推測階段①ALA→PBG、階段②PBG→Urogen III和階段⑤Proto IX→Mg-Proto IX是翠云草葉綠素合成的關鍵環節。
2)在階段③,綠色葉中合成的前體物質由原來藍色葉的37.46%上升到100.76%,緊接著在階段④又下降到藍色葉的70.32%,在階段⑤和階段⑥中,藍色葉>綠色葉的趨勢不變,但到了階段⑦,綠色葉中的合成產物快速上升為藍色葉的128.34%,隨后階段⑧又急劇下降為71.06%,其后保持低于藍色葉的趨勢。根據以上藍色葉和綠色葉的比較分析,推測階段③Urogen III→Coprogen Ⅲ、階段④Coprogen Ⅲ→Proto IX、階段⑦Pchlide→Chlide a和階段⑧Chlide a→Chl a是翠云草葉綠素合成的關鍵環節。
2.4 翠云草葉綠素合成產物相關性分析
將翠云草葉綠素合成途徑各中間產物:ALA、PBG、Urogen III、Coprogen III、Proto IX、Mg-Proto IX、Pchlide、chlide a的含量分別與葉綠素指標進行相關性分析,結果(見表3)顯示,前4個中間產物ALA、PBG、Urogen III、Coprogen III的含量與葉綠素各指標均無顯著相關關系,而后4個中間產物Proto IX、Mg-Proto IX、Pchlide、Chlide a的含量與葉綠素各指標(除Chl a/b外)顯著相關。
3 討論與結論
3.1 翠云草的耐陰性
植物在不同光照強度的生長環境中,為滿足體內葉綠素性能的需求,可以利用葉綠素循環,自我調整Chl a和Chl b的比值[22]。一般說來,葉綠素含量高、Chl a/b比值小的植物具有較強的耐陰性。低的Chl a/b值能提高植物對遠紅光的吸收,因而在弱光下,具有較低的Chl a/b值及較高的葉綠素含量的植物,也具有較高的光合活性。蕨類作為典型的陰生植物,Chl a/b值通常小于3∶1[23]。據丁曉浩等報道,其所測的10種觀賞蕨在3種不同光照處理下的Chl a/b值均小于3∶1,為(0.17~2.49)∶1[23]。
本研究中三種植物材料Chl a/b值均小于2,和丁曉浩等的研究結果[23]一致。其比值大小依次為紅色葉翠云草>綠色葉小翠云>藍色葉翠云草,說明翠云草比同屬的小翠云耐陰,而紅色葉翠云草是受到強光脅迫形成的[12],其耐陰性最差。
3.2 翠云草葉綠素合成關鍵環節和關鍵酶
根據前文(“2.3”節)藍色葉和紅色葉、綠色葉的比較分析,推測翠云草葉綠素合成的關鍵環節是階段①ALA→PBG、階段②PBG→Urogen III、階段③Urogen III→Coprogen Ⅲ、階段④Coprogen Ⅲ→Proto IX、階段⑤Proto IX→Mg-Proto IX、階段⑦Pchlide→Chlide a和階段⑧Chlide a→Chl a這7個環節。
通過“2.4”節相關性分析可知,Proto IX、Mg-Proto IX、Pchlide 、Chlide a這4個產物與葉綠素指標顯著相關。即圖3中的階段④→階段⑦環節與葉綠素合成的關系更為密切。
Li等根據轉錄組數據,對翠云草葉綠素代謝相關基因進行差異表達分析,發現鎂離子螯合酶(CHLH)、光依賴的原葉綠酸酯氧化還原酶(LPOR)、葉綠素酶(CLH)(即圖3中的階段⑤、階段⑦和階段⑨所對應的3個酶)在藍色葉中比紅色葉中均有所上調[13]。
綜上,我們認為階段⑤Proto IX→Mg-Proto IX和階段⑦Pchlide→Chlide a這兩個環節是翠云草葉綠素代謝途徑的關鍵環節,CHLH和LPOR是相應的兩個關鍵酶。
3.3 翠云草葉綠素代謝途徑
楊海蕓對花葉矢竹(Pseudosasa japonica f. akebonosuji)進行葉色突變研究,發現引起其葉色變異的原因在于:Coprogen III→Proto IX這一中間過程(圖3中的階段④)生成的Proto IX與上一產物Coprogen III相比較,其相對含量水平急劇下降,導致花葉矢竹白色條紋葉Chl a、Chl b和總葉綠素的含量均低于綠色葉,致使葉片顏色變淡或白化[18]。孫捷音等發現油菜(Brassica napus)的葉綠素合成途徑中,從PBG→Urogen III(圖3中的階段②),和野生型相比,其含量降低了一半,是Chl b的缺失造成了葉色突變[24]。董立花采用熒光光譜和紫外可見光譜分析了金心吊蘭(Chlorophytum capense var. Medio-pictum)葉綠素代謝流中間產物的變化,發現其金心部分ALA、Proto IX和Pchlide的合成(圖3中的起始環節和階段④、階段⑥)受阻,且推測ALA合成受阻可能是其形成黃色葉條紋的主要原因[25]。上述各例都是由于葉綠素合成過程中Chl a、Chl b和總葉綠素產生變化后導致葉色發生改變。Li等通過對藍色葉翠云草和紅色葉翠云草進行轉錄組測序,找到了翠云草葉綠素代謝途徑中幾乎所有的酶,且基于兩個樣本中的葉綠素合成酶(Chlorophyllsynthase, CS)和葉綠素a加氧酶(CAO)的表達都沒有顯著差異的結果,推斷翠云草中兩種葉綠素的合成都沒有受阻[13]。
從L-谷氨酰-tRNA到Chl a,再到Chl b,整個葉綠素生物合成過程一共15步反應,需要15種酶參與[17]。葉綠素循環過程從Chlide a開始,經過CS酯化反應形成Chl a。Chl b是由Chl a轉化形成的,在此過程中,Chlide a在CAO的催化下形成Chlide b,Chlide b在CS作用下形成Chl b。而Chl b在一定的條件下也可還原為Chl a。植物可以利用Chl a和b能夠相互轉化的反應來調整葉綠素a/b的比值以適應不同的生理條件和環境變化[26]。通常Chl a和Chl b吸收不同的波長,前者吸收紅光而后者主要吸收藍紫光,在蔭蔽條件下,Chl b能夠利用環境中的藍紫漫反射光適應光照條件。本試驗應用HPLC在三種葉色材料中檢測到Chl a、Chl b和Chlide a,但均未檢測到Chlide b,推測Chlide a在CAO催化下,產生的Chlide b迅速進入下一步反應生成Chl b,使得Chlide b在代謝流中不積累,即翠云草中Chl a轉化為Chl b的效率大于其反向轉化的效率,導致葉綠素a/b值小于2,以適應翠云草生長的蔭蔽環境,滿足其葉綠素需求。
圖4為我們參考Li等[13]并做了一些改動,總結出的翠云草葉綠素代謝通路圖。
參考文獻:
[1] 吉醒.蒼翠清新的翠云草[J].花木盆景(花卉園藝),2011(10):10-11.
[2] Tsuji S, Ueda K, Nishiyama T, et al. The chloroplast genome from a lycophyte (microphyllophyte), Selaginella uncinata, has a unique inversion, transpositions and many gene losses[J]. Journal of Plant Research, 2007, 120(2): 281-290.
[3] Smith D R. Unparalleled GC content in the plastid DNA of Selaginella[J]. Plant Molecular Biology, 2009, 71(6): 627-639.
[4] Oldenkott B, Yamaguchi K, Tsuji-tsukinoki S, et al. Chloroplast RNA editing going extreme: more than 3400 events of C-to-U editing in the chloroplast transcriptome of the lycophyte Selaginella uncinata[J]. RNA, 2014, 20(10): 1499-1506.
[5] H Bant C, LEE D W. Ultrastructural Basis and Developmental Control of Blue Iridescence in Selaginella Leaves[J]. American Journal of Botany, 1984, 71(2): 216-219.
[6] 邱宏聰,陳小剛.壯藥材翠云草化學成分、藥理活性及質量控制的研究進展[A].中華中醫藥學會.中華中醫藥學會第七次中藥分析學術交流會會議論文集[C].廣州,2014.
[7] 鄭俊霞,鄭揚,顏秋萍,等.翠云草總黃酮的提取工藝研究[J].中藥材,2011(12):133-135.
[8] 賴紅芳,溫曉娟.果膠酶法提取翠云草中總黃酮的工藝優選[J].中國實驗方劑學雜志,2012,18(23):34-36.
[9] 黃莉潔.觀賞蕨類卷柏——翠云草的引種栽培和繁殖技術[J].農業研究與應用,2011(5):86-88.
[10] 張旭樂,楊燕萍,黃建,等.蕨類植物翠云草栽培繁殖技術及園林應用價值[J].農業科技通訊,2009(6):202-203.
[11] 楊俊杰.翠云草栽培管理技術[J].農業工程技術·溫室園藝,2015(4):46-48.
[12] 李林,黃潔瑜,張水木,等.不同遮蔭處理對翠云草葉色變化的影響[J].分子植物育種,2015(5):193-198.
[13] LI L, WANG Q, DENG R, et al. Transcriptome profiling of blue leaf coloration in Selaginella uncinata[J]. Canadian Journal of Plant Science, 2016, 97(4): 580-593.
[14] 張水木,彭媛媛,李林.不同光質處理對翠云草葉色變化的影響[J].北方園藝,2016(12):75-79.
[15] 宗學鳳.水稻葉片全生育期黃化突變體ylg3葉綠素合成特性研究[J].西南大學學報(自然科學版),2013,35(11):21-26.
[16] 趙明輝,隋陽輝,陳溫福.超綠水稻葉綠素的生物合成[J].作物雜志,2010(6):33-37.
[17] 王平榮,張帆濤,高家旭,等.高等植物葉綠素生物合成的研究進展[J].西北植物學報,2009(3):207-214.
[18] 楊海蕓.花葉矢竹葉色變異機理研究[D].北京:北京林業大學,2015.
[19] COSTA M L, CIVELLO P M, CHAVES A R, et al. Effect of ethephon and 6-benzylaminopurine on chlorophyll degrading enzymes and a peroxidase-linked chlorophyll bleaching during post-harvest senescence of broccoli (Brassica oleracea L.) at 20℃[J]. 2005, 35(2): 191-199.
[20] 程紅艷,陳軍輝,張道來,等.超聲波輔助提取RP-HPLC法測定滸苔中的葉綠素a、b[J].海洋科學,2010,34(2):23-27.
[21] 楊露露.觀賞蕨翠云草葉綠素代謝途徑研究[D].南寧:廣西大學,2019.
[22] 李祖祥,呂梅,夏愛軍.遮陰對冷季型草坪草葉綠素含量和生物量的影響[J].草原與草坪,2017,37(5):69-74.
[23] 丁曉浩,何云核.10種觀賞蕨類植物的耐陰性[J].江蘇農業科學,2013,41(6):160-162.
[24] 孫捷音,張年輝,杜林方,等.油菜葉綠素b減少突變體Cr3529葉綠素生物合成的研究[J].西北植物學報,2007,27(10):1962-1966.
[25] 董立花.金心吊蘭的葉綠素生物合成以及光脅迫的耐受性[D].雅安:四川農業大學,2015.
[26] 陳熙.低葉綠素b水稻類囊體膜的蛋白質組學研究[D].南京:南京農業大學,2009.
(責任編輯:丁志祥)

