水環境中萊茵衣藻對納米氧化銅的吸附及離子溶出的影響
崔曉倩,陳國棟,鄭 昊,李曉晨
(1.臨沂首創博瑞水務有限公司,山東 臨沂 276021; 2.山東農業大學水利與土木工程學院,山東 泰安 271018;3.臨沂首創環保發展有限公司,山東 臨沂 276002)
隨著納米技術的廣泛應用,金屬納米顆粒(metal nanoparticles,MNPs)不可避免地在生產、消費或處置過程中匯集于水環境[1-2],其在水環境中具有遷移能力強、影響范圍廣等特點[3-4]。MNPs進入水環境后會受各種生物和非生物因素的影響發生相應的遷移轉化[5],可通過靜電吸引、氫鍵作用、配位作用等吸附在微生物細胞表面,也可通過微生物的吸附架橋作用發生異團聚作用[6-8],從而改變在水環境中的歸趨和生態毒性效應[9]。對于水環境中的MNPs(如Ag-NPs、CuO-NPs、ZnO-NPs等)來說,其粒子表面的溶解離子被釋放到水體中是一個重要的過程。MNPs的溶解不僅會改變其在水環境中的粒徑和賦存形狀,也會降低顆粒本身在環境中的持久性和長期的生物可利用性。MNPs在水環境中的溶解受其自身特性、水化學條件等的影響,水生生物的存在也會影響其溶解程度[10]。微藻是自然水環境中廣泛存在的一種細胞結構簡單、生長繁殖快的水生生物[11]。在水環境中,微藻和MNPs會以多種形式長期共存,微藻必然對MNPs的遷移和潛在生物毒性產生重要影響[12]。微藻對MNPs的吸附主要依賴于微藻細胞表面含有豐富的羧基、羥基、氨基等官能團,這些官能團易于與MNPs結合,從而將其吸附在細胞表面[13]。已有研究表明死亡藻體對重金屬離子具有較強的吸附能力,如Jacinto等[14]發現馬尾藻對Cr6+和Cu2+均具有較強的吸附去除能力,其吸附容量是普通商品活性炭的6倍;Gupta等[15]發現水綿對鉛離子具有很強的吸附能力等。此外,金屬氧化物納米顆粒在水體中會有不同程度的溶解,可以釋放出自由金屬離子。有些研究認為,水環境中MNPs的自由離子釋放是其生態毒性的主要致毒機理,如Hou等[16]認為Zn2+的釋放是納米氧化鋅(ZnO-NP)對羊角月牙藻毒性抑制效應的主要原因。微藻細胞表面通常會存在大量的胞外多聚物(extracellular polymeric substances, EPS)和一些胞外酶,而EPS和胞外酶都可能會對MNPs的自由離子釋放產生一定的影響[17]。
萊茵衣藻(Chlamydomonasreinhardtii)是一種常用的測試污染物毒性效應的模式水生生物[18],納米氧化銅(CuO-NPs)則是人們生產、生活中廣泛應用且備受生態毒理學關注的一類MNPs[19-24]。本文采用批量試驗研究萊茵衣藻對CuO-NPs的吸附特性和機理及其對CuO-NPs中自由離子(Cu2+)溶出的影響,旨在探討微藻對水環境中金屬納米顆粒遷移轉化的影響和利用其進行生態修復的可行性。
1 試驗材料與方法
1.1 試驗溶液的來源及配制
試驗所用的CuO-NPs粉末購于上海阿拉丁有限公司,平均粒徑40 nm,純度為99.5%,比表面積為29 m2/g。儲備液的配制參照文獻[25],在超純水中加入一定量的CuO-NPs(需要時可調節pH值),為使其更好地分散,需進行超聲處理,離心后取上清液作為儲備液,初始濃度以上清液中的相應金屬離子濃度為準。
試驗所用的萊茵衣藻由中國科學院野生生物種質庫-淡水藻種庫提供。培養基為液體SE培養基。將萊茵衣藻接種于SE培養基中,放置于培養溫度為25 ℃、光照條件2 000 lux、光照周期12L/12D的光照培養箱中培養。培養至對數生長初期后進行試驗,起始濃度均為100萬個/mL。
1.2 試驗方法
1.2.1吸附等溫線試驗
在100 mL的聚乙烯塑料瓶中加入處于對數生長期的萊茵衣藻藻液50 mL,溫度為22 ℃的情況下,分別投加10 mg/L、20 mg/L、50 mg/L、100 mg/L、200 mg/L 的CuO-NPs,放入220 r/min的震蕩培養箱中振蕩一段時間后取出,置于4 000 r/min的離心機中離心30 min,取上清液,用石墨爐原子吸收分光光度計在波長為324.7 nm處測定Cu2+的質量濃度。為消除其他因素對試驗結果的影響,在測定特定因素對萊茵衣藻吸附效果的影響時,將其他試驗條件設置為相同的固定值。設置3組平行試驗以排除容器對離子吸附造成的影響。在不添加藻液的SE培養基中加入CuO-NPs,作為對照組研究SE培養基對試驗的影響。采用Langmuir和Freundlich等溫線模型對試驗數據進行擬合。Langmuir和Freundlich模型的吸附等溫線表達式分別為
(1)
(2)
式中:qe為吸附反應達到平衡時萊茵衣藻對Cu2+的吸附量,μg/106個;qmax為萊茵衣藻對Cu2+發生單層吸附時的最大吸附量,為Langmuir等溫線模型對所得試驗數據進行線性擬合后擬合曲線斜率的倒數,即斜率越小,吸附效果越好,μg/106個;ρe為吸附反應達到平衡時Cu2+的質量濃度,μg/L;KL為Langmuir吸附等溫線的常數,與吸附速率正相關,L/μg;KF為單位濃度吸附質存在時,吸附劑對其的吸附量,數值大小與吸附劑和吸附質的性質以及溫度有關,與溫度呈負相關,可用來表征吸附劑的吸附能力;1/n為擬合曲線斜率,范圍為0~1,可反映溶液濃度對吸附強弱的影響程度,1/n越小說明吸附能力越強,當0.1≤1/n≤0.5時易于吸附,1/n>0.5則難以吸附[26]。
1.2.2吸附動力學試驗
取300 mL處于對數生長期的萊茵衣藻藻液,在溫度為22 ℃情況下進行吸附試驗,藻液初始pH值為7.4,投加50 mg/L的CuO-NPs,在接觸時間分別為0、10 min、30 min、60 min、90 min、120 min時取藻液,測定其中Cu2+的質量濃度。用準二級動力學模型對所得試驗數據進行擬合,其線性方程表達式為
(3)
式中:qt為t時刻萊茵衣藻對Cu2+的吸附量,μg/106個;k2為二級動力學吸附速率常數,min-1。
1.2.3萊茵衣藻對Cu2+溶出影響試驗
在SE培養基及不同濃度(0、50萬個/mL、100萬個/mL、200萬個/mL)的萊茵衣藻藻液中分別加入不同質量濃度ρ1(10 mg/L、20 mg/L、50 mg/L、100 mg/L、200 mg/L)的CuO-NPs,并將混合液置于溫度為22 ℃、轉速為160 r/min的恒溫震蕩箱中震蕩。96 h后取10 mL的混合液放入離心機中,以4 000 r/min的速率離心30 min,取上清液用石墨爐原子吸收分光光度計測定Cu2+離子的質量濃度ρ2,并計算離子溶出比例(ρ1/ρ2)。每組設置3組平行試驗。利用Microsoft Excel和Origin 8.0對試驗數據進行整理、分析。
2 結果與分析
2.1 萊茵衣藻對CuO-NPs的吸附及影響因素
2.1.1CuO-NPs投加量對吸附效果的影響
不同CuO-NPs投加量下萊茵衣藻對CuO-NPs的吸附情況如圖1所示。由圖1可見,隨著CuO-NPs投加量增加,萊茵衣藻細胞對CuO-NPs的吸附量也隨之增加。但當CuO-NPs的投加量為 100 mg/L 和200 mg/L時,兩者的吸附量并無顯著差異(P>0.05),產生這種現象的原因可能是在CuO-NPs質量濃度較低時,萊茵衣藻細胞表面吸附活性位點數量多于CuO-NPs粒子,藻細胞對CuO-NPs的吸附量取決于CuO-NPs的質量濃度;而隨著CuO-NPs質量濃度的升高,CuO-NPs粒子的數量逐漸超過了藻細胞表面的活性位點數量,藻細胞表面吸附達到飽和,吸附量難以繼續增加。此外,高質量濃度的CuO-NPs在微藻培養液中更易發生團聚而沉降[26],導致溶液中吸附質的濃度降低,減弱了吸附動力,也會降低萊茵衣藻細胞對CuO-NPs吸附效率。

圖1 不同CuO-NPs投加量下萊茵衣藻對CuO-NPs的吸附情況Fig.1 Adsorption of CuO-NPs by Chlamydomonas reinhardtii at different dosage of CuO-NPs
2.1.2接觸時間對吸附效果的影響
在0~30 min 的初始吸附階段,萊茵衣藻細胞對CuO-NPs的吸附量迅速增加,很快達到了最大值167 μg/L,主要是因為此階段萊茵衣藻藻細胞表面的活性點位數量充足,加之CuO-NPs的質量濃度大,吸附驅動力大,CuO-NPs可快速被吸附到藻細胞表面,屬于快速吸附階段。隨著時間的延長,CuO-NPs發生團聚、沉降,溶液中的吸附質減少,驅動力降低,同時,萊茵衣藻細胞表面空閑活性點位減少,吸附量增加緩慢,屬于緩慢吸附階段[27]。在試驗后期,萊茵衣藻對CuO-NPs的吸附量有所降低,吸附量下降至 160 μg/L,出現了解吸現象;但是解吸量很低,說明CuO-NPs與藻細胞的吸附較為穩定。
2.2 吸附等溫線
萊茵衣藻細胞對CuO-NPs的吸附等溫線如圖2所示。可以看出,Langmuir和Freundlich等溫線模型對萊茵衣藻細胞吸附CuO-NPs的過程均有較高的擬合度,R2分別為0.942 1及0.965 1。Langmuir等溫線模型擬合效果優良說明萊茵衣藻對CuO-NPs的吸附是單層的,CuO-NPs占據萊茵衣藻細胞表面不同活性位點的可能性是一樣的,并且不同位點是否吸附CuO-NPs與其他位點無關,即各位點之間是相互獨立的。Freundlich等溫線模型中1/n遠遠小于1,說明萊茵衣藻對CuO-NPs親和力較好,吸附較易進行,且為多分子層吸附。從兩種等溫線模型的擬合結果可以看出,萊茵衣藻細胞對CuO-NPs的吸附是單層吸附和多層吸附共存的過程。此外,由Langmuir等溫線模型可以得到萊茵衣藻對CuO-NPs的最大吸附量為128 μg/106個。

(a) Langmuir模型
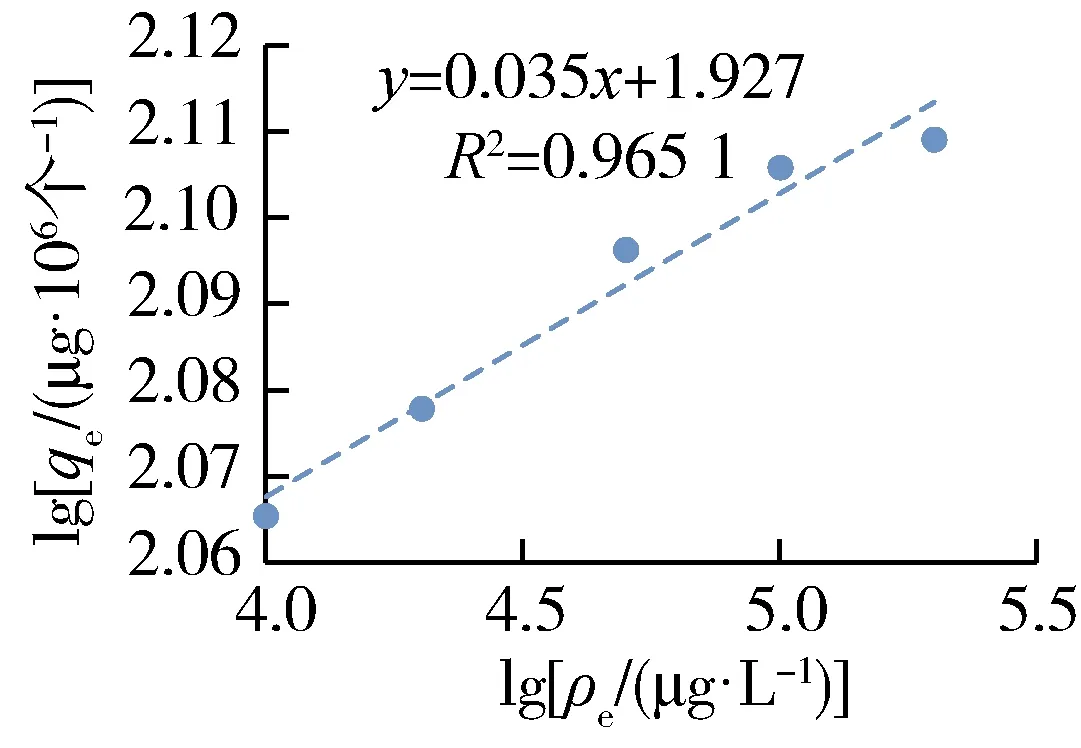
(b) Freundlich模型圖2 萊茵衣藻對CuO-NPs的吸附等溫線Fig.2 Adsorption isotherms of Chlamydomonas reinhardtii to CuO-NPs
2.3 吸附動力學
萊茵衣藻對CuO-NPs的吸附動力學擬合結果如圖3所示。可以看出,萊茵衣藻吸附CuO-NPs的準二次模型的R2為0.999 97,說明吸附過程的擬合效果很好,能準確地反映吸附模式,也說明了物理吸附和化學吸附同時對萊茵衣藻吸附CuO-NPs起作用。

圖3 萊茵衣藻對CuO-NPs的吸附動力學擬合結果Fig.3 Fitting results of adsorption kinetics of Chlamydomonas reinhardtii to CuO-NPs
由試驗結果可以看出,萊茵衣藻對水環境中的CuO-NPs表現出較強的吸附去除能力,可有效降低水環境中CuO-NPs的質量濃度,減小其對環境的潛在危害。微藻與MNPs之間的吸附機理主要包括范德華力、疏水性、靜電吸引和特定的化學反應(包括氫鍵和受體配體的相互作用)。此外,微藻細胞及其分泌的EPS還會通過吸附架橋作用導致MNPs的異團聚作用[28]。還應當引起注意的是,目前有關微藻對MNPs的吸附(去除)多針對死亡藻體來探討,主要原因在于研究者多數認為MNPs對微藻生長及生物活性的抑制效應會導致微藻死亡[29-30]。然而,在實際水環境中,MNPs的賦存濃度一般僅僅處于μg或者ng的痕量水平,即按照已有的關于MNPs的毒性效應研究結果來分析,尚不足以導致微藻死亡。在實際地表水環境中微藻廣泛而大量存在,對于處于痕量水平的MNPs,利用水體原有的微藻進行原位處理或修復具有重要的潛在價值。
2.4 萊茵衣藻對Cu2+溶出的影響
圖4為不同質量濃度萊茵衣藻對Cu2+溶出的影響。由圖4可見,隨著CuO-NPs投加量的增加,Cu2+的溶出比例呈現出逐漸降低的趨勢,原因可能在于隨著質量濃度的增加,CuO-NPs更易于發生自團聚和異團聚,從而導致CuO-NPs膠體顆粒的有效表面積和裸露于水相的活性點位降低,由此抑制了Cu2+的溶出。Baalousha等[31-32]研究也發現MNPs在水中的初始濃度會影響其在水中的溶解和聚合過程,自然水體中更低濃度會導致更高的溶解率和較小的團聚粒徑。

圖4 不同質量濃度萊茵衣藻對Cu2+溶出的影響Fig.4 Effect of Chlamydomonas reinhardtii with different concentrations on Cu2+ release
從圖4中還可以看出,萊茵衣藻的加入破壞了溶液中CuO-NPs和Cu2+之間的溶解平衡。與對照組(藻液濃度為0)相比,萊茵衣藻的存在明顯地促進了Cu2+的溶出。當萊茵衣藻的濃度為100萬個/mL時Cu2+的溶出比例是對照組的2倍多;但是,與萊茵衣藻濃度為50萬個/mL、100萬個/mL相比,當萊茵衣藻濃度進一步升高到200萬個/mL時,Cu2+的溶出比例反而迅速下降。水環境中CuO-NPs的溶解是氧氣和質子共同參與的化學反應[33],即,
CuO-NPs+O2+H+?Cu2++H2O
(4)
由式(4)可知,在萊茵衣藻濃度較低時,由于藻細胞表面的有機官能團與Cu2+絡合而吸附在藻細胞表面,降低了水體中Cu2+的濃度,從而促進了Cu2+的溶出。此外,藻在光合作用過程中釋放出游離O2,也會促進CuO-NPs釋放出Cu2+。但是,當萊茵衣藻濃度進一步增加后,一方面會由于藻細胞表面的EPS對CuO-NPs顆粒產生包覆現象而阻礙Cu2+的溶出,另一方面也會由于藻細胞及有機分泌物的橋聯作用促進CuO-NPs發生異團聚而形成大顆粒或者沉降與水底,從而抑制了Cu2+離子的溶出效率[34]。
3 結 論
a. 萊茵衣藻對水環境中低濃度的CuO-NPs表現出較強的吸附力,藻細胞與CuO-NPs之間結合力較強,且CuO-NPs被微藻吸附到細胞表面后不易于重新釋放到水環境中。
b. 萊茵衣藻細胞對CuO-NPs的吸附是單層覆蓋和多層吸附共存的過程,吸附類型包括物理吸附和化學吸附。
c. 萊茵衣藻對Cu2+離子的溶出影響顯著,低濃度的萊茵衣藻促進Cu2+離子溶出,而高濃度的萊茵衣藻抑制Cu2+離子溶出。同時,萊茵衣藻可促進CuO-NPs的團聚沉降,減少水中CuO-NPs的質量濃度,降低其對水生生物的毒性。

