羊乳中牛乳成分的環介導等溫擴增高分辨熔解檢測
張文娟,澹臺瑋,李敏康,蔡露陽,徐秦峰
(陜西科技大學 食品與生物工程學院,國家羊乳制品加工技術研發專業中心,陜西 西安,710021)
乳是兒童和成年人健康生長所需的各種營養物質的來源之一[1]。由于乳制品需求的增加和供應鏈的全球化,某些供應商為追求經濟利益,常在乳制品中摻入一些不易區分、同源性更高的動物源性產品和原料來降低成本,其中最常見的摻假形式是在高值羊乳中摻入低值牛乳[2-3]。這種摻假行為不僅會影響行業健康發展,也更容易增加過敏的風險[4-7]。因此,檢測此類產品的摻假情況對核實食品標簽成分,保護消費者的合法權益等具有重要意義。
鑒別牛、羊乳品質有蛋白水平、脂肪水平和核酸水平上的方法[8],相比而言,核酸分子水平上的檢測穩定性更高[9],且DNA具有很強的種屬特異性,使其被越來越多地用于乳制品的檢測中。已有的核酸水平上的檢測方法有聚合酶鏈式反應(polymerase chain reaction,PCR)[10-11]、聚合酶鏈式反應-高分辨率熔解曲線(PCR-high resolution melting,PCR-HRM)[12-14]、單重實時環介導等溫擴增(loop-mediated isothermal amplification,LAMP)技術[15]等。常規的PCR技術,依賴于昂貴的熱循環儀器,而LAMP技術只需恒溫水浴鍋,但單重LAMP技術在檢測多個靶標時需要進行大量繁瑣、重復性的工作,難以滿足當今用戶需求。隨著核酸分子技術的快速發展,在食品及乳制品的檢測中多重檢測可滿足一次反應多靶標擴增,快速對現場大量的復雜樣品及未知樣品做出驗證。KIM等[16]基于熒光探針法建立了雙重實時LAMP技術對牛奶和羊奶進行檢測,但是不同的靶標需要合成不同的熒光標記探針,使得成本增高。
HRM是基于飽和熒光染料發展起來的一種新型PCR檢測技術,在普通熔解曲線的基礎上依據更小的熔解溫度差異鑒別不同的目的基因,并依靠特殊儀器獲得更高密度數據值。GANOPOULOS[17]使用PCR-HRM技術檢測出羊乳奶酪中的牛乳成分,為該技術在乳及乳制品的摻假檢測應用中奠定了基礎。本研究針對奶牛和奶山羊線粒體DNA設計LAMP特異性引物,通過對不同引物比例及反應溫度的優化,利用HRM技術對Tm值差異較小的牛羊乳擴增產物進行準確有效區分,實現了羊乳中摻入牛乳成分的檢測。
1 材料與試劑
1.1 實驗材料
新鮮牛乳樣品采集于陜西省西安市未央區某奶牛場,新鮮羊乳樣品采集于未央區某市場農戶處,樣品存于-20 ℃冰箱備用;其他用于驗證引物特異性DNA(雞、豬、馬、兔、鴨、狗和貓)樣本購買于四川華漢三創有限公司;其他不同類型全脂羊奶產品、低脂羊奶產品、羊奶片等實際樣品隨機購買于大型商場。
1.2 主要試劑和儀器
1.2.1 試劑
磁珠法血液基因組DNA提取試劑盒,天根有限公司;甜菜堿,Sigma公司;dNTP混合液、Bst 2.0 Warm Star DNA聚合酶和MgSO4等,NEB公司。
1.2.2 儀器
熒光定量PCR儀(MyGo Pro),IT-IS Life Science Ltd;實時熒光定量PCR儀(Qtower 2.2),德國耶拿公司;電熱恒溫水槽(DK-8D),上海精宏實驗設備有限公司;高速冷凍離心機(5424R),Eppendorf 有限公司;超微量分光光度計(Q6000),美國Quawell。
2 實驗方法
2.1 DNA的提取
按照磁珠法血液基因組DNA提取試劑盒說明書對上述新鮮乳品或羊乳制品中的DNA進行提取。使用超微量核酸定量儀測定鮮牛乳、鮮羊乳DNA質量濃度,將溶液稀釋到7 ng/μL,-20 ℃保存備用。
2.科學制定實施方案。2017年,山西農墾依據中央政策,結合調查摸底情況和我省實際,多次征求各市農墾主管部門及26個農場和省編辦的意見,由省農業廳、財政廳、教育廳、衛生和計劃委員會、民政廳、中國人民銀行太原中心支行共同研究起草了《山西省農墾國有農場辦社會職能改革實施方案》,進一步明確了工作原則、改革內容、實施步驟及責任分工。之后,有改革任務的各市縣也分別制定了符合自身實際的辦社會職能改革實施方案。
2.2 LAMP引物設計及篩選
參考SN/T 4419.21—2016[18]標準及文獻報道的引物序列[19],以牛、羊線粒體保守序列為靶基因,并在PrimerExplorer 5網站進行多次篩選比對來合成LAMP特異性引物,如表1所示。LAMP引物由生工生物(上海)有限公司合成并經高效液相色譜純化。

表1 實驗中所用的LAMP引物序列Table 1 Primers pairs used in LAMP for goat and bo ine
2.3 LAMP-HRM反應體系建立及條件優化
LAMP反應體系的組成及濃度如下:1×Thermol Pol緩沖液、1.4 mmol/L dNTPs、0.8 mol/L甜菜堿、4 mmol/L MgSO4、外引物F3和B3各0.2 μmol/L、內引物FIP和BIP各1.6 μmol/L、8 U DNA聚合酶0.4 μL、20×E a Green熒光染料0.25 μL和DNA模板7 ng,總反應體系為10 μL。將混合體系置于實時熒光PCR儀中64 ℃反應45 min,65~97 ℃進行熔解分析。
根據上述LAMP反應的實驗結果,通過改變反應溫度及引物比例對LAMP反應條件進行優化,以確定最佳的反應條件。LAMP擴增所用的酶最適反應溫度為60~68 ℃,當反應溫度降到60 ℃以下時,聚合酶的酶活力減弱,擴增效率降低,因此選擇60、61、62、63、64和65 ℃ 6個溫度對反應體系進行優化。改變奶牛和奶山羊的引物用量體積比例,即0.1∶0.2、0.15∶0.2、0.2∶0.2、0.1∶0.3、0.1∶0.4,以挑選出最適引物濃度比。
2.4 LAMP-HRM反應特異性、靈敏度和牛羊乳不同混合比例檢測
按照LAMP體系配制反應液,加入質量濃度均為7 ng/μL的不同模板DNA,在最適反應溫度下進行擴增,分析鑒定擴增曲線及熔解曲線,以驗證LAMP引物的特異性。
將牛乳和羊乳提取的DNA原液等比例混合,再進行10倍質量濃度梯度稀釋,即反應體系中DNA質量濃度分別為7、0.7、0.07、0.007和0.000 7 ng/μL,每個質量濃度梯度均取1.2 μL為反應模板,進行LAMP檢測。通過對熔解曲線的Tm值進行分析來檢測方法的靈敏度。
取7 ng/μL的羊乳DNA為原液,分別摻入不同體積比例的牛乳DNA,體積比例依次為100%、80%、50%、10%、5%、1%、0.1%和0%,取1.2 μL上述混合DNA作為模板進行LAMP擴增,分析此方式的檢測限。在羊乳實際樣品中混合不同體積比例的牛乳,混合體積比例為100%、50%、15%、5%、1%、0.5%和0%,再進行DNA提取,確定此種混合方式的檢測限。
2.5 實際樣品檢測
對市售的8種乳制品進行鑒定,通過對熔解曲線進行分析來評價LAMP-HRM方法的實際應用能力,與已建立的實時PCR方法進行比較,驗證其方法的準確性。
3 結果與分析
3.1 LAMP-HRM方法可行性
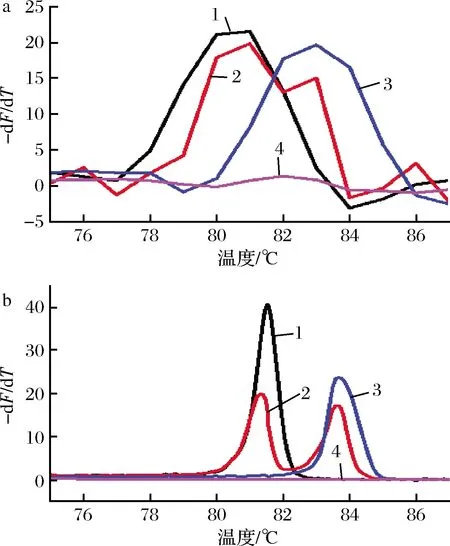
a-傳統熔解峰; b-高分辨熔解峰1-牛;2-牛+羊;3-羊;4-NTC圖1 LAMP-HRM可行性的驗證Fig.1 erification of LAMP-HRM feasibility注:動物名稱代表各自DNA;NTC代表on template control,無DNA陰性性對照(下同)
3.2 LAMP-HRM反應體系的優化
3.2.1 反應溫度優化
為了消除由于溫度影響而產生的競爭性擴增,選取牛羊DNA擴增子熔解峰面積相近時的反應溫度作為最佳擴增溫度,此時2種擴增子含量接近,擴增效率相當[21]。結果如圖2-a所示,在60~65 ℃溫度范圍內,即使1 ℃的溫度變化,牛、羊源性DNA成分的熔解峰也有較大差距,說明溫度對雙重擴增影響較大。觀察到在63 ℃時,2種熔解峰面積接近,因此選擇63 ℃作為后續檢測的最佳反應溫度。

a-反應溫度優化; b-引物濃度比優化圖2 LAMP-HRM反應體系的優化Fig.2 Optimization of LAMP-HRM reaction system
3.2.2 引物濃度比優化
在多重LAMP反應中,由于不同靶標的引物對之間存在競爭關系而產生優勢擴增,容易導致其靶目標序列擴增效率的不同[22]。為了使擴增效率一致,減少不同引物對之間的相互競爭,從而更清楚地區分2種DNA。如圖2-b所示,選擇引物濃度比為0.15∶0.2的一組,該比例條件下等溫擴增效率相對較高,更適合對乳制品中牛、羊源性成分同時進行檢測。
3.3 LAMP-HRM體系的特異性實驗、靈敏度檢測和牛羊乳不同混合比例檢測
3.3.1 特異性檢測
利用建立的雙重LAMP-HRM方法對牛、羊及其他7種動物進行LAMP擴增并進行熔解分析。由圖3-a可知,含有奶牛、奶山羊的反應體系均有單峰出現,奶牛和奶山羊的混合物也出現雙峰,而其他動物DNA模板均未出現熔解現象,表明建立的雙重LAMP-HRM方法具有較好的特異性,且設計的引物特異性也較好。
3.3.2 靈敏度檢測
將提取出的牛奶和羊乳線粒體 DNA混合物經逐級稀釋后,如圖3-b結果所示,建立的LAMP-HRM方法能夠檢測到0.7 pg/μL的牛和羊DNA混合物,表明該方法具有較高的檢測靈敏度。

a-特異性; b-靈敏度圖3 LAMP-HRM反應體系的特異性和靈敏度Fig.3 Specificity and sensiti ity for LAMP-HRM reaction system
3.3.3 牛羊乳不同混合比例檢測
將牛乳和羊乳DNA不同混合比例樣品按照最優反應體系進行LAMP-HRM檢測,檢測結果如圖4-a所示。當摻入0.1%牛乳DNA時,該反應體系內仍可觀察到清晰的熔解信號。盡管1%的牛乳熔解峰值高于5%,但更進一步發現,牛羊乳峰高比值與相應的混合比例呈現一定的相關性。因此可以確定牛羊乳DNA混合的檢出限為0.1%。為了進一步驗證LAMP-HRM方法對實際樣品的檢測能力,在羊乳實際樣品中混合不同比例的牛乳,再進行DNA提取,結果如圖4-b,最低檢出限為0.5%,這可能是因為乳本身體系的復雜性和乳中細胞分布的不均勻性,混合乳之后再進行DNA提取可能會造成提取不完全等。這2種方式混合比例的檢測均表明LAMP-HRM方法靈敏度較高。
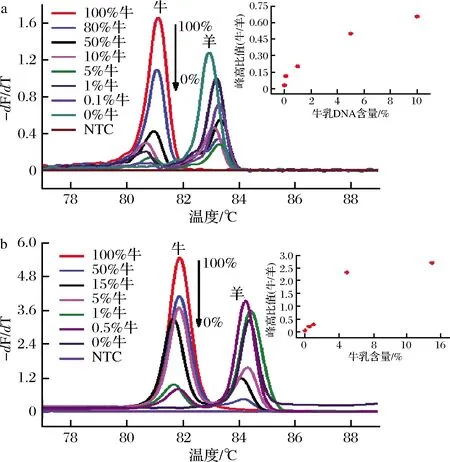
a-牛羊乳DNA混合比例; b-牛羊乳實際樣品混合比例圖4 牛羊乳不同混合比例的LAMP-HRM檢測Fig.4 LAMP-HRM detection of different cow’s milk adulterated in goat’s milk注:圖a和b中插圖為各混合比例牛羊乳峰高比值相關性
3.4 市售樣品的應用性檢測
牛源性成分為羊乳品中最為常見的摻假成分。采用上述建立的雙重LAMP-HRM方法對超市里銷售的全脂奶產品、低脂奶產品、嬰幼兒配方奶粉等8個商業產品進行了檢測分析,并與實時PCR技術檢測所得的數據進行比較,2種方法的檢測結果見表2。結果表明,在分析的8種商業奶制品中,對于商品標簽顯示含有100%的4個羊乳樣品,其中僅2個樣品(3、6)顯示與標識符合,4、5號樣品則摻入了部分或全部的奶牛乳成分,與標簽標識不符;對于配方羊奶粉,國家允許添加牛乳清粉,樣品8、9、10均檢測出牛源性成分,與標簽標示相符。實時PCR技術檢測顯示,其檢測結果與LAMP-HRM反應相比,結果完全一致,表明了LAMP-HRM檢測方法在實際樣品應用中的高準確性,可為大規模的牛羊乳樣品初篩提供一種技術支持。
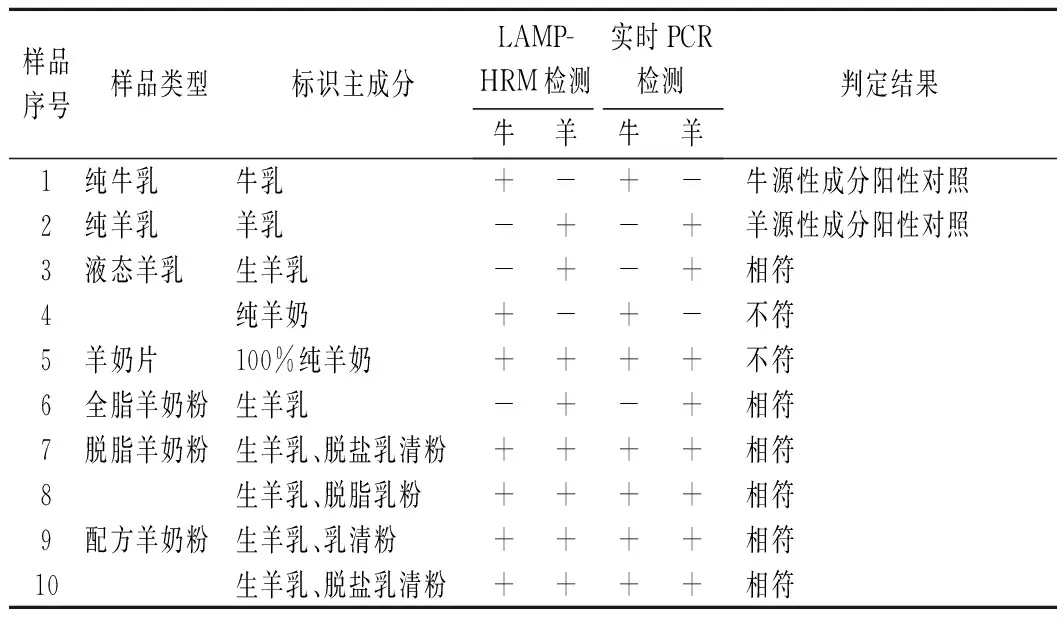
表2 LAMP-HRM反應體系對市售羊乳制品的應用性檢測Table 2 Detection result of LAMP-HRM reaction system in goat milk products
4 結論
本研究將雙重LAMP擴增技術與HRM技術相結合,針對奶牛、山羊分別設計了4條特異性引物,通過優化反應條件,利用不同靶標的Tm值差異對2種目標基因進行同時區分,建立了羊乳中牛乳成分的雙重實時LAMP-HRM技術。結果表明,所建立的方法特異性好,當體系中存在其中一種或兩種目標物時都可將其檢出,且對其他物種沒有交叉反應及假陽性現象的發生,對牛羊混合DNA的檢測靈敏度可達0.7 pg/μL,并可用于不同市售樣品的檢測,適用于羊乳制品中摻入牛乳成分的快速檢測。與PCR-HRM技術相比,該方法不需要復雜的熱循環控溫儀器,而且不需要針對奶牛、奶山羊源性成分單獨進行檢測、鑒別,在進一步節省時間的同時也提高了檢測效率,降低了檢測成本,適用于大規模樣品的初篩。值得注意的是,多重LAMP-HRM檢測方法的建立與優化,主要是在具有HRM檢測能力的實時PCR儀器上完成,近年來發展的便攜式恒溫LAMP檢測儀器已經具備了很高的溫度分辨能力,也能夠滿足該方法應用于現場快速檢測的需要。

