不同病原菌化膿性腦膜炎患兒的臨床特點對比分析
陳志卿 周 丹 林芳芳
福建省婦幼保健院新生兒科,福建福州 350001
新生兒化膿性腦膜炎(neonatal purulent meningitis,NPM)是指新生兒化膿性細菌(出生至28 d)引起的中樞性感染,這是新生兒期的一種重要疾病,具有高發病率、高殘疾率和高死亡率等特點[1]。盡管發達國家的死亡率已大大降低,但長期并發癥如殘留癲癇、認知障礙、聽力損失、視力障礙和痙攣癱瘓仍然是引起人們關注的主要原因[2]。不同地區、甚至同一地區不同時期NPM的細菌流行譜可能不同。筆者對過去3年在本院新生兒救護中心收治的NPM的臨床表現、相關實驗室檢查、病原體分布和耐藥細菌分析進行了回顧性研究,旨在了解本地區不同病原菌的NPM的臨床特征,使抗生素應用更加合理有效,為臨床經驗性治療NPM 提供依據。
1 資料與方法
1.1 一般資料
回顧性分析2014年1月1日~2016年12月31日福建省婦幼保健院新生兒科收治的符合入選條件的化膿性腦膜炎患兒的病例資料。本研究符合《赫爾辛基宣言》要求。納入標準:①具有新生兒感染和NPM臨床表現;②腦脊液(cerebrospinal fluid,CSF)常規、生化檢查符合化膿性腦膜炎腦脊液改變(白細胞計數>20×106/L,蛋白含量早產兒>1.5 g/L 和足月兒>1.0 g/L,葡萄糖濃度低于外周血血糖的50%,足月兒<1.7 mmol/L 或早產兒<1.1 mmol/L);③血培養或者腦脊液培養檢出病原菌,并除外可能污染的病原菌[3-5];④診斷日齡≤28 d。排除標準:①合并先天性神經系統發育畸形如脊柱裂、腦脊膜膨出以及先天性遺傳代謝病;②住院時間短,診斷未明確前自動出院,或者資料不完整。根據血培養或CSF培養結果,將研究對象分為三組,具體如下。①無乳鏈球菌(Streptococcus agalactiae,GBS)組15例:培養為GBS;②其他細菌組14例:培養為GBS 以外的細菌;③病原菌不明組105例:血培養和腦脊液培養均陰性組。研究期間納入符合標準的NPM患兒總共134例,其中GBS組15例,其他細菌組14例,病原菌不明組105例。134例NPM患兒中,男86例,女48例;胎齡28~41周,平均(38.04±2.73) 周;早產兒24例,足月兒110例;出生體重1.10~4.32 kg,平均(3.08±0.61)kg;入院日齡1~28 d,平均(12.64±8.27)d;住院時間為4~70 d,平均(23.42±11.05)d。GBS組、其他細菌組及病原菌不明組的性別、出生體重、胎齡、發病日齡、住院時間比較,差異無統計學意義(P>0.05)(表1),具有可比性。
1.2 研究方法
收集符合標準的NPM患兒的資料,比較各組的臨床資料,包括性別、出生體重、出生胎齡、發病日齡、住院時間、臨床表現、并發癥、血液和腦脊液培養結果、腦脊液檢查結果、發病時血常規結果、抗菌藥物使用、總抗菌藥物療程及臨床轉歸情況。
細菌性腦膜炎早發型是指出生后7 d 內獲得感染,8~28 d 獲得感染為晚發型[3];并發癥(硬膜下積液、腦室膜炎、腦膿腫、腦積水)的診斷[3]主要根據臨床表現及頭顱MRI 異常結果。臨床轉歸中,治愈是指療程足夠,臨床癥狀及體征消失,血液和CSF 陰性,CSF 白細胞數、葡萄糖、蛋白濃度均恢復至正常水平;好轉是指療程足夠,臨床癥狀、體征消失,血液和CSF培養陰性,CSF 白細胞和血液感染指標恢復正常,僅蛋白和(或)葡萄糖水平尚未恢復正常。足療程是指革蘭陽性菌感染至少2周,革蘭陰性菌感染至少3周。
1.3 統計學方法
采用SPSS 19.0 統計軟件進行數據分析,計量資料中連續變量呈正態分布者用均數±標準差(±s)表示,采用單因素方差分析,兩兩比較采用t 檢驗;非正態分布者采用Kruskal Wallis H 秩和檢驗。計數資料以頻數或百分率表示,組間比較采用χ2檢驗或Fisher 精確概率法檢驗,以P<0.05 為差異有統計學意義。
2 結果
2.1 三組臨床表現的比較
三組均以發熱、呼吸急促、黃疸反復為主要臨床表現,神經系統多表現為抽搐、意識障礙(激惹、嗜睡)、前囟緊張、肌張力和原始反射異常,三組臨床特征比較,差異無統計學意義(P>0.05)(表2)。
2.2 三組外周血常規、CSF常規結果比較
三組外周血白細胞計數、血小板比較,差異無統計學意義(P>0.05);69例(51.49%)患兒C反應蛋白(C-reactive protein,CRP)>8 mg/L。GBS組、其他細菌組的CRP 高于病原菌不明組,差異有統計學意義(P<0.05)。其他細菌組、GBS組的腦脊液白細胞計數高于病原菌不明組,GBS組的腦脊液多核細胞百分比高于其他細菌組、病原菌不明組,差異均有統計學意義(P<0.05)。三組CSF 的葡萄糖、氯化物、蛋白、乳酸脫氫酶水平比較,差異無統計學意義(P>0.05)(表3)。
表1 三組患兒一般資料的比較(±s)

表1 三組患兒一般資料的比較(±s)
組別 出生體重(kg) 胎齡(周) 發病日齡(d) 住院時間(d)性別(例)男女GBS組(n=15)其他細菌組(n=14)病原菌不明組(n=105)χ2/F/H值P值6 10 70 943 5 4.42 0.11 3.30±0.33 2.72±0.74 3.10±0.61 0.85 0.741 39.13±1.06 36.29±3.95 38.11±2.62 0.50 0.922 10.33±5.41 12.29±7.47 13.02±8.69 1.30 0.523 31.47±17.58 23.00±7.07 22.32±9.89 4.21 0.122
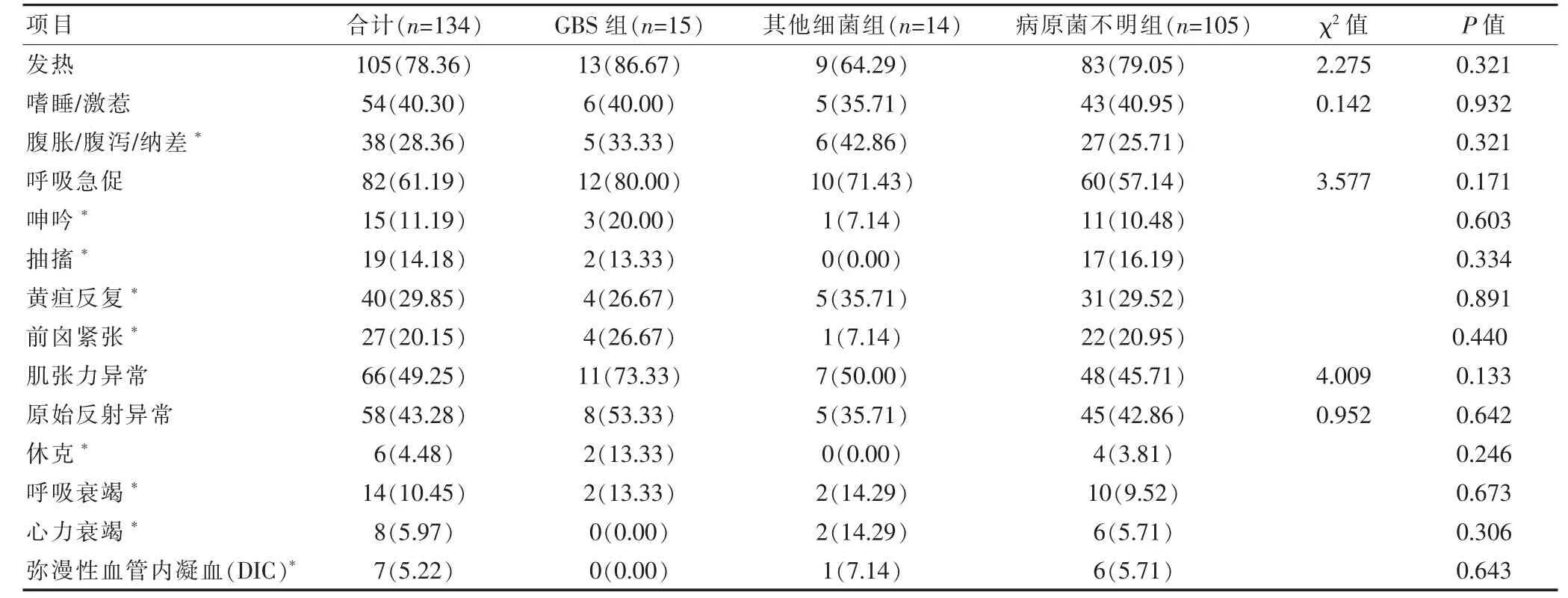
表2 三組NPM 臨床特征比較[n(%)]
CSF蛋白數超過1.88 g/L 有30例,其中出現并發癥13例。GBS組5例(1.90~3.78 g/L,1例并發硬膜下積液),其他細菌組4例(3.29~12.93 g/L,并發硬膜下積液1例,腦室膜炎、硬膜下積液并腦積水1例,腦積水1例),不明原因組21例(1.95~10.65 g/L,并發腦積水5例,腦積水并腦軟化2例,硬膜下積液1例,硬膜下積液并腦軟化1例)。
2.3 血培養、CSF培養及藥敏情況
血培養陽性26例(陽性率19.40%),其中GBS 14例(53.84%),大腸埃希菌6例(23.08%),肺炎克雷伯菌3例,人葡萄球菌、表皮葡萄球菌、解沒食子酸鏈球菌各1例。CSF培養陽性7例(5.22%),其中GBS 3例,大腸埃希菌2例,解沒食子酸鏈球菌、糞場球菌各1例。血液和CSF培養均陽性(均為同一種細菌)共3例,分別為GBS、大腸埃希菌和解沒食子酸鏈球菌各1例。藥敏結果顯示,GBS 對多西環素、克林霉素耐藥性達100%,對紅霉素、阿奇霉素耐藥性達50%以上,對青霉素、氨芐青霉素、阿莫西林、頭孢美唑、萬古霉素敏感。大腸埃希菌對氨芐青霉素、阿莫西林、頭孢一代、頭孢二代耐藥性高,主要對頭孢他啶、頭孢哌酮舒巴坦、頭孢四代、哌拉西林/他唑巴坦、碳氫酶烯類敏感性高。
2.4 治療及轉歸
因患兒發病時常以敗血癥為首發表現,入院時存在明顯中毒癥狀,病程初期一般聯用抗生素,再根據血培養或CSF 細菌培養報告、臨床表現及實驗室檢查結果調整抗生素。入院一般選用的抗生素為青霉素或美洛西林舒巴坦聯合頭孢三代抗生素,再根據臨床表現、輔助檢查報告及治療效果調整為哌拉西林他唑巴坦、美羅培南、利奈唑胺、萬古霉素。有13例使用激素。治愈83例,好轉44例,2例并發硬膜下積液轉神經外科進一步治療,5例因嚴重合并癥/并發癥放棄治療,其中1例CSF培養為GBS,合并顱內出血、房間隔缺損;1例血、CSF培養均為大腸埃希菌,合并壞死性小腸結腸炎、DIC,出院當天死亡;1例并發腦軟

表3 三組NPM 實驗室檢查結果的比較[M(Q1,Q3)]
化、腦積水,2例并發硬膜下積液、腦積水、腦室膜炎,出院不久即死亡。并發癥15例(11.2%),其中GBS組并發硬膜下積液1例;其他細菌組中,并發硬膜下積液1例(解沒食子酸鏈球菌),腦室膜炎、硬膜下積液并腦積水1例(大腸埃希菌),腦積水1例(大腸埃希菌);陰性組中,并發腦積水6例,硬膜下積液2例,腦積水并腦軟化2例,硬膜下積液并腦軟化1例。
3 討論
化膿性腦膜炎是由于細菌入侵、細菌產物釋放以及宿主在體液和細胞免疫中的局部免疫反應而引起的腦膜感染。新生兒時期細菌性腦膜炎的發病率要高于其他年齡段[6]。本病病死率在不同國家及醫院報道范圍較大,據新生兒細菌性腦膜炎多中心研究協作組報道,納入的838例細菌性腦膜炎新生兒中,共死亡13例,病死率為1.6%[7]。本研究納入134例,共死亡4例,病死率為3.0%,低于印度報道的11.2%[8]。
新生兒腦膜炎的臨床表現可能是隱匿的、微妙的和非特異性的,通常與敗血癥中所見相似,溫度不穩定,呼吸窘迫,黃疸和呼吸暫停。中樞神經系統癥狀如嗜睡、驚厥、嘔吐、煩躁不安、前囟飽滿和頸項強直在晚期敗血癥中更常見[9]。本研究中,化膿性腦膜炎以發熱、呼吸急促、黃疸反復為主要臨床表現,發熱是最常見的癥狀,占78.36%,與相關文獻報道[7,10]類似。神經系統多表現為抽搐、意識障礙(激惹、嗜睡)、前囟緊張、肌張力和原始反射異常,這些癥狀、體征并非特異性,在不同病原體感染的細菌性腦膜炎中的表現無明顯區別。
腦膜炎的診斷仍然具有挑戰性,因為最初的癥狀通常很微妙,并且與敗血癥重疊[11]。因此,對化膿性腦膜炎的診斷和治療進行實驗室檢測和病原體培養具有重要的指導意義。通過腰穿檢查腦脊液是確認腦膜炎的唯一方法[9,12],CSF培養是診斷化膿性腦膜炎的金標準,對NPM 預后預測也有較好的價值[13]。本研究化膿性腦膜炎血培養陽性率為19.40%,低于國外報道的31%[14],但與劉夢迪等[10]的報道一致;CSF培養陽性率僅為5.22%,低于文獻報道中的22.5%[15],考慮原因如下。①NPM 臨床表現不典型,與敗血癥等感染相似,早期診斷困難,并且目前國內沒有形成常規對所有懷疑新生兒敗血癥的患兒進行腰穿腦脊液檢查,常在抗生素應用后出現神經系統異常表現后才進行腦脊液檢測;②腦脊液到實驗室的運輸延遲和腦脊液中細菌密度低,尤其是在早發型新生兒腦膜炎中,導致CSF 細菌檢出率較低。此外,CSF常規及生化也是化膿性腦膜炎的診斷依據。本研究顯示,GBS感染或其他細菌感染(如大腸埃希菌感染),CSF 白細胞數顯著增加,GBS 化膿性腦膜炎多核細胞百分比也會增高。有研究表明,預測不良結局的最佳臨界值是CSF蛋白濃度為1.88 g/L(敏感性70.8%,特異性86.2%)[13]。本研究結果顯示,腦脊液蛋白>1.88 g/L 有30例,13例出現腦積水、硬膜下積液、腦軟化等并發癥,其中4例死亡,預后不良的發生率高。因此,CSF蛋白>1.88 g/L,可預測新生兒腦膜炎的不良預后。本研究結果還顯示,51.49%化膿性腦膜炎患兒外周血CRP 升高,且GBS組、其他細菌組的CRP 較病原菌不明組顯著增高,GBS組的CRP 中位數為51.80 mg/L。眾所周知,CRP 是一種非特異性炎癥指標,在早期細菌感染中顯著增加,在感染控制后迅速下降,提示在化膿性腦膜炎的診斷中應注意CRP 的檢測。
目前的文獻報道,NPM的病原菌分布存在地區性差異,不同國家地區及不同年代有所不同,在每家醫院都不一致[6,13]。GBS 是新生兒敗血癥和腦膜炎的主要原因[16]。Whittaker 等[17]報道,早發型腦膜炎中發現的最常見細菌是GBS、大腸埃希菌、單核細胞增生性李斯特菌和革蘭陰性腸細菌。我國華南部分地區細菌性腦膜炎培養陽性前4位細菌依次為GBS、大腸埃希菌、凝固酶陰性葡萄球菌和肺炎克雷伯菌[7]。本研究中,最常見的細菌是GBS、大腸埃希菌、肺炎克雷伯菌,與Zhao 等[18]的報道不同。許多發達國家,例如美國、加拿大和歐洲大部分地區已經采取了GBS 預防策略,該策略基于對孕婦進行GBS攜帶的普查,并在陽性時提供產前抗生素的預防[19],盡管產時抗生素可以預防早發性GBS的發生,但對晚發性疾病無效[20]。
考慮到可能導致細菌性腦膜炎的病原體數量眾多,對于可能患有腦膜炎的新生兒,靜脈注射抗生素的最初選擇必須同時覆蓋革蘭陽性和革蘭陰性菌。適當的抗生素治療是管理的關鍵方面。在根據腦脊液分析結果進行微生物學診斷之前,應首先根據經驗選擇抗生素,并且應基于發病年齡、可能的病原體和抗生素敏感性。青霉素和頭孢菌素可有效對抗GBS、大腸埃希菌、肺炎克雷伯菌和單核細胞增生李斯特菌,這是發達國家新生兒中所有常見的腦膜病原體(單核細胞增生李斯特菌除外)[2]。本研究培養結果為革蘭陰性桿菌者的哌拉西林他唑巴坦和美羅培南使用率較高;培養結果為革蘭陽性球菌者選用青霉素、萬古霉素、利奈唑胺。對于培養陰性者,選擇三代頭孢、青霉素和哌拉西林他唑巴坦。美羅培南具有良好的CSF 滲透性,且對革蘭陽性和革蘭陰性細菌具有廣泛的活性,對大腸桿菌、克雷伯菌屬、腸桿菌屬具有殺菌作用[21],可能在改善結局方面發揮作用,對于大腸埃希菌、肺炎克雷伯桿菌感染的病情嚴重患兒應優先選擇美羅培南。
綜上所述,NPM 臨床表現缺乏特異性,發熱為最常見癥狀;病原菌以GBS、大腸埃希菌為主;CRP 明顯升高,腦脊液白細胞數及多核細胞百分比升高者應考慮GBS感染。本研究存在一定局限性,為單中心研究,個別病情較危重患兒未能及時行腰椎穿刺檢查,未能納入研究,影響了對NPM 病死率的評估;對于存在并發癥病例也未能進一步隨訪觀察其遠期結局,希望在下一步的前瞻性多中心研究中開展。

