青稞蛋白質的微波輔助提取工藝及性質研究
霍金杰,肖志剛,王娜,單秀峰,王依凡,王可心,段慶松,高育哲,*
(1.沈陽師范大學糧食學院,遼寧沈陽110034;2.沈陽師范大學實驗教學中心,遼寧沈陽110034)
青稞是一種重要的高原谷類作物,主要生長在我國西藏、青海、四川、云南等地區[1],具有高蛋白、耐高寒、耐貧瘠的優良特性,另外還由高纖維、高維生素、低脂肪、低糖等營養成分構成[2-4],據分析,青稞的粗蛋白含量為7.68%~17.52%,高于一般的谷物,但是略低于小麥和燕麥。青稞蛋白質主要包括谷蛋白(43.83%)和醇溶蛋白(18.25%)[5]。據證明,青稞蛋白質含有18種氨基酸,包括8種必需氨基酸[6],尤其富含大米和小麥等谷物蛋白質中缺乏的賴氨酸,其含量達0.36 g/100 g[7],是一種優質的植物蛋白質資源[8]。青稞還具有生長期短的優點,病蟲害的發生很少,是高原地區真正綠色無污染的食品[9]。
國內外對于青稞蛋白質提取常用的方法有物理法、化學法和生物酶法[10],堿溶酸沉法是提取植物蛋白最普遍最常用的方法[11]。微波輔助是物理方法,避免了化學試劑的引入,綠色安全無污染并且不改變蛋白質的性質。
本文以青稞米為原料,采用微波輔助堿溶酸沉法提高青稞蛋白質的提取率,通過單因素和響應面試驗優化提取的工藝條件,同時分析并比較微波輔助提取青稞蛋白的功能性質并對其結構進行表征。
1 材料與方法
1.1 原料與試劑
青稞米:寧夏五朵梅食品股份有限公司;鹽酸(分析純)、氫氧化鈉(分析純)、濃硫酸(分析純):沈陽化學試劑廠;硫酸銅(分析純):天津市大茂化學試劑廠;硼酸:天津博迪化工股份有限公司;硫酸鉀(分析純):天津市北聯精細化學品開發有限公司;十二烷基硫酸鈉:天津市恒興化學試劑有限公司;食用大豆油:遼寧省營口市金龍魚精煉一級大豆油。
1.2 儀器與設備
常壓微波合成 (MAS-IIPLUS):上海新儀微波化學科技有限公司;數顯電子恒溫水浴鍋(HH-6):常州國華電器有限公司;低速離心機(LXJ-IIB):上海安亭科學儀器廠;低速離心機(LD5-2A):北京醫用離心機廠;高速均質機(IP 21):IKA Works Guangzhou;凱氏定氮儀(SKD-200)、紅外智能消化爐(SKD-20S2):上海沛歐分析儀器有限公司;數顯pH計(pHS-25):上海儀電科學儀器股份有限公司;紫外可見分光光度計(722型):上海佑科儀器儀表有限公司;分析天平(ESJ12-4B):沈陽龍騰電子有限公司;粉碎機(JFSD-100):上海嘉定糧油儀器有限公司;高速冷凍離心機(X-12R):美國Beckman公司;冷凍干燥機(Scientz-12N):寧波新芝生物科技股份有限公司;冰箱(BCD-198):博西華家用電器有限公司。
1.3 青稞蛋白質的提取及優化方法
1.3.1 青稞蛋白質提取的工藝流程
稱取100 g青稞米→粉碎→過篩→取青稞粉按1∶20(g/mL)加水混勻→微波輔助→調pH值至堿性→恒溫水浴→離心→收集上清液→調pH值至酸性→恒溫水浴→離心→去上清液→取底部沉淀物。
1.3.2 蛋白質含量的測定
參照GB 5009.5-2016《食品安全國家標準食品中蛋白質的測定》中的方法并加以修改,蛋白質的含量計算公式如下:

式中:X為試樣中的蛋白質含量,g/100 g;c為鹽酸標準液的濃度,mol/L;F為氮換算蛋白質的系數,5.83;V1為試液消耗鹽酸標準滴定液的體積,mL;V2為試劑空白消耗鹽酸標準滴定液的體積,mL;m為試樣的質量,g。
1.3.3 微波輔助提取青稞蛋白質的單因素試驗
以蛋白質提取率為測定指標,控制料液比1∶20(g/mL),考察在微波過程中,青稞蛋白質的溶液pH值、微波時間、微波功率、微波溫度對青稞蛋白質提取率的影響。
1.3.4 響應面優化試驗
以蛋白質提取率為響應值,基于單因素試驗選擇微波溫度(A)、微波時間(B)、微波功率(C)、青稞溶液的pH值(D)進行四因素三水平的試驗,優化微波輔助堿溶酸沉法的提取條件。利用Design-Export 8.0對試驗數據進行回歸分析,得到以青稞蛋白質提取率為響應值的回歸模型,對提取率進行預測分析,對模型進行方差顯著性檢驗分析,確定各因素對杏仁蛋白質提取率的影響結果,分析各因素間交互作用,繪制影響因素的響應面圖。試驗因素水平見表1。

表1 因素水平表Table 1 Factors and levels table
1.4 青稞蛋白質功能性質的測定
1.4.1 青稞蛋白質持水性的測定
取10 mL塑料離心管,稱重記為m1,準確稱取0.5 g蛋白質樣品于離心管中加水配置成一定濃度的樣液,調節pH值為7,在離心管中充分振蕩,室溫25℃靜置 30 min,使其充分吸水,溫度分別選取 30、40、50、60、70℃,3 000 r/min離心30 min倒去上清液,靜置10min,稱重記為m2,計算青稞蛋白的持水力(water holding capacity,WHC),以(g/g)表示。

1.4.2 青稞蛋白質吸油性的測定
取10 mL塑料離心管,稱重記為m1,準確稱取0.5 g樣品置于10 mL離心管中,加5 mL大豆油,混勻后恒溫靜置 30 min,溫度分別選取 30、40、50、60、70 ℃,3 000 r/min離心30 min,倒掉上清液,將離心管倒放在濾紙上,10 min后稱量,離心管和殘留物的總質量m2。吸油性以每克樣品吸附油的質量(g/g)表示。

1.4.3 青稞蛋白質起泡性和泡沫穩定性的測定
配置1%的蛋白質溶液20 mL,調節pH值至4.0、5.0、6.0、7.0、8.0、9.0,在高速組織攪拌機中以10 000 r/min的轉速均質1 min,迅速轉入50 mL量筒中,記錄均質停止時泡沫體積V0、30 min時泡沫體積V30,計算青稞蛋白的起泡性(foaming capacity,FC)和泡沫穩定性(foaming stability,FS)。

1.4.4 青稞蛋白質乳化性和乳化活性的測定
配置18 mL濃度為1%的蛋白質溶液,調節pH值至 4.0、5.0、6.0、7.0、8.0、9.0,加入 6 mL 的一級精煉大豆油混合,10 000 r/min均質1 min,靜置,分別在0 min和10 min時從容器底部取50 μL乳狀液于試管中,加入5 mL 0.1%的十二烷基硫酸鈉(sodium dodecyl sulfate,SDS)混勻后以0.1%SDS為空白于500 nm測吸光度,計算乳化活性(emulsification activity index,EAI)和乳化穩定性(emulsifying stability index,ESI)。

式中:T為2.302;N為稀釋倍數,100;C為蛋白質的質量濃度,g/mL;?為溶液中油的體積分數,0.25;A0為0 min乳化液的吸光度;A10為靜置10 min后乳化液的吸光度。
1.4.5 青稞蛋白質溶解性的測定
配置1%的蛋白質溶液20 mL,分別調節pH3、4、5、6、7、8和9,在30℃水浴磁力攪拌1 h,3 500 r/min離心20 min,吸取上清液1 mL定容到50 mL,500 nm下比色測其吸光度,以單位體積單位質量樣品的吸光度作為溶解指數。

式中:A為3次平行試驗測得的吸光度的平均值;W 為所稱樣品的質量,g;A1為溶解指數,(g·mL)-1。
1.5 青稞蛋白質熱特性的測定
用差式掃描量熱儀測定青稞蛋白質的變性溫度,準確稱取5 mg樣品置于鋁制鉗鍋中,密封壓蓋后進行掃描。以空鋁盒為對照,氮氣流速50 mL/min,掃描溫度從30℃到250℃,升溫速率為10℃/min。利用Universal配套軟件(V3.8,TA Inc,USA)分析處理數據。
1.6 蛋白質二級結構的測定
取適量干燥后的蛋白質樣品放入紅外光譜儀中進行分析,于紅外光譜儀中做全波段(400 cm-1~4 000 cm-1)掃描。紅外譜圖的處理:利用Origin8.5軟件進行繪圖分析。
2 結果與分析
2.1 單因素試驗結果
2.1.1 微波功率對青稞蛋白質提取率的影響
微波功率對青稞蛋白質提取率的影響見圖1。

圖1 微波功率對青稞蛋白質提取率的影響Fig.1 Effect of microwave power on extraction rate of barley protein
如圖1所示,隨著功率的升高,青稞蛋白質的提取率先升高后降低,當微波功率為450 W時,青稞蛋白質的提取率達到最高80.6%,隨著微波功率的繼續增大,青稞蛋白質的提取率降低,并且降低的幅度變大,原因可能是當微波功率較高的時候,升溫速度快,青稞粉的細胞破碎程度較大,蛋白質的溶出量較多。因此選擇微波功率450 W,進行下一步的響應面試驗。
2.1.2 微波時間對青稞蛋白質提取率的影響
微波時間對青稞蛋白質提取率的影響見圖2。

圖2 微波時間對青稞蛋白質提取率的影響Fig.2 Effect of microwave time on extraction rate of barley protein
由圖2可知,隨著微波時間的增加,青稞蛋白質的提取率呈現出先升高后降低的趨勢,在微波時間為9 min時,提取率達到了最大值74.2%,隨著微波時間的進一步加長,蛋白質的提取率反而下降。可能是因為微波時間較短時,輻射的能量不足,青稞粉的細胞破裂程度較低,溶出的蛋白質較少,隨著微波時間的增長,青稞粉的細胞破裂程度大,青稞蛋白質的溶出量逐漸增大,當微波時間逐漸大到一定程度,導致局部過熱,青稞蛋白質的提取率下降。
2.1.3 微波溫度對青稞蛋白質提取率的影響
微波溫度對青稞蛋白質提取率的影響見圖3。

圖3 微波溫度對青稞蛋白質提取率的影響Fig.3 Effect of microwave temperature on extraction rate of barley protein
由圖3可知,隨著微波溫度的升高,青稞蛋白質的提取率增大,在微波時間為40℃時,提取率最大達到72.8%,隨著微波溫度的進一步升高,蛋白質的提取率下降。原因可能是,微波溫度較低時輻射的能量不足,青稞粉的細胞破裂程度較低,溶出的蛋白質較少,隨著微波溫度的升高,蛋白質的分子構象發生改變,使蛋白質更容易從原料中溶解出來[12],青稞蛋白質的溶出量逐漸增大并且達到最大值,當微波溫度高到一定程度,細胞被破壞,青稞蛋白質的提取率下降。
2.1.4 溶液pH值對青稞蛋白質提取率的影響
溶液pH值對青稞蛋白質提取率的影響見圖4。

圖4 溶液pH值對青稞蛋白質提取率的影響Fig.4 Effect of solution pH on extraction rate of highland barley protein
由圖4可知,青稞溶液從酸性到堿性條件下,青稞蛋白質的提取率先升高后下降,pH值為7時提取率最大為74.4%,原因可能是在酸性條件下青稞溶液溶解的不完全,而在堿性環境下,各種雜質開始溶解,干擾了青稞蛋白質的純度,所以pH值為7時,青稞蛋白質的提取率最高。
2.2 響應面優化提取工藝
2.2.1 響應面試驗設計與結果
響應面試驗研究是以蛋白質提取率為響應值,自變量為溶液的pH值、微波溫度、微波時間、微波功率。根據設計的29組試驗,通過每組都進行3組平行試驗,來確保數據的精確性,結果如表2所示。

表2 Box-Behnken試驗設計以及蛋白提取率的實測值Table 2 Box-Behnken test design and the measured value of protein extraction rate

續表2 Box-Behnken試驗設計以及蛋白提取率的實測值Continue table 2 Box-Behnken test design and the measured value of protein extraction rate
2.2.2 模型擬合
通過Design Expert軟件對表2中的數據進行多元回歸擬合分析,由此得出青稞蛋白質提取率的二次項回歸方程:提取率=81.08+2.59A+2.43B+3.64C-0.62D-4.68AB-3.40AC+0.75AD-2.13BC-1.90BD-0.50CD-8.53A2-7.89B2-5.25C2-6.79D2。
2.2.3 方差分析
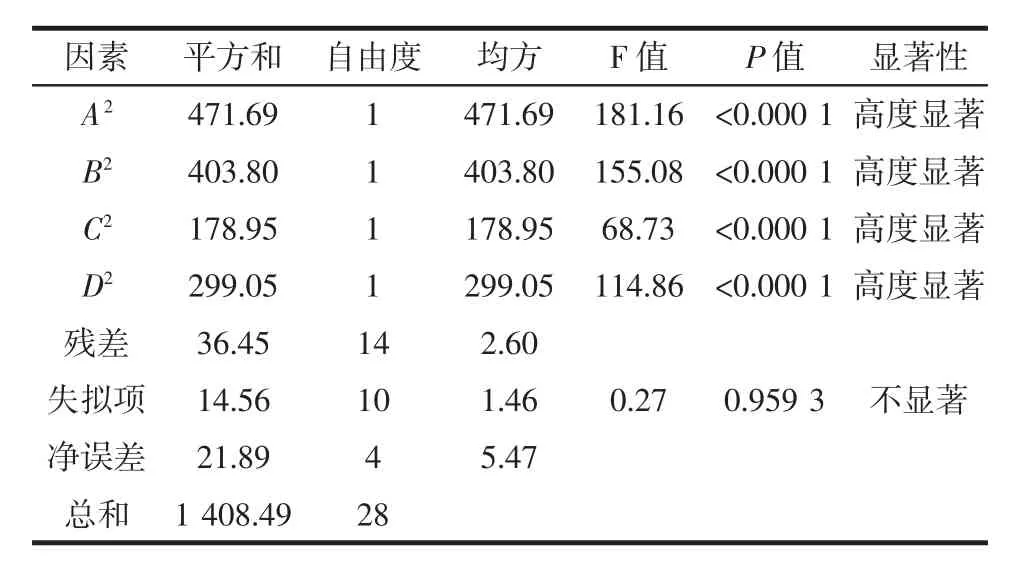
二項式回歸模型系數的顯著性詳細結果如表3所示。

表3 回歸模型的方差分析及顯著性檢驗Table 3 Vriance analysis and significance test of regression model
續表3 回歸模型的方差分析及顯著性檢驗Continue table 3 Vriance analysis and significance test of regression model
由表 3 可知,F 模型=37.64,(P<0.000 1)模型極顯著,失擬檢驗 F=0.959 3,(P>0.05)結果不顯著,說明回歸模型的擬合度較好,模型與試驗誤差小。模型相關系數(R2=0.974 1)較高,說明模型擬合程度良好,誤差較小,可以采用回歸方程替代真實試驗對不同微波輔助堿溶酸沉提取條件下的青稞蛋白質提取率進行預測。由表3可知,一次項中A、B和C均影響高度顯著;交互項中AB影響高度顯著,AC極顯著,BC和BD影響顯著;二次項中,A2、B2、C2和 D2均影響高度顯著,說明各因素之間有較為復雜的二次關系。通過軟件分析,青稞蛋白質提取率最佳條件為:微波功率465.49 W,pH 6.93,溫度40.29℃,時間9.10 min,在此條件下蛋白質提取率為81.86%。考慮到實際的可操作性,調整試驗條件為:微波功率460 W,pH 7.0,溫度40℃,時間9 min,經試驗驗證,此最優條件下蛋白質提取率為81.94%,與預測值的相對誤差在0.97%左右,證明應用該模型在實踐中進行提取效果預測是可行的。
2.2.4 兩因素間的交互作用
通過Design-Expert 8.0.6設計軟件得到響應面和等高線圖見圖5。根據響應面試驗的設計原理及分析,三維響應面圖的彎曲度越大,表示2個因素間的作用越顯著,由此能有效反映出各因素之間的交互作用對響應值提取率的影響[13]。
比較6組三維響應面圖可以看出,隨著4個因素在一定范圍的增大,青稞蛋白質的提取率先升高后降低。同時三維響應面圖彎曲度越大,表示兩因素間越顯著,等高線圖圓形表示兩因素相互作用不顯著,橢圓形表示相互作用顯著,表明相關因素對青稞蛋白質提取率的影響較大[14]。A、B和C對青稞蛋白質的提取率有顯著性影響,A和B、A和C、B和C、B和D的交互作用對青稞蛋白質的提取率也有顯著性影響,A和D、C和D對青稞蛋白質提取率的影響不顯著。

圖5 兩因素相互作用對青稞蛋白質提取率影響的響應面Fig.5 Response surface of the interaction of two factors on protein extraction rate of highland barley

圖6 溫度對青稞蛋白質吸水性的影響Fig.6 Effect of temperature on water absorption of highland barley protein
2.3 青稞蛋白質功能性質的分析
2.3.1 溫度對青稞蛋白質吸水性的影響
分別選取溫度 30、40、50、60、70 ℃,測定青稞蛋白質的吸水性,分析微波與未微波提取出來的青稞蛋白質的吸水性隨溫度的變化情況,結果如圖6所示。
在不同的溫度條件下,青稞蛋白質的吸水性不同,隨著溫度的升高,青稞蛋白質吸水性緩慢升高。當溫度升高時,經過微波處理,蛋白質的分子構象輕微改變,分子的立體結構伸展,埋藏在球狀分子內部的親水基暴露,促進了蛋白質分子和水分子的相互作用,提高了蛋白質的吸水性。
2.3.2 溫度對青稞蛋白質吸油性的影響
分別選取溫度 30、40、50、60、70 ℃,測定青稞蛋白質的吸油性,分析微波與未微波提取出來的青稞蛋白質的吸油性隨溫度的變化情況,結果如圖7所示。
隨著溫度的升高,青稞蛋白質的吸油性緩慢增加,在30℃~50℃的時候變化明顯,50℃~70℃變化不大,而經過微波處理的青稞蛋白質吸油性略高于未經微波處理的。可能是由于微波處理使得分子內部的親油基暴露,但是隨著溫度的升高,蛋白質分子間發生了熱變性反應,分子構象發生了輕微改變,導致吸油基團暴露截留了油分子,促進了蛋白質分子間的相互結合,減弱了蛋白質與油的相互作用。

圖7 溫度對青稞蛋白質吸油性的影響Fig.7 Effect of temperature on oil absorption of highland barley protein
2.3.3 pH值對青稞蛋白質溶解性的影響
分別選取 pH 4、5、6、7、8,測定青稞蛋白質的溶解性,分析微波與未微波提取出的青稞蛋白質的溶解性隨pH值的變化,結果如圖8所示。

圖8 pH值對青稞蛋白質溶解性的影響Fig.8 Effect of pH on the solubility of highland barley protein
青稞蛋白質的溶解性呈現出先降低后升高的趨勢,在等電點附近,溶解性最差,隨著堿性的逐漸增強,青稞蛋白質的溶解性逐漸增強。微波處理提取出來的青稞蛋白質溶解性略高于未經過微波處理的,但是二者的變化趨勢相似,微波處理提高了青稞蛋白質的溶解性,溶解性的提高可能歸因于它們較小的分子以及新暴露的可電離氨基酸和羧基,從而增加了水解產物的親水性[15]。
2.3.4 pH值對青稞蛋白質起泡性和泡沫穩定性的影響
分別選取 pH 4、5、6、7、8,測定青稞蛋白質的起泡性和泡沫穩定性,分析微波與未微波提取出的青稞蛋白質的起泡性和泡沫穩定性隨pH值的變化,結果如圖9所示。

圖9 pH值對青稞蛋白質起泡性和泡沫穩定性的影響Fig.9 Effect of pH on the foaming properties and foam stability of highland barley protein
pH值對青稞蛋白質的起泡性和泡沫穩定性有顯著性影響,在pH值為5左右時,起泡性最差,是因為起泡性與蛋白質溶解度相吻合,肽不能迅速移動到界面[16],而泡沫穩定性最好;隨著pH值的增加,青稞蛋白質的起泡性逐漸增強,泡沫穩定性降低,可能因為增加電荷密度和增加堿度會增強靜電排斥力,從而阻止泡沫粒子的快速聚集[17]。微波與未微波提取出的青稞蛋白質起泡性和泡沫穩定性差異不大,經過微波處理,蛋白質的排斥作用形成了黏性膜,較小的肽比較大的肽能夠將更多的空氣吸收到溶液中,但它們的強度不足以提供穩定的泡沫[18]。
2.3.5 pH值對青稞蛋白質乳化活性和乳化穩定性的影響
分別選取 pH 4、5、6、7、8,測定青稞蛋白質的乳化活性和乳化穩定性,分析微波與未微波提取出的青稞蛋白質的乳化活性和乳化穩定性隨pH值的變化,結果如圖10所示。

圖10 pH值對青稞蛋白質乳化活性和乳化穩定性的影響Fig.10 Effect of pH on the emulsification activity and emulsification stability of highland barley protein
隨著pH值的升高,青稞蛋白質的乳化活性呈現出先降低后升高的趨勢,可能是因為脂肪小球周圍形成帶點層,引起相互排斥,延遲了液滴的聚集;乳化穩定性呈現出先降低后升高的趨勢,由于多肽的低分子量,兩親性不足以表現出較好的性質,在等電點附近,青稞蛋白質的乳化活性和乳化穩定性均最差,隨著堿性逐漸增強,青稞蛋白質的乳化性和乳化穩定性明顯升高[19]。經過微波處理與未經微波處理的乳化活性和乳化穩定性差異性不顯著。
2.4 青稞蛋白質的熱特性分析
經過DSC處理,得到了青稞蛋白質的熱變性溫度與焓值,如表4所示。

表4 青稞蛋白質的變性溫度和焓變值Table 4 Changes of denaturation temperature and enthalpy of highland barley protein
從表4中可以看出,微波輔助法提取出來的蛋白質與天然蛋白質的熱變性溫度Tm=(88.37±0.019)℃,變性熱焓 △H=(96.61±0.056)J/g,天然的蛋白質與經過微波輔助提取出的青稞蛋白質無顯著性差異。
2.5 青稞蛋白質的紅外吸收光譜分析
經過傅里葉紅外光譜的測定,得到的結果如圖11所示。

圖11 青稞蛋白質的紅外光譜吸收圖Fig.11 Infrared spectrum absorption of highland barley proteinz
一般情況下,蛋白質和多肽在紅外區都有著若干特征吸收譜帶,如波數1 700 cm-1~1 600 cm-1范圍所對應的酰胺Ⅰ帶,1 550 cm-1~1 530 cm-1范圍的酰胺Ⅱ帶和1 300 cm-1~1 260 cm-1范圍的酰胺Ⅲ帶[20];由圖11可以看出:經過微波輔助提取出的青稞蛋白質在1 634.8 cm-1處的吸收峰主要應為酰胺Ⅰ區吸收譜帶;1 578.4 cm-1處的吸收峰主要為酰胺Ⅱ區的吸收譜帶;1 234.4 cm-1處吸收峰應為酰胺Ⅲ區吸收譜帶,與未微波提取出的青稞蛋白質無差異。這與一般蛋白質的酰胺Ⅲ區吸收譜帶(1 300 cm-1~1 260 cm-1)略有不同,可能與青稞蛋白質自身性質有關。
3 結論
通過單因素試驗及響應面結果得知,影響微波輔助提取青稞蛋白質主要因素為pH值,微波功率,其次是微波溫度,影響最小的因素是微波時間,最優工藝條件下提取率達到81.94%。與天然的青稞蛋白質對比,經過微波處理提取出的青稞蛋白質吸水性提高了15.5%,吸油性提高了13.6%,溶解性提高了25.0%,起泡性降低了6.0%。微波處理對青稞蛋白質的二級結構影響較小。

