原發性膽汁性膽管炎患者肝組織中自然殺傷細胞活化性受體及其配體的表達及意義
余海燕, 韋進香, 付海艷, 楊依娜, 涂榮芳, 唐映梅
昆明醫科大學第二附屬醫院 消化內科, 昆明 650101
原發性膽汁性膽管炎(primary biliary cholangitis,PBC)是以進行性肝內小膽管非化膿性炎癥為特征的慢性膽汁淤積性自身免疫性肝病。近年來,我國PBC的發病率顯著增加[1]。但是目前PBC的病因和發病機制尚不完全清楚。
NK細胞活化性受體(NK cell activating receptor,NKG2D)為目前研究較清楚的NK細胞的活化性受體之一,MHC-Ⅰ類(MHC class Ⅰchain-related molecule,MIC)是最早被發現且研究較充分的NKG2D受體的配體。NK細胞介導的先天免疫反應可能是PBC初始階段的關鍵[2]。有研究[3]表明,阻斷NKG2D可降低NK細胞的細胞毒性和IFNγ的產生,阻斷IL-10可增強NK細胞的細胞毒性和IFNγ的產生。IL-15可誘導先天性和適應性淋巴細胞亞群上NKG2D的表達[4]。本實驗著重探討單核細胞是否通過NKG2D/MICA及細胞因子途徑參與PBC發病,為闡明PBC的發病機制及尋找新的治療靶點提供理論基礎。
1 資料與方法
1.1 研究對象 選取2014年8月-2015年6月在本院住院且確診為PBC(PBC組,n=30)、慢性乙型肝炎(CHB組,n=15)和非酒精性脂肪性肝病(NAFLD組,n=10)患者的肝穿刺活檢標本。PBC的診斷符合美國肝病學會2009年修訂的PBC診療指南[5],CHB的診斷符合《慢性乙型肝炎防治指南(2015年版)》[6],NAFLD的診斷符合2010年修訂的《非酒精性脂肪性肝病診療指南(2010年修訂版)》[7]。排除標準:自身免疫性肝炎,原發性硬化性膽管炎,病毒性肝炎,肝豆狀核病變等遺傳代謝性疾病,酒精性肝病,肝、膽、脾和其他器官的占位性病變,其他引起肝脾腫大的相關疾病,嚴重的心肺疾病。
1.2 試劑 鼠抗人NKG2D、IL-15、IFNγ單克隆抗體、兔抗人IL-10、MICA多克隆抗體(美國GeneTex公司);HRP標記山羊抗小鼠、山羊抗兔二抗(武漢谷歌生物科技有限公司);蘇木素液(武漢博士德生物工程有限公司);檸檬酸鹽抗原修復液/EDTA(上海翊圣生物科技有限公司)。
1.3 結果判斷 根據肝組織HE染色結果,按照我國慢性肝炎的病理學分級、分期判斷肝臟標本的肝臟炎癥活動度(G)和纖維化程度(S),分析各表達因子與肝內炎癥的關系。肝臟炎癥活動度分級和纖維化程度分期標準參見《慢性乙型肝炎防治指南(2015年版)》[6]。
采用SP法行免疫組化染色。各指標細胞漿和/或細胞核和/或細胞膜有棕黃色顆粒為陽性表達;根據染色細胞多少及染色深淺計算染色評分,判斷各指標表達情況。在顯微鏡下隨機選取5個高倍視野進行細胞計數,根據染色深淺將所有細胞分為4個等級:A不著色,0分;B淺黃色,1分;C棕黃色,2分;D棕褐色,3分。每個視野中陽性細胞A、B、C、D所占的百分數分別為a、b、c、d;細胞的染色評分按A×a+B×b+C×c+D×d計算。
1.4 倫理學審查 本研究通過昆明醫科大學第二附屬醫院醫學倫理委員會審批(批號:審-PJ-2019-38)。
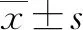
2 結果
2.1 一般資料 3組患者一般資料見表1。

表1 3組患者的一般資料比較
2.2 NKG2D表達情況 CHB組與NAFLD組肝組織中NKG2D均陰性表達。PBC組:NKG2D陽性表達主要位于匯管區(50%)及中央靜脈(10%)與匯管區之間(40%),且NKG2D的表達隨炎癥程度加重而上升,G3~4級者明顯高于G1~2級者,差異有統計學意義(G1 vs G2 vs G3 vs G4:1.4±0.05 vs 1.56±0.05 vs 1.86±0.11 vs 2.60±0.17,F=150.8,P<0.05);隨纖維化程度加重而下降,差異有統計學意義(S3 vs S4:2.30±0.17 vs 1.56±0.05,t=-1.52 ,P<0.05)(圖1)。



注:a,CHB組;b,NAFLD組;c,PBC組。
2.3 MICA表達情況 CHB組、NAFLD組及PBC組G1~2級MICA均為陰性表達。PBC組:G3~4級MICA的陽性細胞主要位于匯管區(60%)及中央靜脈與匯管區之間(40%),G3與G4級比較差異無統計學意義(0.11±0.01 vs 0.20±0.03,t=-2.20,P>0.05),S3與S4級比較差異無統計學意義(0.12±0.02 vs 0.18±0.03,t=-2.64,P>0.05)(圖2)
2.4 IL-15表達情況 IL-15在NAFLD組陰性表達,在CHB組與PBC組肝內表達。PBC組:IL-15的陽性細胞主要位于匯管區(60%)及中央靜脈與匯管區之間(30%),炎癥程度組間比較差異有統計學意義(G1 vs G2 vs G3 vs G4:0.70±0.10 vs 1.50±0.10 vs 1.93±0.11 vs 2.60±0.17,F=251.3,P<0.05),纖維化程度組間比較差異無統計學意義(S3 vs S4:2.00±0.05 vs 2.40±0.30,t=-1.62,P>0.05)。CHB組IL-15的表達:炎癥程度組間比較差異有統計學意義(G1 vs G2 vs G3:0.73±0.15 vs 1.96±0.15 vs 2.50±0.17,F=150,P<0.05),纖維化程度組間比較差異有統計學意義(S1 vs S2 vs S3:0.70±0.10 vs 21.96±0.15 vs 2.50±0.17,F=158.7,P<0.05)(圖3)。
2.5 IL-10表達情況 NAFLD組、CHB組G3~4級及PBC組G2~4級IL-10均陰性表達。PBC組:IL-10的陽性細胞主要位于匯管區(60%)及中央靜脈與匯管區之間(20%),且僅G1期表達(0.16±0.01)。CHB組G1、G2級均表達IL-10,炎癥程度組間比較差異無統計學意義(G1 vs G2:0.19±0.01 vs 0.13±0.01,t=-1.522,P>0.05)(圖4)。
2.6 IFNγ表達情況 3組IFNγ均為陰性表達(圖5)。
2.7 PBC組IL-15、IL-10、IFNγ表達與肝功能的相關性分析 PBC患者肝組織IL-15的表達與ALP、GGT水平均呈正相關(r值分別為0.241、0.407,P值分別為0.014、0.045)(圖6)。



注:a,CHB組;b,NAFLD組;c,PBC組。



注:a,CHB組;b,NAFLD組;c,PBC組。



注:a,CHB組;b,NAFLD組;c,PBC組。

圖6 PBC患者IL-15表達與ALP、GGT相關性
3 討論
近年來,天然免疫在PBC發病中的作用日益受到重視[8]。NK細胞介導的先天免疫反應在PBC的早期階段至關重要[9]。前期研究[10]也發現,PBC患者肝內NK細胞功能增強,提示NK細胞上游存在調節機制,但目前PBC時NK細胞如何被激活的機制仍不清楚,需進一步探究。
NKG2D是NK細胞特異性基因家族中的一個基因編碼,可與MICA結合,且主要表達在有免疫活性的細胞上(如NK細胞、CD8+T淋巴細胞及CD4+T淋巴細胞表面),可為NK細胞同時提供完全激活信號和協同刺激信號,通過增強殺傷作用,參與天然免疫和適應性免疫的調節。
本實驗中NKG2D主要表達于PBC肝臟匯管區,與PBC非化膿性小膽管炎癥及破壞、膽管增生的病理特征一致。PBC患者肝組織中高表達NKG2D,且隨著炎癥程度加重而上升,隨纖維化程度加重而下降,提示NKG2D可能參與了PBC的早期發病,而PBC晚期NK細胞活性則受到抑制。前期研究[11]亦表明,PBC患者外周血NK細胞比例低于正常對照組,以CD56+NK亞群為主,由于CD56+NK細胞產生細胞因子,介導免疫調節作用,提示NK細胞可能主要以免疫調節參與PBC的發病。
MICA在表達異常時被NKG2D識別并結合,啟動NK細胞介導的免疫應答。在自身免疫性疾病中,異常表達的MICA分子,可能導致NK細胞異常活化從而引發自身免疫反應[12]。
本研究發現PBC患者肝組織MICA表達明顯升髙,且隨著炎癥及纖維化程度的加重呈上升趨勢,提示PBC患者MICA異常表達,巨噬細胞處于“應激”狀態,參與免疫反應。PBC患者肝組織中MICA的表達升高,NKG2D表達亦升高。因此,單核細胞與NK細胞之間可能通過NKG2D/MICA途徑參與PBC的發生發展。此外,MICA的表達較NKG2D的表達減少,可能是細胞上的抑制性受體與單核細胞上一部分MICA結合干擾所致,或是持續上調的NKG2D負反饋調節MICA,這提示可能還有其他因素影響NKG2D的活化。
外源性HBsAg刺激了CHB患者NK細胞NKG2D表達[13]。本研究中CHB組NKG2D、MICA均為陰性表達,可能是因為納入的慢性乙型肝炎患者均治療過,且慢性乙型肝炎免疫激活期患者NK細胞活化受體NKG2D的表達、IFNγ和TNFα的產生分別低于免疫耐受期[14]。
IL-15能誘導NK細胞、T淋巴細胞增殖及細胞因子的產生,同時還能增強樹突狀細胞和巨噬細胞的存活,促進強烈的免疫應答。本研究發現IL-15在PBC患者肝臟中表達,隨炎癥程度加重呈上升趨勢。其次,IL-15的表達與血清GGT和ALP的表達呈顯著正相關。有研究[15]表明,IL-15激動劑可使CD8+T淋巴細胞的細胞內IFNγ和TNFα分泌增加,并上調CD8+T淋巴細胞上NKG2D的表達。
肝內單核巨噬細胞被HBV抗原活化導致IL-15大量釋放,而增高的IL-15反過來刺激細胞毒性T淋巴細胞、NK細胞等免疫活性細胞分泌炎性細胞因子,其通過介導細胞毒性作用直接參與自身免疫病理過程[16]。本實驗結果中CHB組IL-15高表達,且隨著炎癥程度和纖維化程度的加重呈上升趨勢。有研究[17]表明,抗病毒藥物替比夫定可通過上調IL-15和NKG2D來恢復CD56 NK細胞的功能。因此,提示IL-15可能參與PBC的發生發展,且在膽管上皮細胞的損傷中具有一定作用,但IL-15在PBC中的具體作用及機制需進一步研究探索。
NK細胞表達IL-10和IL-10受體,單獨的IL-10對NK細胞毒性具有顯著影響,在IL-15存在下,其可增加NK細胞的細胞毒性[18]。其次,IL-10作為一種免疫抑制和抗炎細胞因子,內源性IL-10在維持免疫耐受中起關鍵作用,外源性IL-10會加劇肝臟炎癥和纖維化[19]。本研究發現IL-10在PBC組、CHB組表達,提示IL-10可能在肝內炎癥及纖維化發生的進程中發揮一定作用,但具體機制需進一步研究。
PBC患者中由NK細胞合成的IFNγ、IL-6和IL-8的水平顯著降低,且NK細胞頻率的降低和NKG2A的增加可能通過IFNγ分泌減少而導致細胞毒活性降低,有助于恢復NK細胞相關免疫力[20-21]。IFNγ的缺失降低了肝臟中炎性巨噬細胞的頻率,并減輕了肝纖維化[22]。而NK細胞上IL-15受體的上調可能促進IFNγ的產生[23]。本研究3組中IFNγ均陰性表達,PBC患者高表達的NKG2D、IL-15可能通過負反饋調節導致IFNγ表達減少,但需進一步深入研究。
本實驗結果中PBC肝內表達NKG2D,同時在晚期表達MICA,提示可能通過NKG2D/MICA促進NK細胞的活化,并介導細胞間相互作用,調節肝內炎癥反應的程度,進而引起膽管上皮的損傷,從而參與PBC的發生發展。其相關細胞因子分泌異常在PBC的發生發展中發揮一定作用,但細胞因子之間的相互調節作用需要進一步深入探究。因此,NKG2D/MICA信號轉導活化通路可能是PBC治療的一個靶點,而IL-15可能作為一個輔助診斷PBC的指標。
利益沖突聲明:本研究不存在研究者、倫理委員會成員、受試者監護人以及與公開研究成果有關的利益沖突,特此聲明。
作者貢獻聲明:余海燕、楊依娜參與撰寫論文,修改論文,資料分析;韋進香收集數據,研究過程及數據分析;付海艷指導撰寫文章,負責擬定寫作思路;涂榮芳參與資料分析;唐映梅負責課題設計,最后定稿。

