低溫誘導稻曲病菌菌核形成的轉錄組學分析
呂楚陽,鄧平川,張曉麗,孫鈺超,梁五生,胡東維
(1浙江大學生物技術研究所/水稻生物學國家重點實驗室,杭州 310058;2浙江大學作物科學研究所,杭州 310058)
0 引言
【研究意義】近年來,我國稻曲病已從水稻次要病害上升為主要病害,成為全世界稻米主產區的主要真菌病害之一[1]。稻曲病是由子囊菌門麥角菌科的稻曲病菌(Villosiclava virens)侵染水稻穎花造成的。病原菌侵染后,整個穎花形成球狀菌落,最外層有大量黃色和墨綠色的厚垣孢子層。在一定環境條件下,稻曲球表面可形成一個至數個菌核[2]。菌核及其有性生殖是稻曲病菌安全越冬和提供來年初侵染源的重要方式,菌核及其萌發過程的控制是稻曲病控制的中心環節和瓶頸問題。因此,深入研究菌核的分化與形成機制對探索稻曲病防控新策略具有重要意義。【前人研究進展】在稻曲病的侵染循環過程中,病菌菌核常被認為是造成病害初次侵染的重要來源。稻曲病菌菌核可以安全越冬,并在來年萌發產生大量的子囊孢子,且在時間上與稻曲病菌在水稻孕穗期侵染基本一致[3-6]。稻曲病菌菌核一般形成在高海拔或溫帶地區,且出現在稻曲球發育的后期[7-8],而在我國南方地區數量很少,在部分地區如廣東尚未發現菌核[9]。但也有研究發現,位于長江中下游地區、屬于亞熱帶地區的浙江省,稻曲病菌不但可產生菌核,且菌核的數量龐大[10]。筆者課題組近期研究表明,在稻曲球發育前期,低溫是誘導稻曲病菌產生菌核的重要環境因子之一,室內夜間15℃處理3 d即足以誘導菌核形成[11];減少田間菌核數量可顯著減輕稻曲病的發生[12]。為了驗證低溫是菌核產生的主導環境因子,筆者對低溫誘導后的稻曲球進行了系統性解剖,結果發現稻曲球內部具有比以往的認識更多的隱含菌核。目前,轉錄組測序技術已經成功運用到病原菌形態發育研究中,YU等[13]利用轉錄組技術比較分析稻曲病菌子實體發育和產分生孢子階段的基因表達差異,揭示了稻曲病菌的有性生殖相關候選基因;韓彥卿等[14]采用測序技術對接種稻曲病菌的抗、感病水稻進行了轉錄組學分析,初步探明參與水稻與稻曲病菌之間早期互作的調控網絡。【本研究切入點】通過轉錄組測序技術,全面、快速地獲取低溫誘導菌核形成過程中的所有轉錄本信息,并系統分析相關的基因表達變化。【擬解決的關鍵問題】采用轉錄組測序技術對低溫處理的稻曲病菌樣品進行研究,探明稻曲病菌菌核形成初期的基因表達變化,闡釋低溫誘導稻曲病菌菌核形成的分子機制并了解其發育進程,為稻曲病防控提供理論依據。
1 材料與方法
試驗于2018—2019年在浙江大學完成。

圖1 晚秋田間形成的稻曲球Fig. 1 The rice false smut balls formed in late autumn in paddy field
1.1 試驗材料
對照組稻曲球樣本采自浙江省杭州市桐廬縣的稻曲病常發生地塊,采集地區前10 d的日間平均氣溫為31.2℃。另采集浙江省寧波市奉化區前10 d的日間平均氣溫為23.2℃的稻曲球為處理組樣本,本組樣本的田間溫度與對照組相差約10℃,視為低溫處理(圖1)。采集發育前期的稻曲球立即放入液氮中速凍,-80℃冰箱中保存。測序所用樣品均設置3個生物學重復,每個重復3—5個稻曲球,分別記為對照組:TL911_1、TL911_2、TL911_3;低溫處理組:FH1016_1、FH1016_2、FH1016_3。
1.2 試驗方法
1.2.1 建庫測序 將提取的稻曲病菌RNA利用瓊脂糖凝膠電泳、Nanodrop、Qubit 2.0 Fluorometer、Agilent 2100等儀器進行降解程度、是否污染、純度、濃度和完整性共5個方面的評估,質檢合格后,以片段化的mRNA為模板,隨機寡核苷酸為引物,在 M-MuLV逆轉錄酶體系中合成cDNA第一條鏈,隨后用RNaseH降解 RNA鏈,并在 DNA polymerase I體系下,以dNTPs為原料合成 cDNA第二條鏈。純化后的雙鏈cDNA經過末端修復、加 A尾并連接測序接頭,用AMPure XP beads篩選250—300 bp左右的cDNA,進行PCR擴增并再次使用AMPure XP beads純化PCR產物,構建cDNA文庫,并委托北京諾禾致源生物信息科技有限公司利用Illumina HiSeqTM4000測序平臺進行高通量測序。
1.2.2 轉錄組數據分析 利用 Hisat2(v2.1.0)[15]將各樣本數據(clean reads)分別與稻曲病菌“UV-8b”參考基因組序列(https://www.ncbi.nlm.nih.gov/genome/31935?genome_assembly_id=59177)進行比對,保留唯一基因組比對序列,結合基因組注釋文件,利用StringTie(v2.0)軟件完成各基因定量,差異表達基因(differentially expressed gene,DEG)鑒定依賴于R包ballgown,篩選標準為|log2fold change (FC)|≥1且q-value≤0.05[16]。采用 Gene Ontology(GO)數據庫(http://geneontology.org)和 Kyoto Encyclopedia of Genes and Genomes(KEGG)數據庫(https://www.genome.jp/kegg/pathway.html)對DEG分別進行GO和Pathway富集分析。
1.2.3 差異表達基因的 qRT-PCR驗證 為驗證轉錄組數據準確性,隨機選取6個DEG進行qRT-PCR定量。利用Primer Premier 5.0設計qRT-PCR引物,內參基因選用α-tubulin,引物列表詳見表 1。隨后采用儀器CFX96 Real-Time System(BIO-RAD)進行qPCR擴增,反應程序:95℃ 5 min;95℃ 10 s,60℃ 30 s,40個循環,每個樣品設置3次重復。采用2-ΔΔCT法計算差異基因相對表達量[17]。
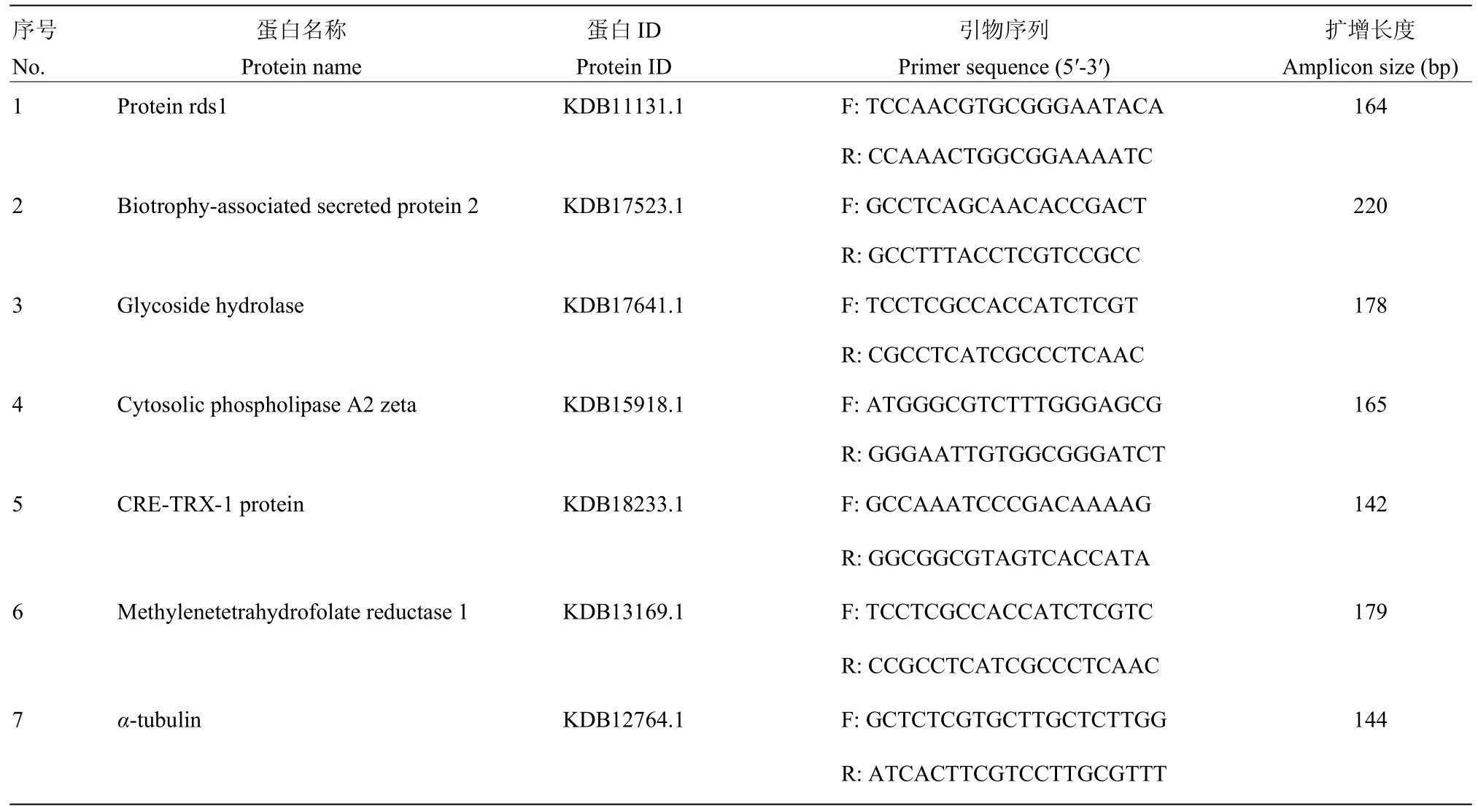
表1 實時熒光定量PCR所用引物Table 1 Primers used in qRT-PCR
2 結果
2.1 測序數據質量分析
轉錄組分析共計6個樣本,包括稻曲病菌對照組樣本 TL911_1、TL911_2、TL911_3和低溫處理組樣本FH1016_1、FH1016_2、FH1016_3。過濾帶有接頭(adapter)序列和低質量reads,共得到59.78 G的clean data,樣本平均數據量約為9.96 G,其中,近93.17%的序列能夠比對到參考基因組(表 2)。以上結果表明測序產出數據質量良好,可進行后續的生物信息學分析。
基于各基因表達量,計算樣本間相關系數(R2),R2越接近 1,表明樣本之間表達模式的相似度越高。由圖2-A可知,對照組、低溫處理組3個生物學重復間任意兩個樣本R2均>0.99,表明生物學重復性好、數據可靠。此外,比較了不同處理下的基因表達相關性,發現對照組TL911與處理組FH1016之間的平均R2為0.93,低于組內生物學重復,說明低溫處理組的基因表達與對照組之間存在一定差異,暗示低溫誘導稻曲病菌菌核形成過程中確實發生了基因轉錄變化。樣本間層級聚類也有著相近的結果,即相同樣本、不同生物學重復優先聚類(圖2-B)。
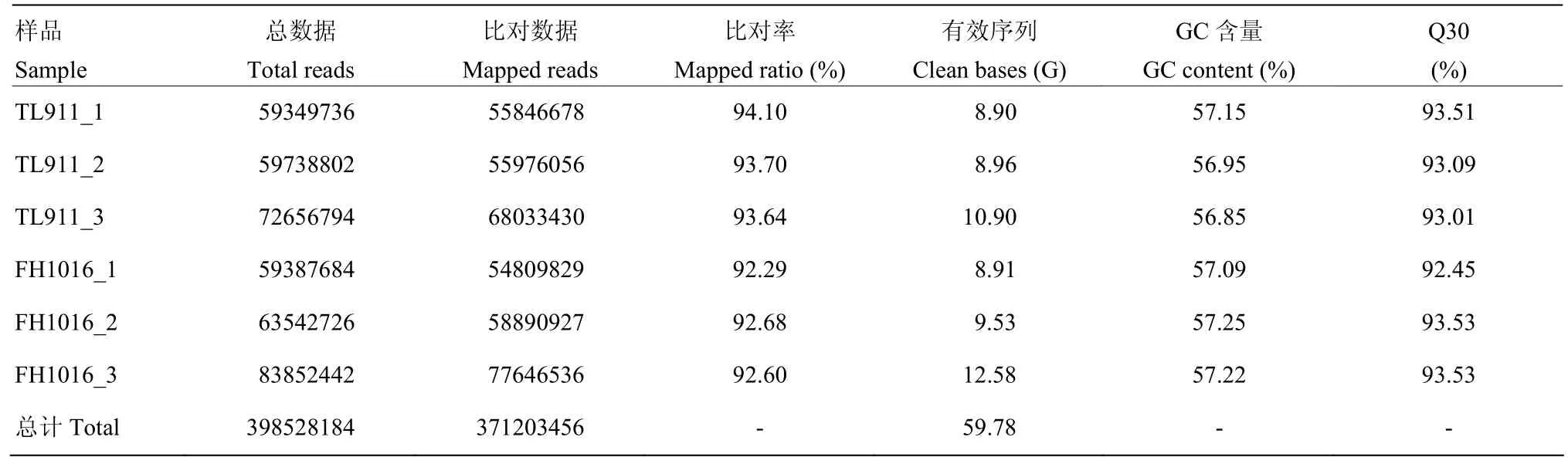
表2 轉錄組測序數據以及與參考基因組比對結果Table 2 Sequencing data and alignment results of sequencing data with the reference genome
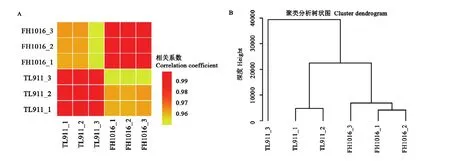
圖2 樣本間關系的整體特征Fig. 2 Overall characterization of sample relationship
綜合TL911和FH1016樣本基因表達分析,共檢測到8 426個基因發生一定程度表達(圖3-A),占稻曲病菌基因組基因的97.13%。按照DEG篩選標準,只有793個基因表達量發生了顯著性變化,占總體基因的9.41%,其中,398個基因表達上調,395個基因表達下調(圖 3-B)。上、下調表達倍數最高的前 6位基因及其相對表達量、FPKM表達量分別見圖3-C、3-D。
2.2 GO富集分析
GO注釋主要從3個角度描述基因的生物學功能,包括分子功能、生物過程和細胞成分。DEG在分子功能分類中,顯著富集于氧化還原酶活性(GO:0016491),其上調基因 142個,下調基因89個;陽離子結合(GO:0043169),其上調基因146個,下調基因83個;金屬離子結合(GO:0046872),其上調基因145個,下調基因83個;過渡金屬離子結合(GO:0046914),其上調基因113個,下調基因 61個(圖 4-A);而在生物過程類別中,碳水化合物代謝過程(GO:0005975)和氧化還原進程(GO:0055114)等通路富集程度最高(圖4-B);進一步對分子功能中氧化還原酶活性功能條目的DEG分析,發現NADPH氧化酶(KDB12731.1)、過氧化氫酶(KDB11363.1)、FAD依賴性氧化還原酶(KDB11634.1)、肌氨酸氧化酶(KDB12820.1)在低溫處理稻曲病菌中顯著上調,結合生物過程類別中氧化還原過程的相對活躍,推測這些真菌機體的氧化還原反應可能與稻曲病菌菌核形成有關。另外,在所有的 GO分類中包含上調與下調基因的表達,但整體上并未發現有顯著富集的下調功能條目。
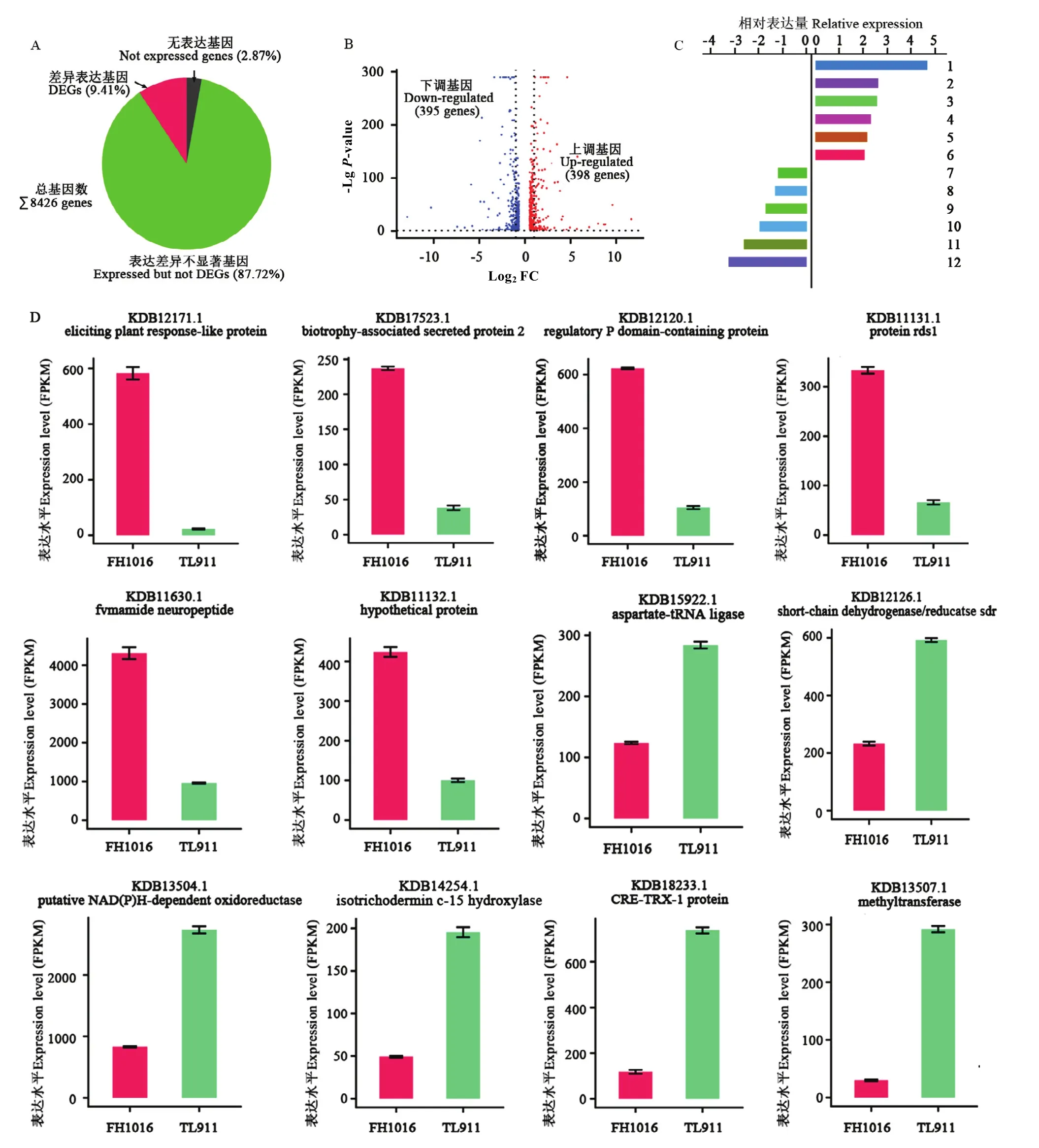
圖3 低溫處理下稻曲病菌表達差異顯著基因的比較分析Fig. 3 The comparative analysis of DEGs in V. virens under low temperature

圖4 稻曲病菌低溫誘導菌核形成相關基因的鑒定及富集分析Fig. 4 Identification and enrichment analysis of genes involved in low temperature response in V. virens at the initial stage
2.3 KEGG代謝途徑分析
DEG被注釋到91條通路中,共獲得顯著富集通路8條,分別涉及次生代謝產物生物合成、淀粉和蔗糖代謝、糖酵解/糖異生、碳代謝、甲烷代謝、抗生素的生物合成、丙氨酸、天冬氨酸和谷氨酸代謝、氨基糖和核苷酸糖代謝(表3、圖4-C)。這些結果進一步表明,稻曲病菌菌核在形成過程中具有活躍的營養物質代謝和能量代謝。
2.4 差異表達的基因家族分析
基因家族是指在進化過程中,由一個祖先基因通過基因復制產生兩個或更多的拷貝,進而發生分化形成的一類具有相似結構和功能的基因,能夠編碼相似的蛋白質產物。本研究中DEG共注釋到180個基因家族中,占DEG總數的22.7%(圖5-A),其中111個基因家族表現為顯著上調,占總數的 61.67%;11個上調基因被注釋到MFS轉運蛋白基因家族中,富集程度最高,其他顯著上調表達基因家族如糖轉運蛋白(8個)、鋅指轉錄因子(6個)、磷酸激酶(4個)等也有著較多成員受低溫誘導(圖5-B—E);顯著下調基因家族占比38.33%,主要包括真菌特異性轉運蛋白基因家族(4個)、磷酸轉移酶基因家族(3個)等(圖 6)。推測顯著差異數目較多的基因家族與低溫誘導稻曲病菌菌核形成有關,可能參與低溫脅迫的形態學發育和生理代謝響應。
2.5 與低溫誘導菌核形成相關的差異表達基因
為研究稻曲病菌在低溫處理后,菌核形成過程中基因表達差異,根據稻曲病菌基因組搜索獲得基因編號,主要對氧化應激反應、信號轉導、跨膜運輸、細胞形態、生物合成等相關基因進行分析。并根據轉錄組數據的 FPKM 值繪制熱圖表示基因的相對表達量(圖 7)。這些基因在不同樣本間的表達量具有顯著差異。

表3 差異表達基因在KEGG代謝通路中顯著富集分析Table 3 KEGG enrichment significant analysis of DEGs
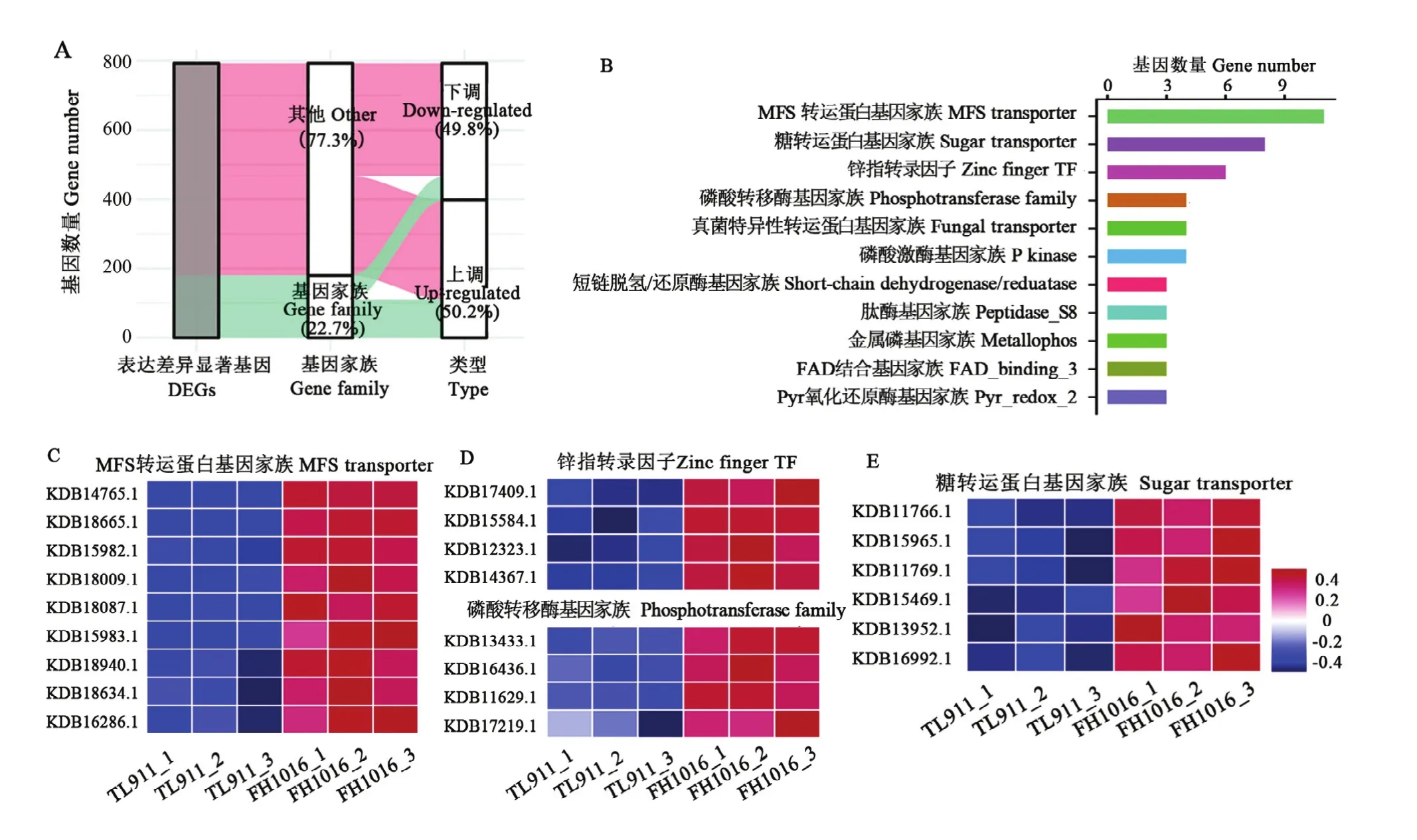
圖5 稻曲病菌低溫誘導相關基因家族的表達分析Fig. 5 Expression analysis of gene family involved in low temperature response in V. virens at the initial stage
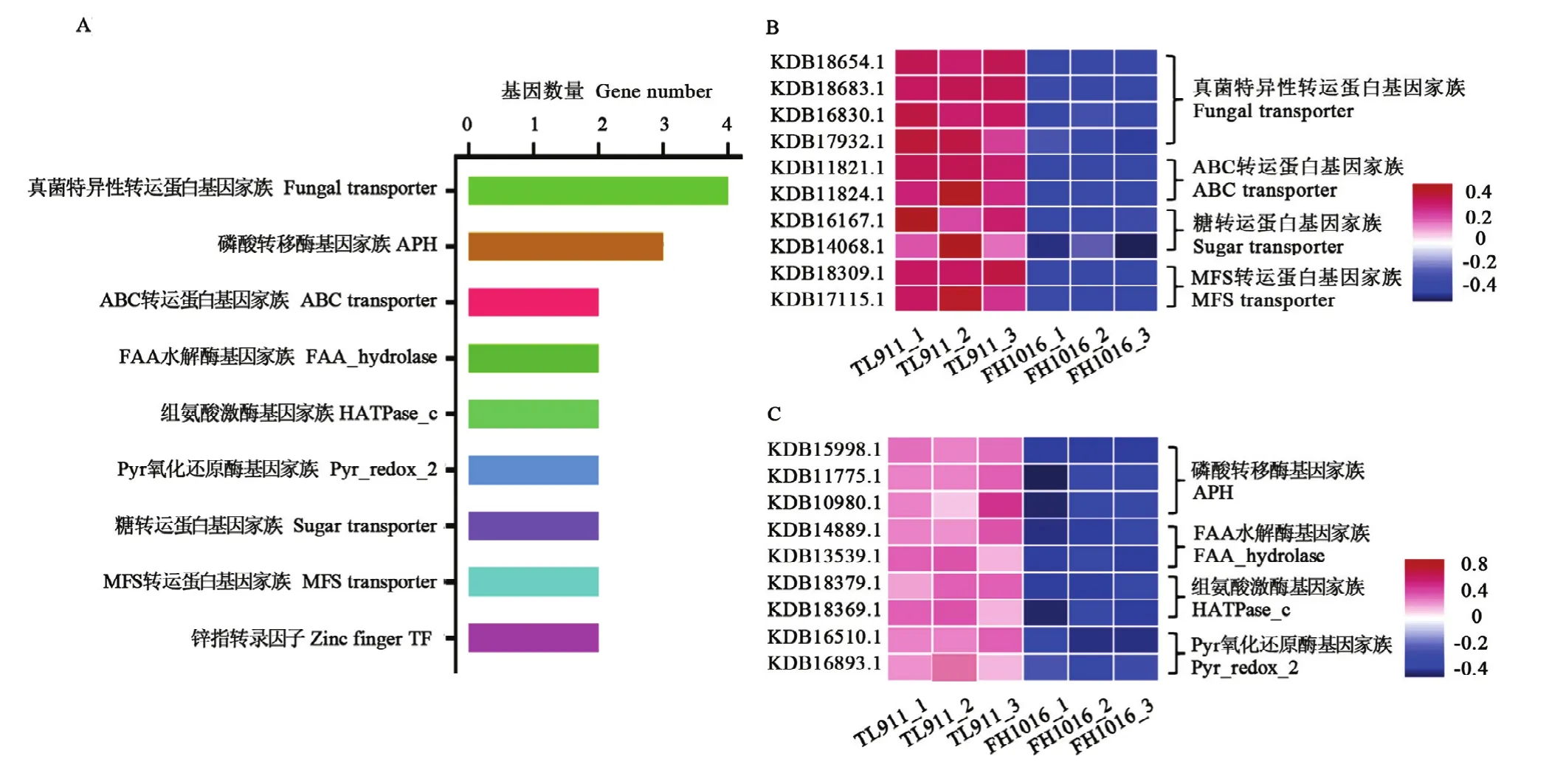
圖6 低溫誘導稻曲病菌下調表達的基因家族分析Fig. 6 Expression analysis of down-regulated gene family in V. virens under low temperature
2.5.1 氧化應激反應相關基因分析 氧化應激反應能夠誘導機體在遭受脅迫時產生的 ROS(O2-和H2O2等),影響絲狀真菌齊整小核菌(Sclerotium rolfsii)[18]和核盤菌(Sclerotinia sclerotiorum)[19]菌核的分化過程。而NADPH氧化酶(NADPH oxidase,Nox)、超氧化物歧化酶(superoxide dismutase,SOD)、過氧化氫酶(catalase,CAT)是影響真核生物細胞ROS水平和H2O2積累的關鍵酶類。對低溫處理后的稻曲病菌中Nox、SOD和CAT基因表達變化進行研究,發現NADPH氧化酶基因(KDB12731.1、KDB18142.1)、SOD基因(KDB13992.1、KDB18714.1)、CAT基因(KDB11441.1、KDB15626.1)在低溫處理的稻曲病菌中表達量明顯增加(圖 7);結合轉錄組數據GO途徑中差異基因在氧化還原酶活性和過氧化物酶的富集,推測由于低溫脅迫,稻曲病菌的氧化應激反應強烈,內部活性氧水平升高,進而誘導了菌核的分化。
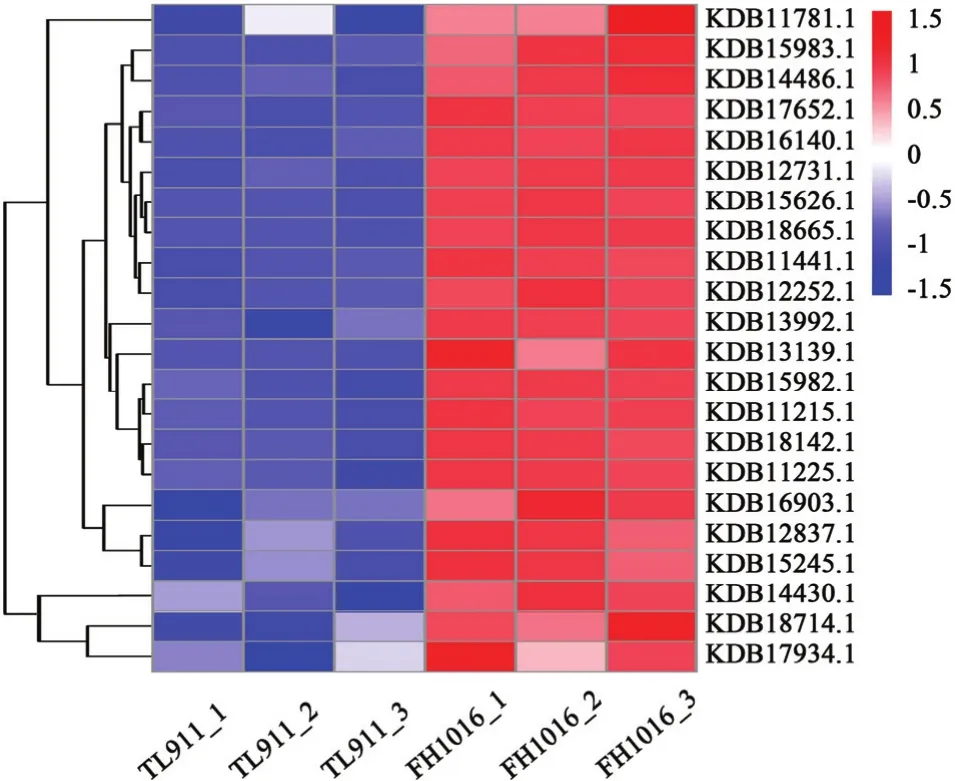
圖7 樣品TL911和FH1016中差異顯著表達基因熱圖Fig. 7 Heatmap of DEGs in TL911 and FH1016
2.5.2 信號轉導相關基因分析 絲裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)是真核類生物信號傳遞通路(MAPK通路)中的關鍵酶,能夠調控真核細胞形態和生長。轉錄組數據中,該類基因(KDB16903.1)在低溫誘導菌核的過程中顯著差異表達(圖 7),表明信號傳遞通路被激活,能夠將感知到的外界或胞內信號向下游傳遞,引發一系列的級聯反應。
2.5.3 跨膜運輸相關基因分析 主要協助轉運蛋白超家族(MFS),是目前真菌主要的跨膜運輸蛋白家族之一,在真菌營養吸收中起到重要作用。通過對DEG分析,發現有22個基因表達被注釋到MFS蛋白家族中,結合圖5-B、5-C看出MFS蛋白家族DEG在上調表達的基因家族分類中富集程度最高;其中 3個 MFS 基因 KDB15983.1、KDB18665.1、KDB15982.1上調表達量分別達到了2.46、2.14和2.11倍(圖7)。另外,糖轉運蛋白家族中絕大部分基因也是表現為顯著上調富集(圖 5)。磷脂是微生物細胞膜的重要組成部分,而磷脂酰絲氨酸合成酶(phosphatidylserine synthase,Pss)能夠催化磷脂酰絲氨酸的合成,是合成細胞膜成分的關鍵,該基因KDB14430.1在低溫處理時表達量較高(圖7)。
2.5.4 細胞形態相關基因分析 Ras和 cytochrome P450(CYP450)蛋白家族能夠調控菌絲的極性生長和形態發育[20-21],稻曲病菌轉錄組中注釋到Ras蛋白家族中的 3個基因 KDB12837.1、KDB17934.1、KDB11781.1被誘導上調表達;此外,有22個基因表達被注釋到CYP450蛋白中,其中18個家族基因表達被顯著誘導,以KDB17652.1表達量上調幅度最大,為7.13倍(圖7)。
2.5.5 生物合成基因相關分析 真菌菌核的發育形成往往伴隨黑色素的沉積,聚酮合酶是真菌黑色素合成途徑中的關鍵酶之一,通過對 DEG進行分析,發現聚酮合酶基因(KDB13139.1)上調表達了1.65倍;此外幾丁質和 1,3-β-葡聚糖作為真菌細胞壁的組成成分,其幾丁質合成酶(KDB15245.1、KDB11225.1、KDB11215.1、KDB14486.1)表達量也顯著增高。分析富集在淀粉和蔗糖代謝途徑中的DEG,發現參與合成 1,3-β-葡聚糖的 2個關鍵基因(KDB12252.1、KDB16140.1)在低溫處理的稻曲球中顯著上調(圖7)。說明代謝產物黑色素、幾丁質和多糖隨菌核發育而被大量合成。
2.5.6 生殖相關基因分析 菌核作為無性繁殖體是稻曲病菌分化形成的一團緊密交織的菌絲體,越冬后的菌核可進行有性生殖,萌發形成子實體并產生子囊孢子。而Velvet家族蛋白被認為是真菌特有的無性和有性發育的重要調控因子,同時也影響著次級產物的合成[22-23]。通過與模式真菌比對,找出稻曲轉錄組中關于Velvet family的同源基因VEA(KDB14625.1),并發現其表達水平上調了1.31倍;其中,低溫處理組FPKM為36.97、對照組FPKM為28.19,明顯低于整個轉錄組數據的平均數值130,說明VEA在稻曲病菌的基因組內屬于低表達的組成型基因。另外,稻曲病菌的有性配合主要受基因MAT1-1-1和MAT1-2-1調控,發現MAT1-2-1表達量極低(FPKM value<2),而交配型基因MAT1-1-1在低溫處理組和對照組中均未檢測到該基因的表達。
2.6 qRT-PCR驗證基因表達
為驗證轉錄組數據是否準確、可信,隨機選取 6個DEG進行qRT-PCR檢測。qRT-PCR測定結果與轉錄組測序輸出數據分析得到的變化趨勢一致(圖8),表明本研究中基于轉錄組數據得到的DEG是可信的。
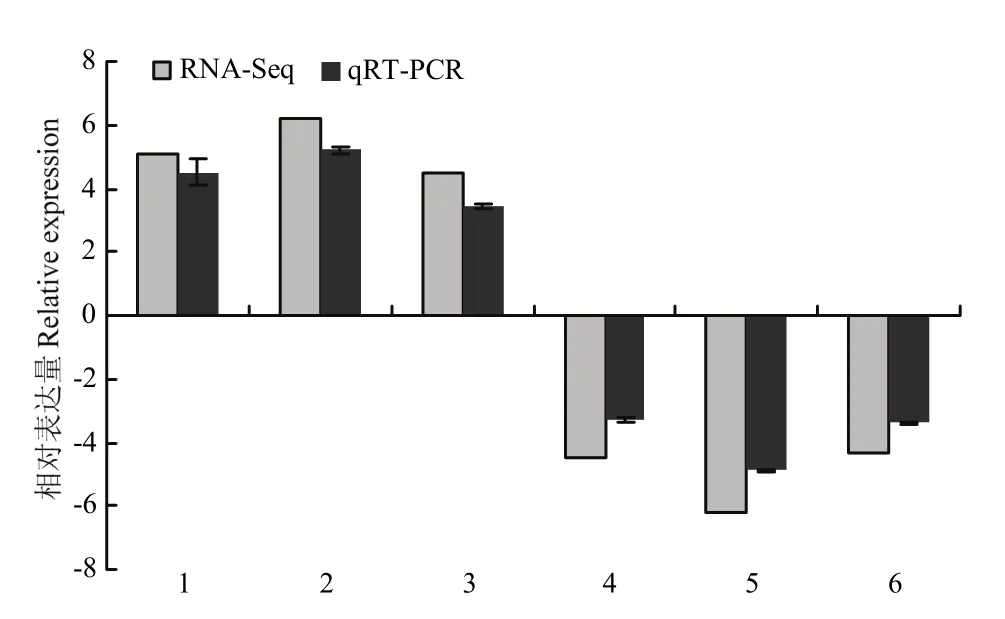
圖8 隨機挑選6個差異基因的實時熒光定量分析Fig. 8 qRT-PCR analysis of 6 randomly selected DEGs
3 討論
氧化應激反應特別是ROS的形成,是誘發菌核分化和調節真菌發育的重要因素之一,高氧化狀態可以驅動真菌菌核、有性結構的形成[24-26]。Nox能在真核生物中產生活性氧,是超氧化物的一個重要來源[27]。有研究表明,bcnoxa和bcnoxb參與了灰霉病菌(Botrytic cinerea)菌核的形成過程[28]。另一方面,在高氧化應激狀態下,各種抗氧化酶和其他小分子(如SOD、CAT等)可能在保護真菌細胞免受ROS的有害影響方面起重要作用。SOD是細胞內ROS的第一道防線,是氧化應激過程中清除自由基最重要的酶之一,在各種生物系統中都會遇到ROS,其作用是消除O2-。CAT能夠催化H2O2產生H2O和O2-,發揮抗氧化作用[29]。在本研究轉錄組數據中發現,CAT和SOD基因表達量升高,這可能歸因于氧化還原反應的平衡被破壞和ROS含量相應地急劇增加。因此,SOD和CAT能在應激時主動清除Nox產生的活性氧,最終導致抗氧化酶濃度升高,這些結果間接證明了菌核形成與氧化應激密切相關。GRINTZALIS等研究表明,黃曲霉(Aspergillus flavus)能夠在氧化應激反應中合成次級代謝產物黃曲霉素B1[30]。推測氧化應激反應不僅是菌核形成所需要的,也與菌核形成過程中次級代謝產物的合成有關聯,這與本研究KEGG通路中差異基因在次級代謝產物合成途徑中顯著富集相吻合。
此外,MAPK信號轉導通路中的絲裂霉素活化蛋白激酶基因在低溫處理組中上調表達,使得ROS能夠通過MAPK途徑將信號傳遞給下游,進一步影響稻曲病菌生理過程基因的表達。例如Pss基因表達量升高,稻曲病菌通過加速合成磷脂來保護細胞膜系統并確保膜上的功能酶能夠正常行使功能,結合基因家族分析,MFS轉運蛋白家族和糖轉運蛋白家族的DEG數目較多且表達量變化明顯,說明稻曲病菌在菌核形成過程中細胞營養代謝旺盛,自身能夠在膜轉運蛋白的協助下實現物質的快速轉運,使機體應答低溫脅迫。在細胞形態發育方面,Ras是一類調控細胞極性、周期和功能分化的信號分子,而CYP450蛋白在植物木質素中間體、甾醇、萜烯、類黃酮等多種次生代謝物的合成中起關鍵作用[31],也能夠通過對激素的響應進而影響形態發育。Ras和CYP450的表達上調,推測其參與調控稻曲菌絲的細胞極性生長與形態發育。而鋅指蛋白是一類具有手指狀結構域的轉錄因子,在轉錄和翻譯水平上調控基因的表達和細胞分化,如構巢曲霉(Aspergillus nidulans)中,nsdC蛋白是一種C2H2型鋅指蛋白,基因敲除突變體的生長速率降低,并且完全不能形成子實體[32]。本研究鋅指轉錄因子中6個顯著上調,2個顯著下調,鋅指轉錄因子家族中的不同TF表達上調或下調,推測這些TF的種類及表達水平的變化可能與稻曲病菌對低溫脅迫響應的形態發育有關。此外,代謝產物黑色素、幾丁質和多糖也隨菌核的發育而被大量合成。綜上,稻曲病菌菌絲形成菌核無疑是對外界刺激的一種反應,通過自身形態學及生理代謝等改變對低溫脅迫作出響應。
另外,在大部分絲狀真菌中有一類velvet,VEA是Velvet蛋白復合物的核心蛋白,具有廣泛存在性和功能保守性,能夠調節菌核的形成。在寄生曲霉(Aspergillus parasiticus)和黃曲霉中VEA不僅能夠調控菌核的發育、誘導黃曲霉毒素的產生,還進一步證實是機體發育和次級代謝之間分子聯系的橋梁[33-34]。在煙曲霉(Aspergillus fumigatus)中VEA可以激活有性生殖,減少分生孢子的產生。但是其組成型的基因表達,使得VEA幾乎不因無性或有性生殖的發生而有很大的表達變化[35],這與本研究在 DEG分析中發現VEA較低的上調倍數相一致,故推測稻曲病菌的VEA可能以其他獨特的方式調控菌核的形成。進一步挖掘稻曲病菌有性生殖基因的表達,發現在低溫處理組與對照組中不僅MAT1-2-1表達量極低而且還未檢測到MAT1-1-1的表達,推測是由于在低溫環境下促進的是稻曲病菌菌核的快速形成,而菌核越冬后需要在適合的溫度以及充足的光照下才能進行有性生殖形成子實體,所以導致在低溫誘導菌核形成的過程中并未發現有性生殖基因的大量表達。由于低溫誘導稻曲病菌菌核形成所涉及的分子機制尚未確定,因此通過轉錄組測序分析的大量基因將作為進一步研究的候選者,為今后稻曲病的防治提供數據和理論基礎。
4 結論
通過對低溫誘導稻曲病菌菌核形成的轉錄組數據進行深度挖掘,發現稻曲菌絲低溫脅迫下,致使菌絲機體內部處于氧化應激狀態,并通過信號轉導途徑放大,該過程由多個基因參與并調控基因家族成員,最終促使跨膜運輸、細胞形態、生物合成等基因的上調表達,使得在形成菌核過程中蛋白表達活躍,達到合成細胞及物質的高峰期,進而促進菌核形成。

