黃芪丹參對多囊卵巢綜合征大鼠雄激素/胰島素受體表達影響的研究
麥秀云 張靜 郭樂琴


摘要 目的:研究黃芪聯合丹參對多囊卵巢綜合征(PCOS)模型大鼠雄激素(AR)及胰島素受體(INSR)表達的影響。方法:通過對大鼠注射外源性雄激素建立高雄激素無排卵模型,將建模成功的大鼠隨機分為黃芪組、丹參組、黃芪+丹參聯合組以及模型組,每組10只,分別以黃芪、丹參、黃芪+丹參聯合用藥行不同干預治療,模型組用生理鹽水灌胃。比較各組大鼠血清雄激素、胰島素水平;卵巢AR、INSR mRNA及蛋白水平。結果:1)與模型組比較,黃芪組血清睪酮水平明顯下降,丹參組血清胰島素水平明顯下降;聯合組血清睪酮及胰島素水平均明顯下降。2)與模型組比較,黃芪組INSR蛋白水平明顯下降,丹參組INSR蛋白水平明顯上升;黃芪+丹參聯合組AR蛋白水平明顯下降,同時INSR蛋白水平明顯升高。3)與模型組比較,黃芪組AR mRNA水平明顯下降,丹參組INSR mRNA水平明顯上升;黃芪+丹參聯合組AR mRNA水平明顯下降,同時卵巢INSR mRNA水平明顯升高。結論:黃芪可改善PCOS的高雄激素狀態,丹參可改善PCOS的高胰島素狀態,聯合用藥兼具抗雄激素及降低胰島素的作用,AR、INSR表達的改變是其可能的作用機制之一。
關鍵詞 多囊卵巢綜合征;聯合;黃芪;丹參;雄激素受體;胰島素受體;mRNA;蛋白
Abstract Objective:To study the effects of Radix Astragali seu Hedysari and Radix Salviae Miltiorrhizae on the expression of androgen receptor and insulin receptor of rats with polycystic ovary syndrome(PCOS).Methods:The model of hyperandrogen anovulatory was established by injecting exogenous androgen.Rats successfully modeling were randomly divided into an Radix Astragali seu Hedysari group(n=10),a Radix Salviae Miltiorrhizae group(n=10),a combined group(n=10)and a model group(n=10).The rats were treated with Radix Astragali seu Hedysari,Radix Salviae Miltiorrhizae and Radix Astragali seu Hedysari+Radix Salviae Miltiorrhizae for different interventions.The rats in the model group were given the same dose of saline by gavage,The levels of serum androgen and insulin,ovarian AR,INSR mRNA and protein levels were compared in each group.Results:Compared with the model control group,1)the serum testosterone level was significantly decreased in the Radix Astragali seu Hedysari group,the serum insulin level was significantly decreased in the Radix Salvia Miltiorrhiza group,and the serum testosterone and insulin levels were significantly decreased in the combined group.2)the level of INSR protein in Radix Astragali seu Hedysari group was significantly decreased,the level of INSR protein in Radix Salvia Miltiorrhiza group was significantly increased,the level of AR protein in the combined group was significantly decreased,INSR protein in ovary was significantly increased in combined group.3)the level of ovarian AR mRNA in Radix Astragali seu Hedysari group was significantly decreased,the level of INSR mRNA in Radix Salviae Miltiorrhizae group was significantly increased,and the level of AR mRNA in combined group was significantly decreased while the level of ovarian INSR mRNA was significantly increased.Conclusion:Radix Astragali seu Hedysari can improve the hyperandrogen state of PCOS,Salvia miltiorrhiza can improve the hyperinsulin state of PCOS.Combination medication has anti-androgen and insulin-lowering effects.The change of AR and INSR expression is one of the possible mechanisms.
Keywords Polycystic ovary syndrome; Combination; Radix Astragali seu Hedysari; Radix Salviae Miltiorrhizae; Androgen receptor; Insulin receptor; mRNA; Protein
中圖分類號:R285.5 文獻標識碼:A doi:10.3969/j.issn.1673-7202.2020.20.009
多囊卵巢綜合征(Polycystic Ovary Syndrome,PCOS)確切的發病機制目前尚不清楚,但普遍認為胰島素抵抗和高雄激素血癥是2個主要的病理生理學基礎,因此控制高雄激素、糾正異常糖代謝,已成為治療PCOS的重要方向[1]。臨床上分別使用含有黃芪或丹參的方劑,觀察結果顯示有降雄激素、胰島素和增加PCOS患者妊娠率的作用[2-3]。但黃芪與丹參兩者聯合使用對PCOS高雄激素、胰島素抵抗狀態的治療效果及作用機制,目前尚無報道。本研究擬通過對大鼠注射外源雄激素建立PCOS動物模型,分別以黃芪、丹參、黃芪+丹參聯合用藥,比較不同干預組、對照組間雄激素及胰島素抵抗狀態的差異,以及卵巢雄激素、胰島素受體mRNA水平的差異,從對卵巢中雄激素受體(AR)、胰島素受體(INSR)影響的角度,探討中藥黃芪、丹參對PCOS大鼠模型抗雄激素/改善胰島素抵抗的效應和作用機制,評估黃芪、丹參及聯合應用治療PCOS的療效。報道如下。
1 材料與方法
1.1 材料
1.1.1 動物 SPF級9日齡SD雌性大鼠[廣東省實驗動物中心提供,合格證號SCXK(粵)2009-0015],所有動物飼養于本院動物實驗中心,飼養條件:溫度(22±1.5)℃,濕度(50±2.0)%,以12/12 h為光暗交替周期。
1.1.2 藥物 脫氫表雄酮(SIGMA公司,德國,批號:25102173);黃芪顆粒(四川百利藥業,批號:Z19993381),丹參顆粒(湖北天圣康迪藥業,批號:Z19994069)。
1.1.3 試劑與儀器 T(批號:2004121915),INS(批號:201012348)放免試劑盒,購自生物工程有限公司;RNA提取試劑盒(貨號:C11730-025),反轉錄試劑盒(貨號:DRR037A),購自美國Invitrogen公司;RT-PCR儀(Appendorf,德國,型號:SimpliAmp);實時定量PCR儀(ABI,美國,型號:QuantStudio 7)。
1.2 方法
1.2.1 分組與模型制備 60只SPF級9日齡SD雌性大鼠,按照數字隨機法分為空白組(n=10)、模型組(n=50),其中模型組大鼠接受PCOS模型制備,按俞瑾等方法建立動物模型[4],造模結束20 d后,進行陰道細胞涂片,染色干燥后,顯微鏡下觀察細胞形態的變化確定大鼠動情周期的情況。同時稱量造模后大鼠體質量,與正常組比較,以確定建模效果。將建模成功的40只大鼠隨機分為黃芪組、丹參組、聯合組以及模型組,每組10只。各組大小鼠體質量、鼠齡等方面比較差異無統計學意義(P>0.05),具有可比性。
1.2.2 干預方法 將造模成功的SD大鼠(n=40)隨機分為黃芪組、丹參組、黃芪+丹參聯合組、模型對照組4組,每組10只。第29天開始分別以黃芪0.24 g/kg體質量/d,丹參0.4 g/kg體質量/d,黃芪、丹參聯合,給予各組相應藥物,模型組及空白組大鼠予生理鹽水灌胃,1次/d,連續20 d。各組灌胃容積為20 mL/kg。
1.2.3 檢測指標與方法
1.2.3.1 血清睪酮、胰島素水平 干預后每組隨機取3只大鼠,利用10%水合氯醛腹腔麻醉后取下腔靜脈血,采用放射免疫(RIA)法測定血清中睪酮、胰島素水平,操作步驟按試劑盒說明書。
1.2.3.2 卵巢AR、INSR蛋白表達 干預結束后利用10%水合氯醛腹腔麻醉后冰上快速取出卵巢組織,按照100 mg∶ 0.5 mL裂解液的比例加入適量1%PMSF蛋白裂解液,勻漿后室溫下靜置10 min后,用BCA試劑盒測定樣本總蛋白,根據結果得出上樣量后進行電泳跑膠,轉膜,加入AR、INSR及β-actin一抗,比例均按照1∶ 1 000稀釋,再進行生物辣根過氧化酶HRP標記的二抗孵育,最后顯影、拍攝,用Image(BIO-RAD公司)的圖像處理軟件進行處理,測定各樣本灰度值。
1.2.3.3 卵巢AR、INSR mRNA表達 干預后利用10%水合氯醛腹腔麻醉后冰上快速取出卵巢組織,勻漿,按RNA trizol試劑盒說明提取總RNA,反轉錄為cDNA。引物由Takara公司合成,見表1,以β-actin為內參基因。反應體系為20 μL,SYBR Green PCR master mix(Roche)10 μL,cDNA2 μL,正反引物為1 μL。反應條件:95 ℃ 10 min。95 ℃15 s,60 ℃ 1 s,共40個循環。讀取Ct(Cycle threshold)值,采用2-△△Ct方法分析結果。引物序列如下:Β-actin上游:TGTCACCAACTGGGACGATA下游:GGGGTGTTGAAGGTCTCAAA;AR上游:AGGAGGGCAGATCCTGTCTA下游:ATCCTGCCTCCTCGTCCTCTT;INSR上游:CGGCCCGATGCTGAGAACAAC下游:CCCTTGCCCCTTTCCGATAG。
1.3 統計學方法 采用SPSS 20.0統計軟件進行數據分析。計量資料用均數±標準差(±s)描述,組間比較采用兩樣本t檢驗或兩樣本秩和檢驗;組內比較采用配對t檢驗或配對秩和檢驗。當P<0.05時,認為差異有統計學意義。
2 結果
2.1 建模效果評估 1)大鼠體質量變化:用藥后PCOS組大鼠體質量(201.2±27.5)g,明顯高于造模前(132.8±39.83)g,2者比較差異有統計學意義(P<0.05)。2)陰道細胞涂片:40只大鼠陰道涂片始終為動情間期,持續上皮角化,2只大鼠陰道涂片為不規律動情周期,示無排卵。該模型大鼠存在體質量增加、持續無排卵及雄激素增加,是較理想的PCOS動物模型。
2.2 各組血清睪酮、胰島素水平變化 與空白組比較,模型組血清睪酮及胰島素水平均明顯上升(P<0.05)。與模型組比較,黃芪組、黃芪+丹參聯合組血清睪酮水平明顯下降(P<0.05)。說明黃芪及黃芪丹參聯合用藥能降低PCOS大鼠的血清睪酮水平。與模型組比較,丹參組與聯合用藥組血清胰島素水平明顯下降(P<0.05)。說明丹參及黃芪+丹參聯用可降低血清胰島素水平。而黃芪+丹參聯用可以同時降低血清睪酮及血清胰島素水平。見表1。
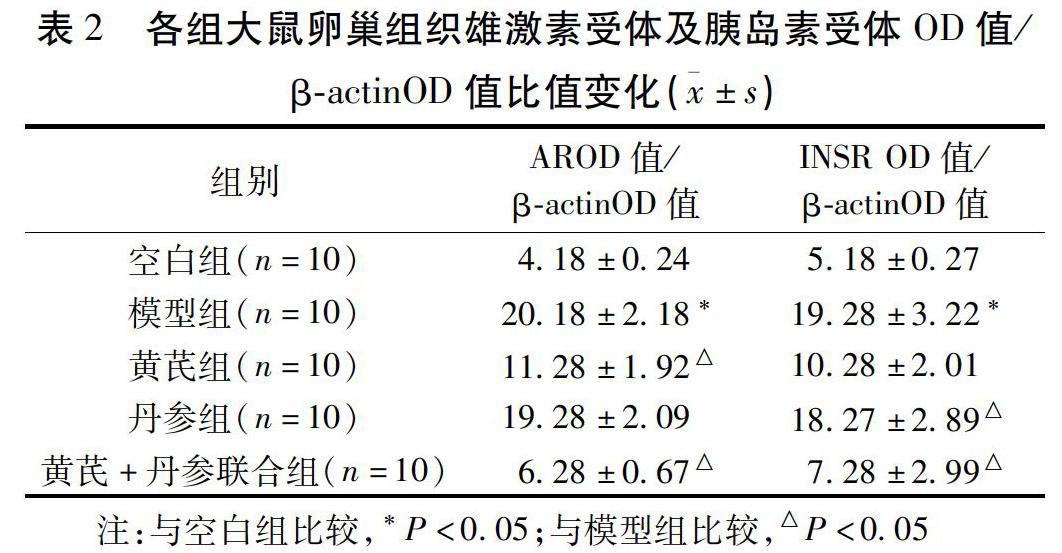
2.3 各組卵巢AR、INSR蛋白水平變化 與模型組比較,黃芪組卵巢雄激素受體蛋白水平明顯下降,丹參組卵巢胰島素受體蛋白水平明顯上升;黃芪+丹參聯合組卵巢雄激素受體蛋白水平明顯下降,同時卵巢胰島素受體蛋白水平明顯升高。見圖1,表2。
2.4 各組卵巢AR、INSR mRNA水平變化 與空白組比較,模型組卵巢AR mRNA水平明顯升高,而INSR mRNA水平明顯下降(P<0.05)。與模型組比較,黃芪組、黃芪+丹參聯合組卵巢AR mRNA表達水平明顯下降(P<0.05),說明黃芪以及黃芪+丹參聯合用藥可抑制PCOS大鼠卵巢中AR的表達。與模型組比較,丹參組及黃芪+丹參聯合組卵巢INSR mRNA表達水平明顯上升(P<0.05),說明丹參以及黃芪加丹參聯合用藥可增強卵巢INSR mRNA的表達。而黃芪加丹參聯合用藥則可抑制PCOS大鼠卵巢AR基因的表達,同時增強INSR基因的表達。見表3。
3 討論
PCOS是常見的生殖內分泌疾病,以高雄激素、胰島素抵抗為主要特征。近年來,PCOS中受體因素的作用吸引了越來越多的關注[5-7]。PCOS許多病理特征都受著AR的影響。高雄激素在女性PCOS中引起的一系列病理生理變化是通過AR實現的。研究表明:雄激素致無排卵模型動物(Androgen Sterilized Rats,ASR)的血雄激素水平升高,上調胰腺、下丘腦及卵巢AR的表達,引起該模型的高LH血癥和無排卵[8-9]。
胰島素抵抗是胰島β細胞發生代償效應的表現,是PCOS的糖脂代謝的重要原因之一。當外周組織對葡萄糖進行攝取時對胰島素的敏感度下降,隨之胰島素的相關生物效應減弱,從而引起血糖升高,應激性得導致機體所需胰島素量增加,誘發胰島β細胞分泌過量的胰島素,故血液中的胰島素水平上調,出現代償性的高胰島素血癥[10-12]。研究表明,PCOS患者卵巢顆粒細胞胰島素受體(Insulin Receptors,INSR)表達異常,可導致胰島素抵抗/高胰島素血癥,多數PCOS患者因體內激素水平產生改變,影響了脂肪代謝,出現向心性肥胖體態,這亦是PCOS的典型特征之一。有研究表明,胰島素受體表達異常是胰島素抵抗發生的重要機制,胰島素受體在PCOS體內異常降低,這與本研究結果一致,因此上調胰島素受體的水平,調節糖脂代謝是治療PCOS的關鍵[13-15]。胰島素抵抗與下丘腦-垂體-卵巢軸紊亂息息相關,而下丘腦-垂體-卵巢軸紊亂亦被認為是PCOS的病理特征,二者協同作用,最終導致雄激素上調。有研究顯示雄激素受體在竇卵泡中有大量表達,提示雄激素受體的增多影響卵泡的生長發育,同時間接說明雄激素可影響卵泡細胞停留于竇卵泡階段的時長,雄激素可能阻滯了卵泡細胞的成熟,進而導致PCOS機體生殖能力減弱,故降低雄激素是治療PCOS的關鍵[16-19]。
臨床上使用含有黃芪或丹參的方劑,有降雄激素和增加PCOS患者妊娠率的作用[20]。對32例PCOS患者聯合應用黃芪多糖和達英-35共3個月,觀察治療前后血性激素、胰島素敏感性及血脂的改變,可以有效改善PCOS患者胰島素抵抗和高雄激素狀態及血脂代謝。但以上少量的臨床觀察研究均不能解釋黃芪、丹參在PCOS中確切的作用機制。本研究發現:與正常組比較,ASR模型組血清雄激素水平和胰島素水平均明顯升高;與正常組比較,模型組卵巢中AR水平顯著升高而INSR水平顯著下降。說明ASR模型很好地模擬了PCOS的高雄激素/高胰島素的病理生理變化。分別用黃芪、丹參、黃芪+丹參聯合用藥對PCOS大鼠進行干預后,發現黃芪、黃芪及丹參聯合用藥不僅降低PCOS大鼠的高雄激素水平,也降低了其高雄激素受體mRNA水平,但單用丹參則沒有明顯的降低PCOS大鼠雄激素及雄激素受體表達的作用。丹參、黃芪+丹參聯合用藥可降低PCOS大鼠的胰島素水平,升高胰島素受體mRNA表達水平,但單用黃芪則無改善PCOS大鼠胰島素抵抗狀態的作用。
因此,黃芪和丹參聯用可改善PCOS大鼠的高雄激素血癥,其可能的作用機制是通過抑制血清雄激素水平和卵巢雄激素受體水平實現;亦可同步改善PCOS大鼠的高胰島素血癥,其可能的作用機制為通過降低胰島素水平,增強胰島素受體水平實現的。
參考文獻
[1]Nadir A,Temizkan S,Ozderya A,et al.Dehydroepiandrosterone sulfate/free androgen index ratio predicts a favorable metabolic profile in patients with polycystic ovary syndrome[J].Gynecol Endocrinol,2019,35(2):128-132.
[2]趙一鳴,劉新敏,鄭冬雪.黃芪建中湯在婦科應用驗案舉隅[J].環球中醫藥,2017,10(5):567-569.
[3]蘇靜,薛惠英,范雪琴,等.丹參酮對多囊卵巢綜合征患者糖代謝的影響[J].西北國防醫學雜志,2015,36(9):610-612.
[4]王莉,侯景文,陸利民,等.雄激素致不孕大鼠胰腺、下丘腦及卵巢雄激素受體mRNA表達[J].生殖與避孕,2004,24(1):6-8.
[5]Pasquali R.Metabolic Syndrome in Polycystic Ovary Syndrome[J].Front Horm Res,2018,49:114-130.
[6]Bednarska S,Siejka A.The Pathogenesis and Treatment of Polycystic Ovary Syndrome:What′s New? [J].Adv Clin Exp Med,2017,26(2):359-367.
[7]Szosland K,Karzkowiak A,Lewinski A.Metabolic characteristics of women diagnosed with polycystic ovary syndrome(PCOS)according to the Rotterdam criteria-our own experience[J].Neuro Endocrinol Lett,2019,39(6):434-440.
[8]Meier RK.Polycystic Ovary Syndrome[J].Nurs Clin North Am,2018,53(3):407-420.
[9]陳如楓,劉新敏.多囊卵巢綜合征胰島素抵抗動物模型構建方法的研究概況[J].世界中西醫結合雜志,2018,13(5):733-736.
[10]Abbott DH,Dumesic DA,Levine JE.Hyperandrogenic origins of polycystic ovary syndrome-implications for pathophysiology and therapy[J].Expert Rev Endocrinol Metab,2019,14(2):131-143.
[11]Tannus S,Tan J,Son WY,et al.Prevalence,clinical characteristics,and reproductive outcomes of polycystic ovary syndrome in older women referred fortertiary fertility care[J].Arch Gynecol Obstet,2018,297(4):1037-1042.
[12]Lee MH,Yoon JA,Kim HR,et al.Hyperandrogenic Milieu Dysregulates the Expression of Insulin Signaling Factors and Glucose Transporters in the Endometrium of Patients with Polycystic Ovary Syndrome[J].Reprod Sci,2020,27(8):1637-1647.
[13]Rajska A,Buszewska-Forajta M,Rachoń D,et al.Metabolomic Insight into Polycystic Ovary Syndrome-An Overview[J].Int J Mol Sci,2020,21(14):121-124.
[14]Shaaban Z,Khoradmehr A,Jafarzadeh Shirazi MR,et al.Pathophysiological mechanisms of gonadotropins-and steroid hormones-related genes in etiology of polycystic ovary syndrome[J].Iran J Basic Med Sci,2019,22(1):3-16.
[15]He FF,Li YM.Role of gut microbiota in the development of insulin resistance and the mechanism underlying polycystic ovary syndrome:a review[J].J Ovarian Res,2020,13(1):73.
[16]賴毛華,馬紅霞,宋興華.電針結合克羅米芬對多囊卵巢綜合征大鼠子宮內膜胰島素受體和胰島素受體底物1蛋白表達及胚泡著床的影響[J].針刺研究,2016,41(5):435-439.
[17]林少梅,邢彥君,劉佩姬.雄激素受體對多囊卵巢綜合征患者生育能力的影響[J].汕頭大學醫學院學報,2019,32(1):28-30.
[18]徐鴿,王茜,張安冬,等.電針不同穴位對多囊卵巢綜合征大鼠高雄激素血癥及卵巢雄激素受體表達的影響[J].針刺研究,2018,43(9):543-549.
[19]林少梅.雄激素受體在多囊卵巢綜合征卵巢中表達特征的分析[J].實用中西醫結合臨床,2018,18(8):149-150.
[20]趙虹.黃芪丹參為主治療高雄激素血癥的效果觀察[J].現代中西醫結合雜志,2005,14(4):466.
(2019-05-17收稿 責任編輯:芮莉莉)

