體外模擬胃腸消化及堿性蛋白酶處理后蛋清肽抗氧化活性差異及肽序列解析
馬思彤,劉靜波,張 婷,王 瑩,孫惠炎,魏以恒,王寒穎,雷洪輝,劉博群,*
(1.吉林省營養與功能食品重點實驗室,吉林 長春 130062;2.吉林大學食品科學與工程學院,吉林 長春 130062;3.吉林工程技術師范學院食品工程學院,吉林 長春 130052)
我國是世界上雞蛋的生產和消費大國,蛋品產業在國民經濟中占有重要地位[1]。盡管中國的禽蛋產業在不斷發展,但蛋品行業仍然存在諸多問題,例如,產品形式還是以傳統殼蛋為主,深加工程度低,導致我國蛋品產業附加值不高,經濟效益低。近幾年來,諸多研究成果表明功能蛋白及蛋白肽往往具有極其重要的生物活性,尤其是功能蛋白水解后得到的活性肽片段,對機體功能環境有重要作用。
研究發現,人體內氧自由基的產生與消除失去平衡時,多余的氧自由基會導致細胞損傷,進而引起衰老、癌癥等疾病[2-3]。已有大量研究表明,通過酶解得到的多肽具有很好的抗氧化活性,能有效清除體內多余自由基[4],且與傳統的化學合成物作為主要來源的抗氧化劑相比,天然來源的抗氧化肽具有較好的抗氧化活性且對人體無害。因此,天然多肽將會成為越來越多消費者的選擇[5]。
蛋清蛋白作為優質的蛋白質來源,通過口服的方式進入人體,在胃和腸道中進行轉化。有研究表明,胃和腸道中的蛋白酶、pH值等均會影響蛋白質在人體胃腸道中的吸收與釋放[6]。佟曉紅等[7]研究發現體外模擬消化能夠提升大豆蛋白酶解物的抗氧化活性。趙楠[8]也發現體外模擬消化能一定程度上提升松仁蛋白的抗氧化活性。雖然人體自身的蛋白酶能夠一定程度上水解蛋白質,使其發揮生物活性。但即使是同一蛋白質,在不同的酶解方式、pH值或無機鹽環境中,都會水解出不同種類的肽段[9]。因此,本研究通過對比堿性蛋白酶酶解及體外模擬胃腸消化2 種方式處理蛋清蛋白后水解物的抗氧化活性差異,明確蛋白質深加工對于蛋清肽抗氧化活性的影響,以期為蛋品深加工的方法和意義提供一定的實驗依據。
1 材料與方法
1.1 材料與試劑
蛋清蛋白粉 吉林金翼蛋品有限公司;HepG2細胞 中國科學院上海生命科學研究院細胞庫;DMEM高糖培養基、胎牛血清、磷酸鹽緩沖液(phosphate buffered saline,PBS)、胰蛋白酶-EDTA 美國Gibco公司;堿性蛋白酶Alcalase 丹麥諾維信生物技術有限公司;胃蛋白酶、胰液 美國Genview Scientific公司;乙腈、甲酸(色譜純) 美國Thermo Fisher Scientific公司;水溶性VE(Trolox)、2,2’-聯氮-雙-3-乙基苯并噻唑啉-6-磺酸(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)、2,2-偶氮二(2-甲基丙基咪)二鹽酸鹽(2,2’-azobis(2-methyl-propanimidamide)dihydrochloride,AAPH) 美國Sigma公司;MTS單細胞溶液增殖檢測試劑盒 美國Promega公司;細胞內活性氧(reactive oxygen species,ROS)檢測試劑盒上海碧云天生物技術有限公司;H2O2、熒光素鈉 天津化學有限公司。
1.2 儀器與設備
多功能酶標儀 美國伯騰儀器有限公司;膜分離裝置 美國Millipore公司;EASY-nLC 1000超高效液相色譜-串聯質譜(ultra performance liquid chromatography/tandem mass spectrometry,UPLC-MS/MS) 美國Thermo公司;細胞培養箱 上海力申科學儀器有限公司;移液槍 德國Eppendorf公司;培養皿、離心管及96 孔板 美國Corning公司。
1.3 方法
1.3.1 蛋清肽的制備
1.3.1.1 堿性蛋白酶酶解
參照Wang Liying等[10]的方法并稍作修改。稱取100 g蛋清蛋白粉,加入2 L蒸餾水配制成質量分數5%的蛋清蛋白溶液。將溶液在90 ℃下水浴10 min,使蛋白質發生變性裂解,然后降溫至50 ℃。用1 mol/L NaOH溶液將體系的pH值調至10,加入質量分數4%的堿性蛋白酶Alcalase,保持溫度50 ℃、pH 10持續酶解3 h。之后將體系沸水浴10 min滅活蛋白酶,冷卻至室溫,用1 mol/L的HCl溶液將體系的pH值調整為7(后續將用來處理細胞)。將酶解液離心,在4 ℃下10 000 r/min離心10 min,收集上清液,-20 ℃貯存備用。
1.3.1.2 體外模擬胃腸消化
參照Alting等[11]報道的方法并稍作修改。稱取20 g蛋清蛋白粉,加入2 L蒸餾水配制成質量分數1%的蛋清蛋白溶液。按1∶50(m/m)加入胃蛋白酶((EC 3.4.23.1),來源于豬胃黏膜,酶活力為3 000 U/mg),用1 mol/L的HCl溶液將pH值調至2,保持體系溫度在37 ℃,持續酶解90 min。用1 mol/L的NaOH溶液調pH值至7,按1∶25(m/m)加入胰液((EC 3.4.21.4),來源于豬胰腺,酶活力為250 U/mg),保持溫度3 7 ℃和p H 7,持續酶解4 h。將體系沸水浴10 min滅活蛋白酶,冷卻至室溫。將酶解液在4 ℃下10 000 r/min離心10 min,收集上清液,-20 ℃貯存備用。
1.3.2 蛋清肽的分離純化
將酶解上清液用截留分子質量為1、3 kDa和10 kDa的超濾膜進行分離,收集分子質量小于1 kDa、1~3 kDa和3~10 kDa的蛋清肽組分,真空冷凍干燥后置于-20 ℃干燥保存備用。
1.3.3 蛋清肽的ABTS陽離子自由基清除能力測定
取ABTS 10 mg溶于2.6 mL蒸餾水中配制為7 mmol/L的ABTS溶液,取3.45 mg過硫酸鉀溶于2.6 mL蒸餾水中配制成2.45 mmol/L的過硫酸鉀溶液,將兩者按體積比1∶1混合配制為ABTS儲備液,使用前在37 ℃下避光靜置12 h后,用0.2 mol/L pH 7.4的PBS稀釋ABTS儲備液(20~30 倍),使其在734 nm波長處的吸光度為0.70±0.02,配制為ABTS工作液,現用現配。實驗分組如下:1)空白組:每孔加入200 μL PBS;2)對照組:每孔加入180 μL ABTS工作液和20 μL PBS;3)實驗組:每孔加入180 μL ABTS工作液和20 μL樣品溶液(終質量濃度分別為0.50、1.00、5.00、10.00 μg/mL),設置3 個復孔。在96 孔板中,按照上述實驗分組加入ABTS工作液、樣品溶液以及PBS,振蕩10 s混勻后在37 ℃下靜置反應5 min,在734 nm波長處測定反應體系的吸光度。ABTS陽離子自由基清除率按式(1)計算。
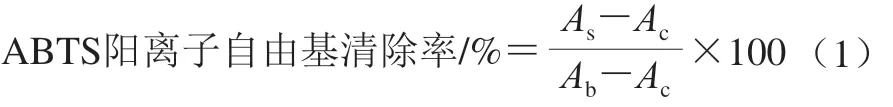
式中:As、Ab、Ac分別為實驗組、空白組、對照組的吸光度。
1.3.4 蛋清肽的氧自由基吸收能力測定
氧自由基吸收能力(oxygen radical absorbance capacity,ORAC)測定參考Zheng Lin等[12]的方法并略作修改。以75 mmol/L PBS(pH 7.4)為溶劑,分別配制熒光素鈉溶液(終濃度為70 nmol/L)、AAPH溶液(終濃度為12 mmol/L)和樣品溶液(終質量濃度為10 μg/mL),Trolox溶液設置為陽性對照(終質量濃度為10 μg/mL)。實驗分組如下:1)空白組:每孔加入120 μL熒光素鈉溶液和20 μL PBS;2)陽性對照組:每孔加入120 μL熒光素鈉溶液和20 μL Trolox溶液;3)實驗組:每孔加入120 μL熒光素鈉溶液和20 μL樣品溶液,設置3 個復孔。在黑色96 孔板中,按照上述實驗分組加入熒光素鈉溶液、樣品溶液、Trolox溶液以及PBS,振蕩10 s混勻后在37 ℃下靜置預熱2 min,然后每孔中快速加入60 μL AAPH溶液啟動反應,立即將黑色96 孔板放入酶標儀中。反應體系在37 ℃下檢測,相鄰兩個測定點之間的時間間隔設置為2 min,每次讀數前振板2 s,連續測定180 min(熒光衰減趨于穩定為止)。設置酶標儀的激發波長為485 nm,發射波長為520 nm。樣品的抗氧化能力與AAPH自由基作用下熒光衰退曲線的延緩部分面積直接相關。
1.3.5 細胞培養
HepG2細胞培養基配方為:88%(體積分數,下同)DMEM高糖培養基、10%胎牛血清、1%非必需氨基酸和1%雙抗。培養箱內環境保持在37 ℃和5% CO2,細胞每周傳代2~3 次,日常視情況更換培養基。待細胞呈對數生長時進行后續實驗。
1.3.6 HepG2細胞氧化損傷模型的建立
細胞存活率的檢測采用單溶液細胞增殖檢測試劑盒,即MTS法[13]。
在96 孔板中接種HepG2細胞,密度為1.0×104cells/mL,每孔加入80 μL細胞懸液。在培養箱中培養12 h后,每孔中加入10 μL DMEM培養基孵育12 h。再按照實驗分組分別加入H2O2和DMEM培養基孵育6 h后,每孔加入20 μL MTS孵育1~4 h,在490 nm波長處測定96 孔板的吸光度。
實驗分組設置如下:1)空白組:每孔加入100 μL DMEM培養基;2)對照組:每孔加入80 μL細胞懸液和20 μL DMEM培養基;3)實驗組:每孔加入80 μL細胞懸液、10 μL DMEM培養基和10 μL H2O2溶液(終濃度為200、300、400、500、600、700 μmol/L),設置6 個復孔。細胞相對存活率按式(2)計算。

式中:As、Ab、Ac分別為實驗組、空白組、對照組的吸光度。
1.3.7 蛋清肽對H2O2誘導氧化損傷的HepG2細胞的保護作用
在96 孔板中接種HepG2細胞,密度為1.0×104cells/mL,每孔加入80 μL細胞懸液。在培養箱中培養12 h后,每孔中加入10 μL DMEM培養基或者蛋清肽溶液孵育12 h。再按照實驗分組分別加入DMEM培養基或者H2O2孵育6 h后,每孔加入20 μL MTS孵育1~4 h,在490 nm波長處測定96 孔板樣品的吸光度。
實驗分組設置如下:1)空白組:每孔加入100 μL DMEM培養基;2)對照組:每孔加入80 μL細胞懸液和20 μL DMEM培養基;3)損傷組:每孔加入80 μL細胞懸液、10 μL DMEM培養基和10 μL H2O2溶液(終濃度為500 μmol/L);4)陽性對照組:每孔加入80 μL細胞懸液、10 μL蛋清肽溶液(終質量濃度分別為0.01、0.1、1 mg/mL)和10 μL DMEM培養基;5)實驗組:每孔加入80 μL細胞懸液、10 μL蛋清肽溶液(終質量濃度分別為0.01、0.1、1 mg/mL)和10 μL H2O2溶液(終濃度為500 μmol/L),設置6 個復孔。
1.3.8 細胞內ROS水平的檢測
按試劑盒說明書進行ROS水平檢測。
1.3.9 蛋清源多肽的氨基酸序列鑒定
1.3.9.1 樣品前處理蛋清肽通過葡聚糖凝膠色譜柱(G15)脫鹽后冷凍干燥,用于UPLC-MS/MS分析。
1.3.9.2 色譜條件
流動相A:0.1%甲酸溶于2%乙腈;流動相B:0.1%甲酸溶于98%乙腈。洗脫程序:0~16 min,流動相B 5%~23%;16~22 min,流動相B 23%~35%;22~27 min,流動相B 35%~80%;27~30 min,流動相B保持80%。流速:0.4 mL/min;進樣量:10 μL。
1.3.9.3 質譜條件
離子源:電噴霧離子化;掃描模式:正離子模式;裂解電壓:120 V;碰撞電壓:20 V;質量掃描范圍m/z 50~1 000。
1.3.10 純肽合成
通過高效液相色譜-串聯質譜解析出混合多肽的序列,以此為依據通過固相合成制備純肽,純肽合成工作委托生工生物工程(上海)股份有限公司進行,純度達到98%以上。
1.3.11 純肽的ABTS陽離子自由基清除能力測定
方法同1.3.3節。
1.3.12 純肽的ORAC測定
方法同1.3.4節。
1.4 數據統計分析
2 結果與分析
2.1 蛋清肽ABTS陽離子自由基清除能力的變化
ABTS陽離子自由基清除能力的測定因其快捷、高效、可信度高,被廣泛應用于評價水溶性物質的抗氧化活性[14]。如圖1所示,未經處理的蛋清蛋白ABTS陽離子自由基清除能力很差,在經過堿性蛋白酶酶解或者體外模擬胃腸消化后的蛋清蛋白被分解為多肽或者氨基酸,活性基團得以暴露;因此,在同一質量濃度條件下,和未經處理的蛋清蛋白相比,處理后的蛋清肽ABTS陽離子自由基清除能力都得到提高,其中分子質量小于1 kDa的蛋清肽抗氧化活性高于其他分子質量的組分,隨著分子質量的增大,蛋清肽的抗氧化活性減弱。這一結果與遲玉杰等[15]的研究一致,其研究發現,蛋清肽分子質量越小,其抗氧化活性越強。同時,蛋清肽質量濃度越高,抗氧化活性越強,這也與圖1結果相對應。除此之外,在同一質量濃度下,不同處理方式得到的蛋清肽抗氧化能力也有顯著差異。實驗發現,堿性蛋白酶酶解物的抗氧化活性普遍優于體外模擬胃腸消化產物,其中分子質量小于1 kDa的堿性蛋白酶酶解物的抗氧化活性顯著高于其他組分(P<0.05)。這可能是由于堿性蛋白酶酶解處理后的蛋清肽暴露出的活性位點更多,蛋清肽可能作為氫供體、自由基穩定劑等方式來抑制過氧化作用。占今舜等[16]用不同酶解方法處理的蛋清肽改善小鼠血清生化指標和肝臟抗氧化能力,并發現Alcalase水解物效果最好。Zheng Zhaojun等[17]研究發現黑豆的菠蘿蛋白酶和堿性蛋白酶酶解產物抗氧化活性好于其他酶酶解產物。

圖1 蛋清肽的ABTS陽離子自由基清除能力Fig. 1 ABTS radical cation scavenging properties of egg white peptides
2.2 蛋清肽氧自由基吸收能力的變化
由于氧自由基吸收能力可以直接反映抗氧化劑阻斷自由基鏈式反應的能力,被認為是最接近人體生理系統真實反應情況的實驗方法[18]。ORAC反應是典型的基于氫原子轉移機制的氧化過程,氫原子轉移是自由基鏈式反應中的關鍵步驟,反應后會形成更加穩定的自由基[19]。

圖2 蛋清肽的氧自由基吸收能力Fig. 2 Oxygen radical absorption capacity of egg white peptides
圖2 表示蛋清肽在質量濃度為10 μg/mL時的熒光衰退曲線,在對照組(PBS代替抗氧化劑)中,熒光衰減最快,實驗組熒光衰減較對照組均放緩,說明蛋清肽都有抗氧化活性。其中,分子質量小于1 kDa堿性蛋白酶酶解物抗氧化活性最強,同ABTS陽離子自由基清除能力的結果一致。Trolox屬于VE的水溶性類似物,是一種常用的抗氧化劑和自由基清除劑,在這里被用作陽性對照,可以看出和Trolox相比,蛋清肽的抗氧化活性仍存在一定差距。
分別計算蛋清肽的ORAC,分子質量小于1 kDa堿性蛋白酶酶解物的ORAC最高,為(0.399±0.180)μg/mL,其次是分子質量小于1 kDa體外模擬胃腸消化產物((0.34±0.05)μg/mL),分子質量1~3 kDa的堿性蛋白酶酶解物和體外模擬胃腸消化產物的ORAC分別為(0.31±0.13)μg/mL和(0.21±0.11)μg/mL,未經處理的蛋清蛋白與3~10 kDa體外模擬胃腸消化產物活性接近。
2.3 HepG2細胞氧化損傷模型的建立
H2O2可誘導細胞氧化損傷,刺激細胞內ROS的生成,打破細胞內氧化還原反應平衡,從而增強細胞氧化應激,最終可導致細胞損傷和凋亡[20]。
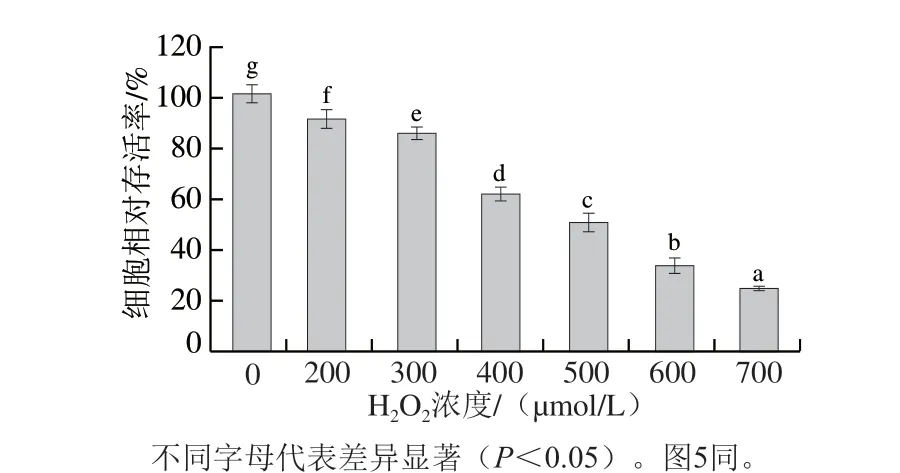
圖3 不同濃度H2O2對HepG2細胞相對存活率的影響Fig. 3 Effect of H2O2 concentration on survival rate of HepG2 cells
由圖3可知,隨H2O2濃度的升高,HepG2細胞的相對存活率降低,即氧化損傷作用越強。當H2O2的終濃度為500 μmol/L時HepG2細胞的相對存活率為(49.96±0.04)%,不同H2O2濃度之間的細胞存活率均有顯著差異(P<0.05),因此選擇500 μmol/L的H2O2建立HepG2細胞氧化損傷模型,用于后續實驗。
2.4 蛋清肽對HepG2細胞氧化損傷的影響
如圖4所示,在500 μmol/L的H2O2作用下,分子質量小于1 kDa的堿性蛋白酶酶解物活性最高,幾乎可以保護細胞免受氧化應激損傷,中質量濃度組及高質量濃度組和對照組相比無顯著差異(P>0.05),細胞相對存活率分別為(96.62±0.05)%和(102.87±0.08)%。分子質量3~10 kDa的體外模擬胃腸消化產物活性最弱,與損傷組相比各質量濃度均無顯著差異(P>0.05),這可能是由于該組分蛋清肽分子質量較大,難以被細胞吸收利用。其他組分蛋清肽和損傷組相比均有顯著差異,說明不同組分蛋清肽均能不同程度上對細胞氧化損傷有保護作用,且堿性蛋白酶酶解物的活性優于體外模擬胃腸消化產物。可能是因為堿性蛋白酶酶解物能夠一定程度上彌補人體無法通過自身消化產生的肽段,且肽段種類更多,從而在細胞內有更高的活性。除了處理方式對蛋清肽活性有影響外,蛋清肽質量濃度也會影響蛋清肽活性,蛋清肽質量濃度越高,蛋清肽的活性越強。He Ying等也曾發現鴨胚胎肽的堿性蛋白酶酶解物能夠保護HepG2細胞免受H2O2誘導的氧化應激損傷[21]。
為排除蛋清肽毒性作用的影響,在未加H2O2損傷的情況下,檢測最高質量濃度(1 mg/mL)蛋清肽對HepG2細胞生長的影響,實驗組和對照組細胞相比存活率均無顯著性差異(P>0.05),說明蛋清肽本身對HepG2細胞無毒副作用。排除高質量濃度蛋清肽刺激細胞的可能性后,蛋清肽對HepG2細胞氧化損傷具有一定的保護作用,可能是通過抑制氧化應激實現的。
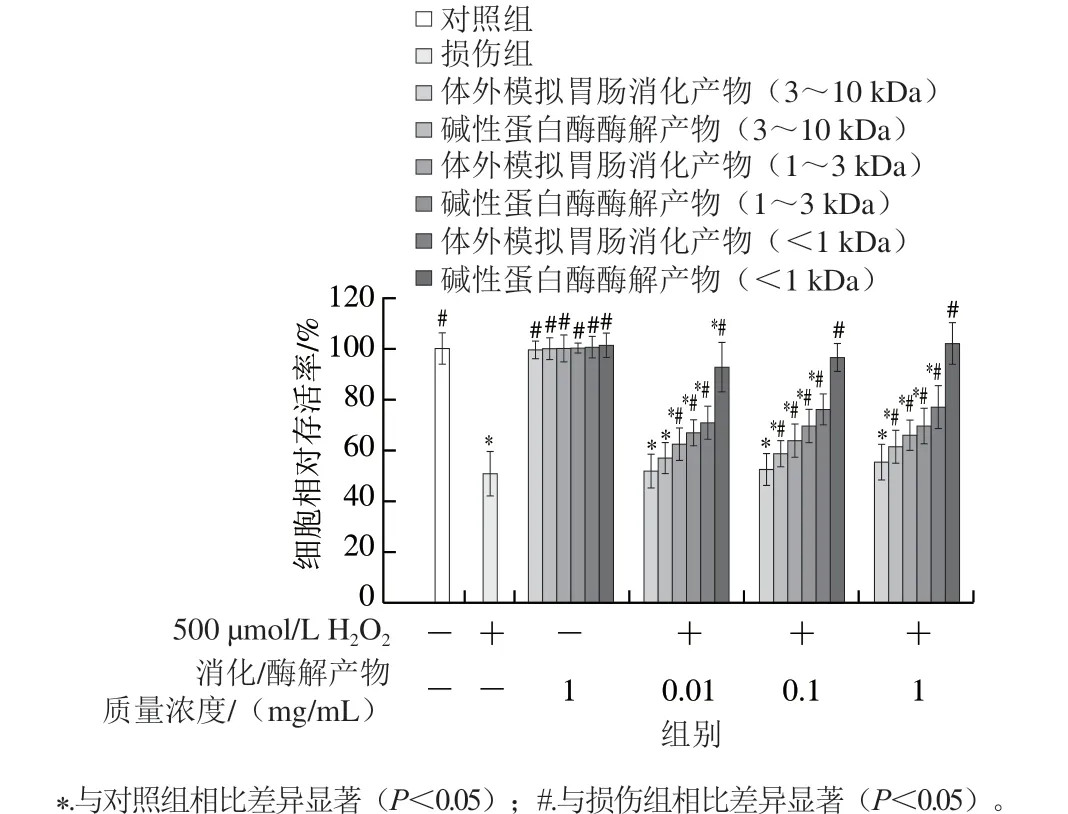
圖4 蛋清肽對HepG2細胞相對存活率的影響Fig. 4 Effect of egg white peptides on survival rate of HepG2 cells exposed to H2O2
2.5 蛋清肽的細胞內ROS清除活性
二 氯 二 氫 熒 光 素 - 乙 酰 乙 酸 酯(2’,7’-dichlorofluorescin diacetate,DCFH-DA)是一種自身沒有熒光且可以自由穿透細胞膜的熒光染料。細胞內ROS將非熒光的DCFH-DA氧化為熒光的2’,7’-二氯熒光素(2’,7’-dichlorofluorescein,DCF)。通過檢測DCF的熒光強度,可以得到細胞內ROS的水平,即DCF熒光強度越強,細胞內ROS水平越高[22]。如圖5所示,H2O2處理后,HepG2細胞內DCF熒光強度顯著增強(P<0.05),大約是對照組的3 倍,表明H2O2誘導HepG2細胞內產生大量ROS。經過蛋清肽預處理的HepG2細胞內ROS水平有不同程度的減少,且呈濃度依賴性。其中分子質量小于1 kDa的蛋清肽和損傷組相比細胞內ROS水平顯著降低(P<0.05),尤其是分子質量小于1 kDa的堿性蛋白酶酶解物,即使在低質量濃度(0.01 mg/mL)下也能很好地抑制ROS對HepG2細胞的損傷,該組分的DCF熒光強度和對照組相比無顯著差異,好于體外模擬胃腸消化產物活性。Yarnpakdee[23]和Zha Fengchao[24]等的研究顯示,從蝦和羅非魚中提取的抗氧化肽也具有清除HepG2細胞內ROS的作用。
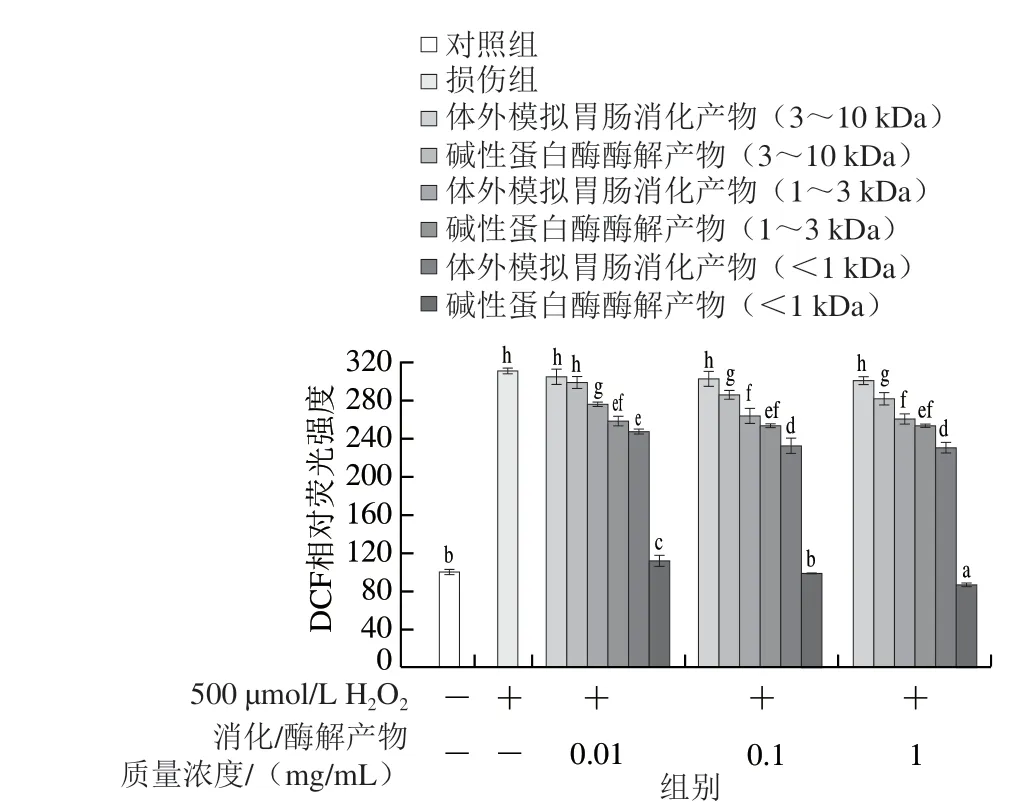
圖5 蛋清肽對H2O2誘導的氧化損傷HepG2細胞內ROS水平的影響Fig. 5 Effect of egg white peptides on intracellular ROS in HepG2 cells with H2O2-induced oxidative damage
2.6 UPLC-MS/MS鑒定蛋清肽的序列
分析對比不同處理方式得到的蛋清肽抗氧化活性后,發現分子質量小于1 kDa的堿性蛋白酶酶解產物具有較高的抗氧化活性,因此利用質譜方法分析該組分蛋清肽的序列,用于后續研究。為了得到蛋清源抗氧化肽的氨基酸序列,根據Zhang Binying等[25]的報道,使用從頭測序的方法解析未知多肽的二級MS碎片信息,從而確定多肽的氨基酸序列。多肽一般在電噴霧離子源條件下發生質子化,當碰撞能量低于200 eV時,多肽大多在酰胺鍵位置斷裂,形成b離子和y離子,因此,MS/MS碎片離子主要為b離子和y離子[26]。


圖6 蛋清肽鑒定的二級質譜圖Fig. 6 Tandem mass spectra of identified egg white peptides
如圖6所示,解析分子質量小于1 kDa的堿性蛋白酶酶解產物得到四肽FYCP、YCPI、YLPR。這3 條多肽都是源于蛋清蛋白中含量最高的卵白蛋白,其中YLPR曾被Ayako等[27]證明具有減緩小鼠焦慮的活性。
2.7 蛋清源活性肽的ABTS陽離子自由基清除能力
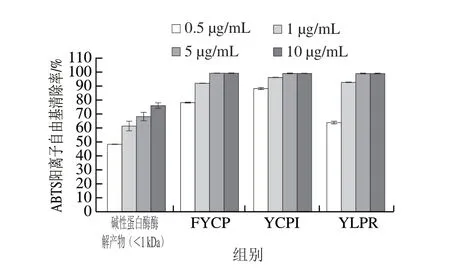
圖7 蛋清源活性肽的ABTS陽離子自由基清除能力Fig. 7 ABTS radical cation scavenging properties of bioactive peptides from egg white proteins
為驗證從分子質量小于1 kDa的堿性蛋白酶酶解物中解析出的3 條多肽FYCP、YCPI、YLPR的抗氧化活性,對這3 條肽的ABTS陽離子自由基清除能力進行測定,并與分子質量小于1 kDa的堿性蛋白酶酶解產物進行比較。如圖7所示,3 條多肽的抗氧化活性都明顯優于分子質量小于1 kDa的堿性蛋白酶酶解產物,當多肽質量濃度達到5 μg/mL時就能完全清除ABTS陽離子自由基,且FYCP和YCPI的抗氧化活性不相上下。這3 條多肽中均含有Tyr和Pro,這類氨基酸的吲哚基和苯環可供氫,因此具有良好的ABTS陽離子自由基清除能力。Hernández-Ledesma等[28]從發酵乳中提取抗氧化肽,并得出類似的結論。
2.8 蛋清源活性肽的氧自由基吸收能力
圖8顯示了3 種多肽和分子質量小于1 kDa的堿性蛋白酶酶解物氧自由基吸收能力測定的熒光衰退曲線,可以看到FYCP的活性最強,ORAC為(2.42±0.13)μg/mL,其次是YCPI,ORAC為(2.04±0.19)μg/mL。這兩條肽的抗氧化活性都要高于陽性對照Trolox,遠遠高于分子質量小于1 kDa的堿性蛋白酶酶解物((0.399±0.180)μg/mL)。但與ABTS陽離子自由基清除能力的結果不同,YLPR的氧自由基吸收能力(ORAC為(0.24±0.16)μg/mL)弱于分子質量小于1 kDa的堿性蛋白酶酶解物。這種差異可能是由于兩種測定方法的作用機制不同,ORAC法是基于氫原子轉移機制[29];ABTS陽離子自由基清除能力的測定是根據被氧化的ABTS變為藍綠色的ABTS陽離子,當被測樣品具有抗氧化活性時,顏色減褪。此外,Zhang Deju等[30]的研究中顯示,Cys在20 種氨基酸中抗氧化活性最高,在氧自由基吸收能力中發揮重要作用。3 種多肽同樣含有Tyr和Pro,但YLPR不含Cys,這可能是YLPR的氧自由基吸收能力小于FYCP和YCPI的原因。
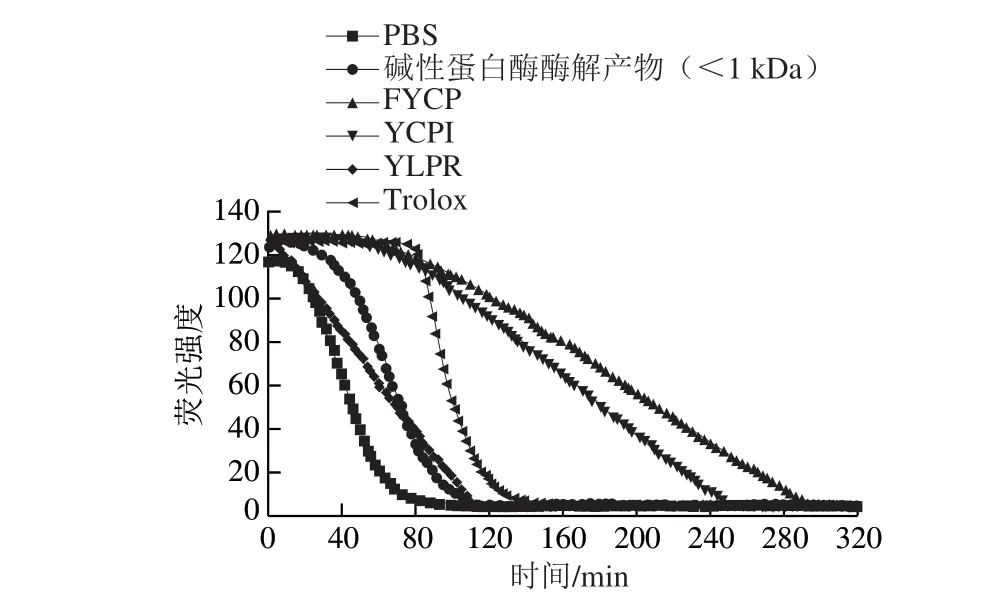
圖8 蛋清源活性肽的氧自由基吸收能力Fig. 8 Oxygen radical absorption capacity of bioactive peptides from egg white proteins
3 結 論
通過對比堿性蛋白酶及體外模擬胃腸消化處理后蛋清肽抗氧化活性差異,堿性蛋白酶酶解物的抗氧化活性最強,其次是體外模擬胃腸消化產物,未經處理的蛋清蛋白抗氧化活性十分微弱,這表明,對蛋清蛋白進行深加工可能有更高的生物活性和經濟價值。此外,蛋清肽的抗氧化活性還與其分子質量和濃度密切相關,小分子質量高濃度的蛋清肽具有更強的抗氧化活性。其中分子質量小于1 kDa的堿性蛋白酶解物能夠有效抑制H2O2誘導的HepG2細胞內ROS的產生,進而阻止細胞的氧化應激損傷和凋亡。利用UPLC-MS/MS從該組蛋清源活性肽中解析出3 條四肽FYCP、YCPI、YLPR,均具有良好的抗氧化活性。以上研究結果在一定程度上說明了蛋白質深加工的重要性,并為蛋清源生物活性肽的抗氧化活性研究提供了一定的參考。

