益生菌對促進腸道發育作用的研究進展
關嘉琦,李柏良,焦雯姝,李慧臻,岳瑩雪,李 娜,史佳鷺,趙 莉,霍貴成
(東北農業大學 乳品科學教育部重點實驗室,黑龍江 哈爾濱 150030)
人與動物的腸道是一個營養豐富的環境,由大量復雜的微生物聚集而成,其中包括大量益生菌。益生菌是定植在宿主體內,可改變宿主某一部位菌群組成的一類對宿主有益的活性微生物;其是通過調節宿主黏膜與系統免疫功能或通過調節腸道內菌群平衡,促進營養吸收保持腸道健康的作用,從而產生有利于宿主健康作用的單一微生物或組成明確的混合微生物[1]。近年來,人們對益生菌功能的研究日益深入,有關益生菌對宿主的作用、益生菌調節腸道生理功能、益生菌與腸道黏膜免疫關系、益生菌在調節腸道微生態菌群平衡中的作用等方面已有大量相關綜述報道,而關于益生菌通過影響腸道細胞增殖、腸道屏障成熟而促進腸道發育及其作用機制則成為日前研究新熱點。研究表明,某些雙歧桿菌的胞外蛋白、益生菌代謝產物丁酸及其鹽類[2]、益生菌細胞壁中肽聚糖的水解產物胞壁酰二肽(muramyldipeptide,MDP)[3]等可參與維持腸道良好形態、干預腸道細胞增殖分化、調節腸道上皮緊密連接的合成,從而促進腸道成熟、修復應激損傷[4]。越來越多的研究表明,益生菌在動物早期腸道發育、免疫系統分化、上皮細胞增殖等腸道生長發育過程中發揮作用[5]。例如,Suo Cheng等從嬰兒糞便中分離得到植物乳桿菌(Lactobacillus plantarum)ZJ316,發現其可以提高斷奶仔豬回腸、空腸和十二指腸絨毛高度;停止Lactobacillus plantarum ZJ316處理1 周后,十二指腸絨毛高度和空腸隱窩深度顯著增加,這表明Lactobacillus plantarum ZJ316可促進仔豬的腸道生長發育[6]。王世杰等通過動物實驗證實,生長發育早期應用副干酪乳桿菌(Lactobacillus paracasei)N1115可促腸上皮細胞增殖分化,使緊密連接結構完整、正常發揮腸道黏膜作用[7]。楊鳳娟等發現灌喂羅伊氏乳桿菌(Lactobacillus reuteri)I5007的新生仔豬十二指腸絨毛高度顯著提高,腸上皮細胞緊密連接蛋白的表達上調[8]。基因水平的研究表明,一些乳酸菌如植物乳桿菌(Lactobacillus plantarum)MB452,可使編碼Occludin和細胞骨架等基因的表達量發生改變[9]。Resta-Lenert等研究發現,嗜酸乳桿菌(Lactobacillus acidophilus)和嗜熱鏈球菌(Streptococcus thermophilus)可提高磷酸肌醇3激酶(phosphatidylinositol 3-kinase,PI3K)信號分子通路、胞外調節蛋白激酶(extracellular regulated protein kinases,ERK)、p38、c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)活力,上調Occludin和ZO-1蛋白磷酸化表達量,增強Caco-2、HT-29細胞的屏障功能[10]。由此可見,腸道內益生菌對于動物腸道發育具有積極的調控作用。
1 益生菌對腸道發育的干預機制
腸是成年哺乳動物自我更新最快的組織,在小鼠體內,腸道上皮在3~5 d內即完成自我更新[11]。腸道上皮由隱窩和絨毛組成[12],是構成黏膜層的主要部分。腸腔結構如圖1所示[13],隱窩柱狀細胞散布在腸隱窩的潘氏細胞之間,位于4位置的標記保留細胞是較不活躍的干細胞。腸道干細胞(intestinal stem cells,ISCs)可自我更新或生成瞬時擴增(transit amplifying,TA)細胞,再增殖分化為不同種類的腸上皮細胞[14]。腸上皮是實現機體對抗原的免疫抵抗、營養物質的消化吸收、完成首過代謝等的場所,其穩態由許多因素共同維持,例如腸內營養、干細胞巢、內分泌系統、微生物代謝產物等協同調節ISCs分化[15]。上皮細胞的分化有利于修復應激造成的損傷、發揮腸道屏障(生物屏障、化學屏障、機械屏障等)作用[16]。核抗原(Ki67)被認為是分裂細胞核的代表物,因此實驗中常使用其陽性染色細胞的表達量來指示細胞的分化程度[17]。

圖1 腸腔結構[13]Fig. 1 Intestinal cavity structure[13]
1.1 益生菌對腸細胞增殖分化通路的調控
ISCs處于一個極其復雜的微環境之中,一些經典通路如Wnt通路、Notch通路和骨形態發生蛋白(bone morphogenetic protein,BMP)通路等對ISCs的分化及自我更新發揮協同調控作用[18-20]。BMP信號限制了隱窩的數量[21]。Wnt信號通路在動物間存在遺傳學上的高度保守性,不同的動物物種間極為相似。Wnt蛋白是影響ISCs增殖的關鍵因素,是控制細胞沿絨毛軸遷移的首要力量,由隱窩上皮細胞表達[22]。
有研究證實,益生菌可通過調控Wnt與Notch信號通路實現lgr5+干細胞定向分化(圖2)。若同時激活上述兩種信號可使干細胞自我增殖;同時被抑制則定向誘導杯狀細胞分化。定向誘導腸上皮細胞分化需要激活Notch通路、阻遏Wnt通路,反之則分化為潘氏細胞,而內分泌細胞分化與Wnt通路無顯著聯系,只需抑制Notch信號通路[23]。當Wnt通路靠近ISCs,與細胞膜表面的卷曲受體蛋白及其輔助受體低密度脂蛋白受體5/6結合后,可使腺瘤性息肉病基因蛋白破壞復合物的聚集結構分散,保護β-聯蛋白不因發生磷酸化而被降解。β-聯蛋白隨后轉位進入核內,結合T細胞因子4,使靶基因起始轉錄,從而促進增殖分化[11,15]。而Xie Shuang等最新研究得到了不同結論,他發現Lactobacillus reuteri 22可提高lgr5+的mRNA表達量并活化上述Wnt/β-聯蛋白信號傳導途徑,增加增殖細胞核抗原的表達,從而促進雞的小腸上皮細胞增殖。此外,Lactobacillus reuteri 22還抑制了Notch信號通路,誘導ISCs分化為杯狀細胞,提高黏蛋白2表達量。這項研究表明,乳桿菌可以調控肉雞腸上皮細胞的發育,以確保腸道黏膜屏障功能[24]。

圖2 Wnt和Notch途徑協同控制ISCs的自我更新和分化模型[23]Fig. 2 Model for cooperative control of ISC self-renewal and differentiation by Wnt and Notch signal pathways[23]
1.2 益生菌對腸道黏膜屏障的調控
腸道發育除表現在腸細胞增殖與分化外,還表現在黏膜屏障的成熟。腸道黏膜屏障功能是一套復雜的機制,通過生物、化學、免疫和機械屏障實現屏障作用。一般認為機械屏障是腸道屏障的主要部分,包括上皮細胞層(即包括上述ISCs、IECs等)、黏液層、固有層等。對腸黏膜屏障功能和完整性的影響是益生菌對宿主發揮益生功能的主要機制,表現在對腸黏膜發育的促進作用、對炎癥的調節作用,以及對黏膜細胞的基因表達的調控作用。
益生菌可以通過信號傳遞改變上皮細胞骨架重構、維持細胞膜滲透性。腸上皮的通透性包括跨上皮與細胞旁途徑(即緊密連接處)兩個途徑。有研究發現給新生小鼠飼喂鼠李糖乳桿菌(Lactobacillus rhamnosus)GG活菌或熱滅活的制劑可誘導跨膜蛋白claudin 3表達,從而加速腸屏障成熟,該研究還指出益生菌在維持緊密結合蛋白的表達方面有促進作用,這種作用能夠被組胺或非甾族化合物消炎藥如阿司匹林等抑制[1]。
另外,作為腸道機械屏障的重要組成部分,黏液層起到半固定保護屏障和潤滑流動生物膜作用。黏液素(Muc2、Muc3)的表達會受到乳酸桿菌的調控作用,表現為促進表達上調,這種促進作用與乳酸桿菌定植時間有關。除刺激腸道發育成熟外,還觀察到一些益生菌可提高上皮絨毛細胞中富含脯氨酸的蛋白質表達[1]。
根據上述腸道發育特點,實驗常從腸道組織形態、腸道細胞增殖分化、腸道上皮緊密連接蛋白的合成等角度來反映腸道狀態。例如絨毛邊緣可以分泌多種消化酶,同時絨毛高度的增加會促使小腸接觸營養物質的面積增大,故絨毛越長的動物其消化吸收能力越強[25]。隱窩深度反映隱窩細胞的增殖率和成熟度,隱窩變淺則分泌功能增強[26]。絨毛長度和隱窩深度的比值(V/C)綜合反映小腸的功能狀況,V/C值下降表明小腸消化、吸收功能下降[27]。
2 益生菌菌體組分對腸道發育的調控
益生菌因其益生功能而被廣泛應用于醫療、保健、食品等領域。盡管益生菌被定義為通過定植在體內,改變宿主某一部位菌群組成的一類對宿主有益的活性微生物,但益生菌發揮益生作用機理較復雜,可通過菌體本身及其活性代謝物直接對有害物質進行黏附或降解,或者通過其代謝產物調節腸道菌群及其代謝酶活性、調節機體免疫活性及機體部分酶活性等,起間接益生作用。因此,國際上普遍觀點認為益生菌無論活菌和死菌都具有益生功能,只是發揮功能的機理、劑量、安全性等有差異。例如滅活的乳酸菌產品含有維生素、游離氨基酸、小分子功能肽等生理活性物質,同樣具有良好的益生功能[28]。目前,已經有越來越多實驗證明益生菌菌體組分對腸道發育具有調節作用,如一些蛋白類物質以及細胞壁成分等。
2.1 菌毛蛋白對腸道發育的調控
蛋白質表面暴露的聚合物結構稱為菌毛[29]。長期以來學者們對細菌菌毛的研究主要集中在各種不同的致病菌株[30],并認為其是宿主發病機制中的關鍵毒力因素[31]。然而在益生菌中也發現有菌毛的存在[32],它們長約1 μm,直徑1~10 nm,從細胞表面發散出來,參與細胞黏附定植以及與宿主細胞之間的信息傳遞。有研究發現鼠李糖乳桿菌L. rhamnosus GG基因組中包含2 個獨立的菌毛位點:SpaCBA和SpaFED基因簇[32-33]。有研究通過免疫電子顯微鏡證實了pilin亞基SpaC的表達[34],并證明SpaC基因是鼠李糖乳桿菌分泌黏液關鍵因素[35-36],SpaF也已被證實在黏連蛋白中起作用[37]。另外,鼠李糖乳桿菌L. rhamnosus GG分泌的具有特異性和可溶性的低分子質量蛋白可調節上皮細胞生長和免疫反應[36]。
菌毛不僅作為一種重要的定植因子可促進二級宿主免疫反應[38-40],同時Motherway等最近發現,Bifidobacterium breve UCC2003的Tad菌毛可能通過產生一種特定的細胞外蛋白結構支架,促進新生兒結腸上皮細胞增殖、黏膜的生長,從而促進幼年腸道的成熟[29]。Bifidobacterium breve UCC2003的Tad菌毛纖維由一個或多個不同菌毛蛋白的多個拷貝組成,編碼其菌毛蛋白的基因簇如圖3所示,其中flp-pilin形成菌毛蛋白軸,該軸上裝飾有假菌毛蛋白、TadE和TadF。實驗表明Tad菌毛也參與了微生物-宿主的通訊,特別是向宿主上皮傳遞增殖信號。Motherway等首先通過動物實驗發現灌喂109CFU/mL Bifidobacterium breve UCC2003PK1 5 d后,細胞增殖效果顯著增加;之后使用功能基因組方法,分別構建了TadE、TadF缺失的Bifidobacterium breve UCC2003基因突變株(UCC2003ΔTadE與UCC2003ΔTadF),分析這些突變株在體內促進上皮細胞增殖,發現Tad菌毛介導的上皮細胞增殖由TadE亞基介導;最后將TadE蛋白純化,并通過體外實驗證實了這些發現[29]。
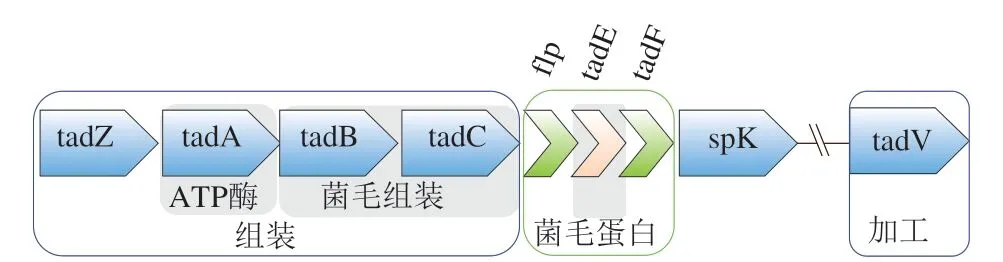
圖3 Bifidobacterium breve UCC2003Tad基因簇[29]Fig. 3 Bifidobacterium breve UCC2003Tad gene cluster[29]
目前認為Tad菌毛這種調節增殖效應的宿主-微生物溝通機制主要與Toll樣受體(toll-like receptor,TLR)有關。TLR家族在識別并抑制病原體、在特定的微生物配體或宿主被感染時釋放危險信號因子、維持生理條件下的組織穩態方面發揮著重要作用。在上皮細胞中,TLR2、TLR4和TLR5的mRNA和蛋白質的誘導性表達已被證實[41]。所有短雙歧桿菌和所有現存雙歧桿菌的基因組中均保留有Tad基因簇,這為菌毛介導宿主-微生物信號傳導的觀點提供了有力支持,也使得從分子水平上對早期微生物-宿主“對話機制”的研究更為深入[29]。
2.2 益生菌細胞壁成分對腸道發育的調控
MDP是益生菌細胞壁中肽聚糖的水解產物。當動物腸道處于穩態時,MDP對ISCs的影響不顯著;一旦腸道受損傷,MDP可立即對ISCs發揮保護作用,并且這一保護作用由Lgr5+ISCs模式識別受體核苷酸結合寡聚化結構域蛋白2(nucleotide-binding oligomerization 2,Nod2)介導,并以Nod2依賴性方式保護干細胞免受體內氧化應激,具體表現為促進Lgr5+ISCs增殖、抑制凋亡。Nigro等研究發現細菌肽聚糖MDP在體外可誘導較高的類腸器官表達[42]。
脂多糖(lipopolysaccharide,LPS)是革蘭氏陰性細菌細胞壁外壁的組成成分,細菌死亡時通過溶解、破壞細胞實現脫落。LPS通過激活TLR4抑制上皮細胞蛋白激酶(protein kinase,Akt)磷酸化,糖原合成酶激酶3β(glycogen synthase kinase-3β,GSK-3β)在其上游負調控因子Akt作用下,磷酸化水平降低,活力提高,使β-聯蛋白被磷酸化后降解,最終抑制Lgr5+ISCs或類器官增殖,誘導細胞凋亡[43],具體機制見圖4。

圖4 TLR4介導LPS引起的ISCs β-聯蛋白降解[15]Fig. 4 TLR4 mediates the LPS-induced β-catenin degradation of intestinal stem cells[15]
ISCs能夠表達TLR4和Nod2等模式識別受體并被配體激活,但表現出不同的功效:MDP可激活Nod2保護ISCs,而LPS激活TLR4促進ISCs凋亡[15]。LPS與MDP同時存在于腸道中,各自按照自身的濃度抵消對方的作用[44]。有研究表明共生細菌在正常的穩態條件下可被TLRs識別,并且這種相互作用在維持腸上皮穩態方面起著至關重要的作用[45]。
2.3 外源性表皮生長因子對腸道發育的調控
表皮生長因子(epidermal growth factor,EGF)存在于胃腸道等組織中,是一類可外源表達的蛋白質類增殖因子[46]。有證據表明,小腸內足夠量的外源性EGF可提高腸谷氨酰胺酶活力,產生ISCs增殖和分化所需酰胺氮及能量,以促進腸道發育,維持良好形態[47],從而修復損傷。Bedford等通過生物工程方法構建了可外源表達EGF的乳酸乳球菌Lactococcus lactis(EGF-LL),并且發現其發酵上清液能促進新斷奶仔豬的生長,包括腸道發育成熟,具體表現為杯狀細胞增殖、空腸結構發育成熟、絨毛高度提高、固有層寬度降低[48]。Cheung等用重組方法構建EGF-LL,發現其可在整個腸道中存活,并且在腸道內容物中還檢測到重組EGF蛋白;口服重組細菌EGF-LL的早期斷奶小鼠的體質量顯著提高、腸道中平均絨毛高度和隱窩深度增加,腸中增殖細胞核抗原染色的細胞數量增多,表明腸細胞的增殖得以增強;該研究證明Lactococcus lactis(EGF-LL)對新生斷奶小鼠的腸道生長具有有益作用[49]。Kang Ping等研究發現接受外源表達EGF的乳酸乳球菌Lactococcus lactis(EGF-LL)組的豬空腸和十二指腸絨毛高度和腸長度、腸道細胞增殖率均顯著高于對照組[50]。
此外,腸道隱窩-絨毛軸上的內源EGF信號通過與細胞膜上的糖蛋白受體特異性結合,使受體磷酸化,提高酪氨酸激酶活力,開啟下游一系列信號通路(如PI3K/Akt和Ras/Raf/MEK/ERK等),通過調節下游基因的轉錄來調控ISCs與TA細胞的增殖和分化[51-52]。
3 益生菌代謝產物丁酸及其鹽類促進腸道發育
動物腸道中存在益生菌代謝產物——短鏈脂肪酸(short-chain fatty acids,SCFAs),如乙酸、丙酸和丁酸等。體內超過95%的丁酸在結腸內產生和吸收[53]。丁酸為腸道上皮細胞提供營養,丁酸鹽可以促進結腸黏膜細胞分化[54]。有研究發現添加0.1%丁酸鈉到斷奶仔豬飼糧中,1 周后仔豬十二指腸和回腸的V/C值顯著提高[55]。此外,丁酸還影響腸道屏障,一方面通過影響覆蓋于結腸上皮黏液中的黏蛋白和三葉因子來提高腸黏膜的屏障能力;另一方面影響結腸上皮的通透性,增加腸道的屏障能力,減少炎癥因子的產生,保護機體免受內源抗原帶來的損傷,延緩潰瘍性結腸炎或其他炎癥[53]。冉舒文等綜述了丁酸可以通過激活Caco-2細胞的腺苷酸活化蛋白激酶而促進腸道的緊密連接表達,保證腸道的屏障功能[56]。其次,丁酸也能夠誘導活性轉谷氨酰胺酶、抗菌肽和熱休克蛋白(heat shock proteins,HSPs)的合成,間接促進結腸黏膜的保護作用。已有研究證明,轉谷氨酰胺酶可以促進腸黏膜的愈合,抗菌肽(白細胞介素-37)和防御素可保護腸黏膜免受細菌的感染,HSPs可抑制炎癥調節劑的生成而預防炎癥[57]。丁酸及其鹽類對動物腸道生長發育的影響見表1。
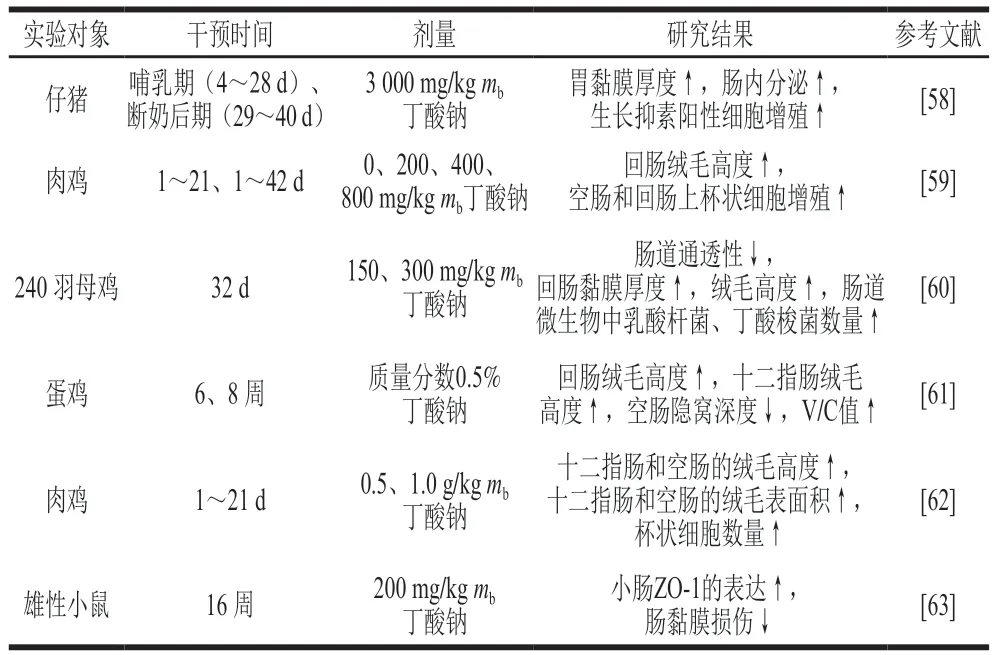
表1 丁酸及其鹽類對動物腸道生長發育的影響Table 1 Effects of butyric acid and butyrate on intestinal growth and development of animals
上述研究結果說明當丁酸及其鹽類作為補充劑對宿主發揮有益作用時,其劑量、攝入時間、攝入方式等需要受到嚴格控制,才可能促進黏膜的成熟和分化,從而影響胃腸道的形態和功能,這使得以丁酸為主要代謝產物的產丁酸細菌在腸道中的作用受到更多關注。通過對人腸道微生物的廣泛調查發現,產丁酸細菌主要分布在梭菌屬(Clostridium)、真桿菌屬(Eubacterium)以及梭桿菌屬(Fusobacterium)等,目前我國已將丁酸梭菌投入商業化應用[53]。李玉鵬等發現與對照組相比,飼喂添加了丁酸梭菌飼糧的仔豬緊密連接蛋白的表達顯著提高,平均日增質量提高7.83%[64]。Takahashi等研究表明日糧中添加丁酸梭菌MIYAIRI588能夠顯著提高肉雞和斷奶仔豬的生長性能,降低壞死性腸炎的發生率和嚴重程度[65]。
4 腸道菌群定植穩態影響腸道發育
棲息在動物腸道的微生物數量龐大,是體細胞和生殖細胞總數的10 倍[66]。腸道也被認為是機體“遺忘的免疫器官”[67]。結腸存在約1 000~1 150 種細菌,主要以嚴格厭氧的革蘭氏陽性菌為主,且具有宿主特異性[52,68]。健康成人腸道菌主要分為厚壁菌門(Firmicutes)、擬桿菌門(Bacteroidete)、變形菌門(Proteobacteria)、放線菌門(Actinobacteria)、疣微菌門(Verrucomicrobia)和梭桿菌門(Fusobacteria),其中前2 類菌門的數量超過全部腸道菌的90%[69]。兒童腸道內富含雙歧桿菌屬(Bifidobacterium)和Lecnospiraceae;青少年腸道菌群主要富含雙歧桿菌屬(Bifidobacterium)、糞腸桿菌屬(Faecalibacterium)、Anaerovorax及毛螺菌科(Lachnospiraceae)[70]。
腸道微生物群可以在腸道受應激損傷期間影響腸上皮細胞。一些研究發現,腸道微生物群通過免疫細胞-上皮細胞網絡促進腸上皮修復的作用,在這些通路中,TLR和甲酰肽受體起識別細菌配體作用[45]。越來越多的證據表明,早期生命中的微生物群是晚期免疫和代謝疾病風險的關鍵決定因素[71],同時也是腸道上皮更新的重要驅動因素,影響腸道黏膜形態和平衡[72]。基于無菌動物的微生物移植實驗整體反映了腸道微生物通過參與機體的物質代謝網絡對宿主的生長和代謝表型進行調節,并直接影響到腸道的生長、發育和代謝調控[69]。腸道微生物群對動物腸道生長發育的影響見表2。

表2 腸道微生物群對動物腸道生長發育的影響Table 2 Effect of gut microbiota on intestinal growth and development of animals
Rask等研究發現,與普通小鼠相比,單一定植菌的小鼠或無菌小鼠可以通過上調小腸黏膜上皮主要組織相關復合體的表達,進而促進小腸黏膜形態結構的完整[81]。張蘭威等的結果表明,不同地域母乳中微生物組成存在差異,一些從樣品中分離得到的乳桿菌和雙歧桿菌可以發揮促進腸道上皮細胞發育、巨噬細胞活性的作用[82]。
腸道微生物群顯然對動物早期腸道形態發育、上皮細胞增殖具有重要影響[5],因此,腸道菌群的變化也能在一定程度上反映出腸道狀態、代謝能力等。另外,腸道菌群與大腦、肝臟等器官之間通過腸道菌群-腸-腦軸、腸道菌群-腸-肝軸等進行相互調控,故通過對腸道菌群的監測,也可預測其他器官正常或異常發揮作用的趨勢。目前對于腸道微生物群與上皮細胞之間雙向交流的通路機制也已有研究[83],但對于微生物群與上皮細胞傳導信號的全分子序列尚未完全了解。腸道菌群對鄰近干細胞的功能調節,包括對代謝、免疫以及神經元和血管發育在內的多種宿主功能的調節,仍有待于進一步深入研究[84-87]。
5 結 語
綜上所述,腸道微生物與腸道發育密切相關,腸道內定植的益生菌可通過直接或間接的途徑影響動物腸道細胞增殖分化、黏膜屏障的形成,從而實現對腸道發育的干預。然而目前實驗常通過建立體外細胞模型、類器官模型以及以轉基因小鼠作為實驗模型來模擬正常動物腸道組織,臨床實驗較少,與人體正常腸道環境存在差異。并且盡管人們目前對于益生菌干預腸道細胞增殖分化及黏膜屏障的形成有一定的了解,但其自我更新具體機制仍有待進一步系統探索。并且有必要深入了解益生菌干預靶位點、靶分子和相關的信號傳導通路等分子調控機制,篩選出含有起調控作用的菌體蛋白或分泌有效代謝產物的功能菌株或利用生物工程手段定向改造工程菌,通過補充益生菌制劑、菌群移植等方式,有效發揮益生菌促進腸道發育的益生作用,這對于嬰幼兒機體成熟、緩解或修復腸道應激損傷等產生重要的影響,對維持機體健康具有重要意義。

