NaCl對結腸癌CT26細胞遷移能力和生物力學特性的影響*
邱煒, 黃瑾, 楊穎穎, 曾柱
(貴州醫科大學 生物與工程學院, 貴州 貴陽 550025)
結直腸癌(colorectal cancer,CRC)是最常見的惡性腫瘤之一,也是導致死亡率較高的一種癌癥[1-2]。CRC在我國的發病率相對較低,但近年來呈上升趨勢,根據人口測算,CRC的發病率在我國所有消化系統癌癥中增長速度第一,有超越肝癌和胃癌趨勢[3-4]。Na+是維持人體正常生理活動不可缺少的物質,其主要來源是每日的膳食鹽。現在社會的大量飲食中,鹽是很容易獲取且消耗量巨大[5]。因此,鹽與CRC的發病機制之間關系的研究是非常必要的。目前已知鹽能影響多種腫瘤的發生發展[6-9], 但是具體潛在機制還知之甚少。細胞生物力學特性反映細胞結構與功能之間的關系,本項目將以細胞生物力學特性為出發點來研究NaCl對結腸癌CT26細胞功能的影響,為進一步了解鹽在結腸癌發生發展過程中的功能提供依據。
1 材料與方法
1.1 材料與儀器
1.1.1主要材料 鼠源結腸癌CT26細胞(課題組保存),RPMI-1640培養基(美國Gibco公司),10%胎牛血清(美國Gibco公司),NaCl(美國Sigma公司),Triton-X100、Cell Counting Kit 8(CCK8)、4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole, DAPI)、和羅丹明標記的鬼筆環肽(北京索萊寶公司)。
1.1.2主要儀器 CO2培養箱(美國Thermo Fisher公司),F-4600熒光分光光度計(日本Hitachi公司),臺式低速離心機(上海安亭科學儀器廠),細胞電泳儀(北京六一生物科技有限公司),激光共聚焦顯微鏡(日本Olympus公司)。
1.2 方法
1.2.1CT26的復蘇與培養 從液氮罐取出凍存的CT26,放入水浴鍋中快速溶解,取出1 000 r/min離心5 min,去掉上清后用含胎牛血清的RPMI-1640培養基重懸細胞, 37 ℃、5% CO2的培養箱中培養。當細胞鋪板面積達約90%左右時,進行NaCl處理實驗,或者使用0.25%胰蛋白酶消化后傳代培養。
1.2.2CT26活力檢測 使用CCK-8試劑盒檢測CT26細胞活力。將CT26分為4組,分別加入含0、10、20和40 mmol/L NaCL的RPMI-1640培養基。細胞在96孔(100 μL/孔)板中培養24 h,然后向培養板中每孔加入10 μL CCK-8溶液,37 ℃、5% CO2培養箱中孵育2 h,酶標儀于450 nm波長下測定每個孔的吸光度(OD)值。
1.2.3CT26遷移能力檢測 使用劃痕實驗檢測細胞遷移能力。CT26細胞貼壁生長密度達約90%時,用無菌的200 μL移液器槍頭在孔中央處垂直進行劃痕,拍照并記錄其直徑。0 mmol/L(對照組)和20 mmol/L(處理組)NaCl處理細胞24 h,拍照并測距計算遷移率。遷移率=(初始劃痕寬度-細胞遷移后剩余寬度)/初始劃痕寬度×100%。
1.2.4細胞膜流實驗 0 mmol/L(對照組)和20 mmol/L(處理組)NaCl處理細胞24 h,PBS漂洗3次;無菌避光條件下加入DPH 800 μL重懸細胞,封口、放入培養箱孵育30 min,取出離心棄上清,PBS洗滌3次后用PBS 1 mL重懸,用熒光分光光度計測量細胞偏振度,記錄IVV(起偏和檢偏器光軸同為垂直方向時測得的熒光強度)、IVH(起偏和檢偏器光軸分別為垂直和水平方向式測得的熒光強度)、IHV(起偏和檢偏器光軸分別為水平和垂直方向時測得的熒光強度)的數值。熒光偏振度P反映細胞膜分子動力學,與細胞膜流動性呈負相關[10]。通過以下公式計算P:
1.2.5電泳率實驗 0 mmol/L(對照組)和20 mmol/L(處理組)NaCl處理細胞24 h,PBS漂洗3次,用10%蔗糖溶液重懸后將細胞懸液加至細胞電泳小室內,靜止層中觀察細胞。記錄細胞電泳的加載電壓、電泳距離及時間,計算細胞電泳遷移率(cell electrophoresisi mobility,EPM)及電泳率[11]。EPM反映了細胞表面負電荷量[11]。實驗重復3次,每次實驗每組隨機選擇10個細胞進行電泳率實驗。
1.2.6細胞骨架蛋白絲狀肌動蛋白(F-actin)檢測 0 mmol/L(對照組)和20 mmol/L(處理組)NaCl處理細胞24 h后,用4%多聚甲醛常溫固定細胞20 min;吸棄多聚甲醛、PBS漂洗、加入Triton-100處理細胞、PBS漂洗、加入羅丹明標記的鬼筆環肽后避光染色12 h;PBS漂洗、加入DAPI、PBS漂洗、加入防熒光淬滅劑油封片,避光4 ℃保存備用。使用共聚焦激光掃描顯微鏡觀察細胞F-actin結構,拍照并用Imagej軟件測量細胞熒光強度,定量絲狀肌動蛋白(filament actin, F-actin)含量。實驗重復3次,每次實驗每個處理組隨機選擇3個細胞測量熒光強度。
1.3 統計學分析
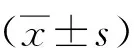
2 結果
2.1 CT26細胞活力的檢測
結果顯示,10 mmol/L和20 mmol/L濃度NaCl處理CT26 24 h對細胞活力無影響,但30 mmol/L和40 mmol/L濃度NaCl能抑制細胞活力,40 mmol/L NaCl組與0 mmol/L組比較,P<0.05。見圖1。因此在后續實驗中,分別將0 mmol/L和20 mmol/L濃度NaCl處理CT26細胞24 h作為對照組和處理組。

注:(1)與0 mmol/L組比較, P<0.05。圖1 不同濃度NaCl對CT26活力的影響Fig.1 Effect of NaCl on the activity of CT26
2.2 細胞遷移
結果顯示,對照組和處理組的遷移率分別為33.9%和22.6%,表明20 mmol/L濃度NaCl可顯著降低CT26細胞的遷移率(P<0.05)。見圖2。

注:圖中數值的單位為μm。圖2 NaCl抑制CT26的遷移能力Fig.2 Migration of CT26 inhibited by NaCl
2.3 細胞膜流動性
與對照組相比,20 mmol/L濃度NaCl處理組熒光偏振度P顯著增加(P<0.05),表明 20 mmol/L濃度NaCl能顯著降低CT26細胞膜流動性。見圖3。

注:(1)與對照組比較,P<0.05。圖3 NaCl顯著抑制CT26細胞膜流動性Fig.3 The membrane fluidity of CT26 inhibited by NaCl
2.4 細胞電泳率
與對照組相比,20mmol/L濃度NaCl處理組的EPM明顯減少(P<0.05),表明CT26細胞表面的負電荷量降低。見圖4。

注:(1)與對照組比較,P<0.05。圖4 NaCl減少CT26細胞膜負電荷量Fig.4 The negative charges load of CT26 decreased by NaCl treatment
2.5 F-actin的表達
與對照組相比,20mmol/L濃度NaCl處理組的F-actin表達降低(P<0.05)。見圖5。

注:(1)與對照組比較,P<0.05。圖5 NaCl減少F-actin的表達Fig.5 Expression of F-actin inhibited by NaCl treatment
3 討論
鹽是生命體不可或缺的物質,適量濃度的鹽對生物特有細胞功能的維持是非常重要的[5]。飲食中高鹽攝入被認為與多種疾病有關,包括心血管疾病、腎臟疾病、神經系統疾病以及自身免疫疾病[12-19]。在腫瘤發生發展過程中,高鹽飲食可以通過調節骨髓來源的抑制性細胞功能來增強抗腫瘤免疫力,從而抑制腫瘤的生長[6-7]。但有也文獻報道表明鹽在腫瘤免疫中發揮積極作用[8]。因此,本項目從細胞遷移能力和生物力學特性為出發點研究NaCl對CT26功能的影響,為了進一步了解鹽在腫瘤免疫中的功能提供更多基礎知識。
細胞生物力學特性包括細胞膜流動性、膜電特性和細胞骨架結構等[20]。膜流動性反映細胞膜脂雙層分子運動情況[10]。NaCl能降低CT26細胞的膜流動性,說明細胞膜分子運動受到NaCl抑制。細胞膜電特性在細胞與細胞或與細胞外基質間的相互作用過程中發揮著重要的作用。真核生物的細胞在體內有帶負電的表面[21]。本研究結果顯示NaCl處理使CT26細胞膜表面所帶負電荷量顯著降低,提示其與其他細胞間的推斥力減少,這可能有利于抗腫瘤免疫中免疫細胞與其結合。真核細胞骨架主要包括微絲、微管與中間纖維。由F-actin構成的微絲主要控制細胞的可塑性和遷移能力[22-24]。本結果發現NaCl處理使CT26的F-actin表達減少,這可能是NaCl抑制CT26遷移能力的原因之一。
綜上所述,本研究從細胞生物力學角度研究NaCl對CT26細胞的影響,發現NaCl能抑制CT26細胞的遷移能力、膜負電荷數量、膜流動性和F-actin的表達量。

