光學相干斷層成像與血管內超聲指導下冠狀動脈斑塊旋磨術治療鈣化病變的近期效果比較
滕瑋利,李琪,馬玉良,曹成富,劉健,趙紅,盧明瑜,宋俊賢,王偉民
冠狀動脈鈣化病變明顯增加介入治療難度和風險,可導致支架膨脹不全、貼壁不良,術中穿孔、夾層風險高以及靶血管血運重建率高[1-2]。冠狀動脈斑塊旋磨術通過有效修飾鈣化病變有助于提高手術成功率[3]。但單純依據冠狀動脈造影往往難以精確判斷鈣化的分布及嚴重程度。腔內影像學技術光學相干斷層成像(OCT)和血管內超聲(IVUS)可以準確評估鈣化病變的性質、部位、范圍,對于是否啟動旋磨術預處理病變、明確旋磨預處理效果以及評價支架置入即刻效果具有重要的指導意義。因此對于冠狀動脈造影顯示重度鈣化病變者推薦術中行IVUS或OCT 檢查以評估病變及指導治療[4]。但IVUS 分辨率低,無法評估鈣化病變的厚度,OCT 可以穿透鈣化沒有偽影,清楚評估鈣化病變的厚度及分布[5-6]。目前關于OCT 與IVUS 指導下旋磨術治療冠狀動脈鈣化病變的對比研究尚少見,因此,本研究旨在比較OCT 與IVUS 指導下旋磨術治療冠狀動脈鈣化病變的近期效果。
1 資料與方法
1.1 研究對象
回顧性分析自2012 年1 月至2019 年12 月北京大學人民醫院冠狀動脈造影顯示中重度鈣化病變,行OCT 或IVUS 指導下進行旋磨術治療的患者60 例(61 處病變),其中男性39 例,女性21 例,平均年齡(69.56±8.45)歲。
納入標準:冠狀動脈造影顯示缺血相關血管狹窄>70%,且中重度鈣化病變;術中行IVUS 或OCT檢查;行旋磨術治療。
排除標準:急性或者亞急性血栓形成病變,冠狀動脈嚴重夾層或撕裂,橋血管病變,嚴重心力衰竭,影像學資料缺失者。
分組及旋磨術指證:根據術中使用OCT 或IVUS 指導,分為OCT 指導組23 例患者(24 處病變)和IVUS 指導組37 例患者(37 處病變)。旋磨術指證為OCT 或IVUS 檢查提示截面圖像鈣化病變弧度大于 180°以上或成像導管無法通過病變,冠狀動脈造影顯示為中重度鈣化病變。所有患者均簽署手術知情同意書。
1.2 研究方法
所有病變標準體位造影,確定缺血相關血管,是否行OCT 或IVUS 檢查由術者決定。OCT 及IVUS圖像均由兩名有經驗的介入醫師分別進行離線測量。
IVUS 檢查:使用iLab 血管內超聲顯像儀(Boston Scientific,美國),血管內超聲導管為40 MHz、2.5 F Atlantis SR Pro(Boston Scientific,美國)。在進行血管內超聲檢查前,冠狀動脈內滴注硝酸甘油200 μg以預防血管痙攣。沿指引導絲將超聲導管送入要檢查的冠狀動脈病變的遠端,采用自動回撤裝置,緩慢從遠端以0.5 mm/s 的速度自動回撤超聲導管至導引導管內,實時記錄IVUS 圖像。所有影像資料刻錄在DVD 光盤以供脫機時分析。
OCT 檢查:使用FD-OCT 系統(C7-XR Imaging System,美國),將 C7 Dragonfly 成像導管用造影劑填充管腔,與 OCT 成像系統連接后進行校準。沿指引導絲將成像導管送至病變遠端10~15 mm 處,檢查時用注射器快速注射造影劑沖洗血管腔,成像導絲以20 mm/s 速度回撤獲取動態影像。OCT 圖像通過成像軟件對靶血管置入支架前后的連續橫斷面影像以 1 mm 間隔(每 15 幀)進行定量分析。
旋磨術:采用美國Boston Scientific 公司Rotablator TM 旋磨介入治療儀(型號 H802220200381)進行旋磨治療,旋磨頭采用 Rota Link TM (直徑分別為 1.25 mm、1.50 mm 和 1.75 mm),旋磨具體操作要點包括:(1)旋磨頭選擇:參照 OCT 或IVUS 檢查結果,按照血管內徑 ×(0.5~0.6)mm 選擇合適的磨頭進行旋磨治療。如果 OCT 或IVUS 成像導管不能通過鈣化病變,則參照造影結果,按照上述方法選擇旋磨頭;(2)旋磨頭轉速為 140 000~160 000 r/min;(3)每次旋磨時間為10~15 s,間隔時間為 30 s~2 min;(4)旋磨頭通過病變后,再次于病變局部打磨3~4 次;(5)術中經旋磨系統常規冠狀動脈內加壓持續滴注含肝素、硝酸甘油的生理鹽水。冠狀動脈旋磨后,再次進行腔內影像學檢查。部分病變旋磨后成像導管仍無法通過病變,可先采用球囊預擴張,再行腔內影像學檢查。如果效果滿意,先行球囊充分預擴張,再置入藥物洗脫支架,最后進行充分后擴張。如果效果不滿意,可以再次旋磨或選用更大的磨頭(直徑較前增加 0.25 mm)旋磨。DES 置入充分后擴張后再次進行腔內影像學檢查以評價支架置入即刻效果。
1.3 觀察指標及相關定義
收集兩組患者的變量包括臨床基線資料、病變及手術特點、住院期間主要不良心血管事件及腔內影像學結果。中度鈣化病變定義為冠狀動脈造影時在心臟跳動時較容易看到較清楚的陰影,但心臟不動時看不到陰影的存在;重度鈣化病變定義為在冠狀動脈造影時心臟跳動和不動時均可清楚看到的陰影。參考段定義為同一血管病變近端及遠端10 mm范圍內,管腔面積最大、狹窄程度<20%且無主要分支的部位。平均參考管腔面積定義為近端和遠端參考面積的平均值。支架膨脹率定義為支架最小橫截面積除以平均參考管腔面積。手術成功定義為支架完全覆蓋病變,殘余狹窄≤ 20%,前向血流達TIMI 3 級。住院期間主要不良心血管事件包括死亡、緊急冠狀動脈旁路移植、靶血管再次血運重建。
1.4 統計學方法
所有數據采用 SPSS 22.0 統計軟件進行統計分析。符合正態分布的計量資料采用均數±標準差()表示,組間比較采用獨立樣本t檢驗;不符合正態分布的計量資料中位數(P25,P75)表示,組間比較采用 M-W-U 檢驗。計數資料用例數和百分比表示,組間比較采用卡方檢驗或 Fisher 確切概率法檢驗。P<0.05 為差異有統計學意義。
2 結果
2.1 OCT 指導組與IVUS 指導組患者臨床基線特征比較(表1)
OCT 指導組與IVUS 指導組患者的年齡、性別、高血壓、糖尿病、高脂血癥、吸煙、心腎功能、既往病史(既往心肌梗死、經皮冠狀動脈介入治療及冠狀動脈旁路移植術)、臨床診斷比較,差異均無統計學意義(P>0.05)。
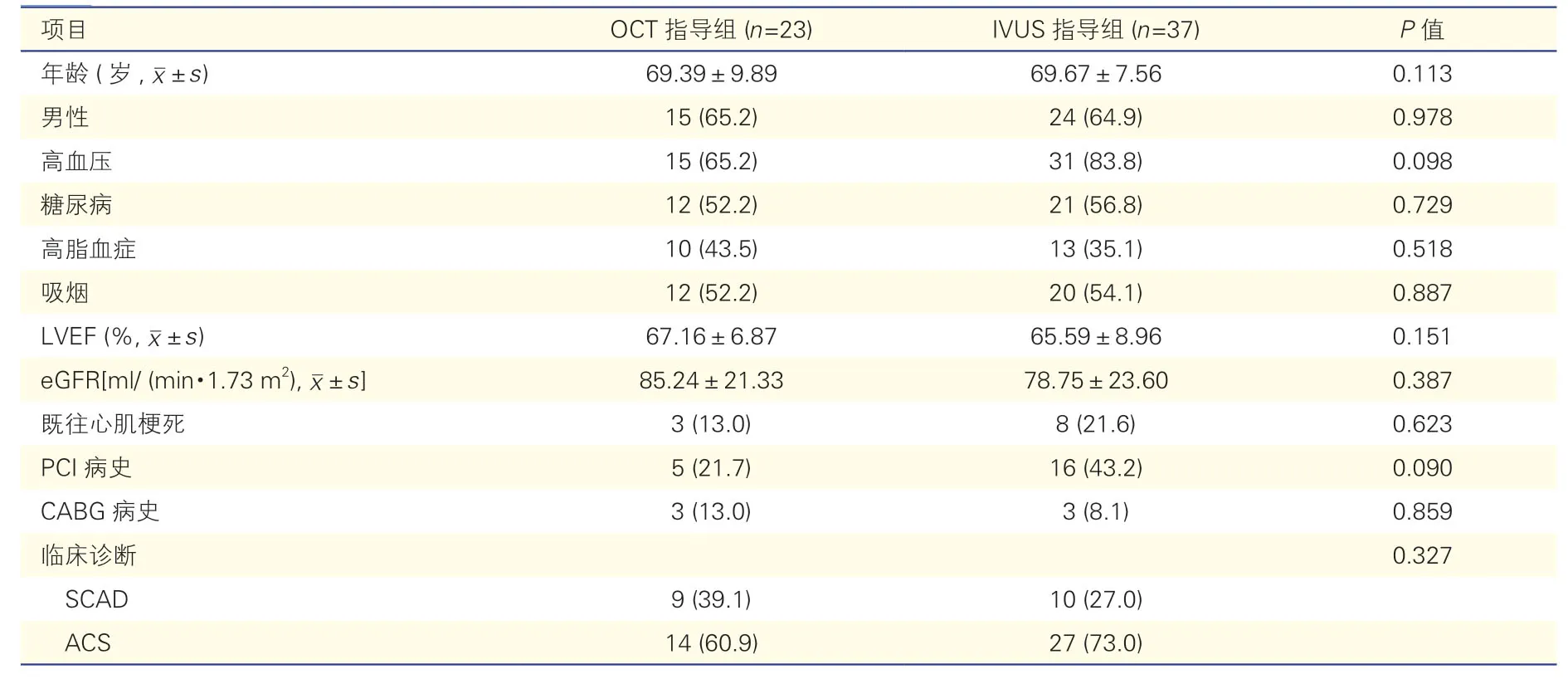
表1 OCT 指導組與IVUS 指導組患者臨床基線特征比較[例(%)]
2.2 OCT 指導組與IVUS 指導組患者病變及手術特點比較(表2)
OCT 指導組與IVUS 指導組患者的靶血管、旋磨頭使用情況、預擴張球囊直徑、預擴張球囊最大壓力、支架置入個數、平均支架直徑、總支架長度、后擴球囊直徑、后擴球囊最大張壓力、手術時間、X 射線量等比較,差異均無統計學意義(P均>0.05)。
OCT 指導組與IVUS 指導組手術即刻成功率均100%,術中未發生冠狀動脈穿孔、緊急外科旁路移植、死亡等嚴重并發癥,住院期間無主要不良心血管事件發生。OCT 指導組對比劑用量多于IVUS指導組[(322.9±106.1) ml vs.(270.6±81.2) ml,P<0.05],差異有統計學意義。
表2 OCT 指導組與IVUS 指導組患者共61 支血管病變及手術特點比較[支(%),]
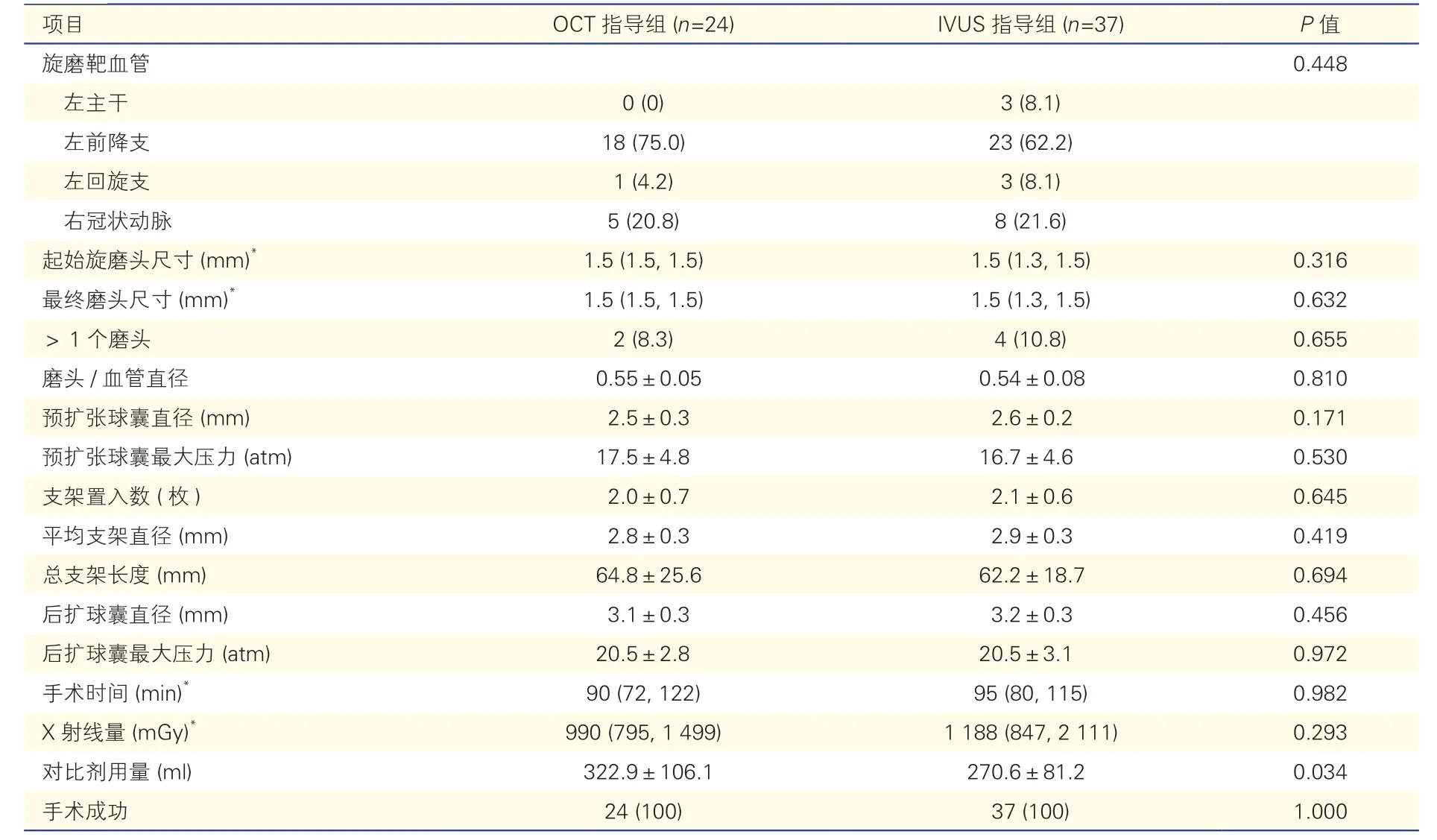
表2 OCT 指導組與IVUS 指導組患者共61 支血管病變及手術特點比較[支(%),]
注:OCT:光學相干斷層顯像;IVUS:血管內超聲。1 atm=101.325 mmHg。*:以中位數(P25,P75)表示
2.3 OCT 指導組與IVUS 指導組患者腔內影像學結果比較(表3、圖1~2)
表3 顯示,OCT 指導組遠端參考血管最大管腔直徑[(2.7±0.3) mm vs.(2.9±0.4) mm,P<0.05]及病變處最小管腔直徑[(1.3±0.4)mm vs.(1.5±0.2)mm,P<0.05]小于IVUS 指導組,兩組比較差異均有統計學意義;而兩組患者支架后最小支架橫截面積[(5.6±1.2) mm2vs.(5.7±1.1) mm2],差異無統計學意義(P>0.05)。與IVUS 指導組比較,OCT 指導組可以獲得更高的支架膨脹率[(82±8)% vs.(75±10)%,P=0.002],差異有統計學意義。OCT 及IVUS 指導下旋磨術前后及支架置入術后效果詳見圖1~2。
表3 OCT 指導組與IVUS 指導組患者共61 支病變血管腔內影像學結果比較()
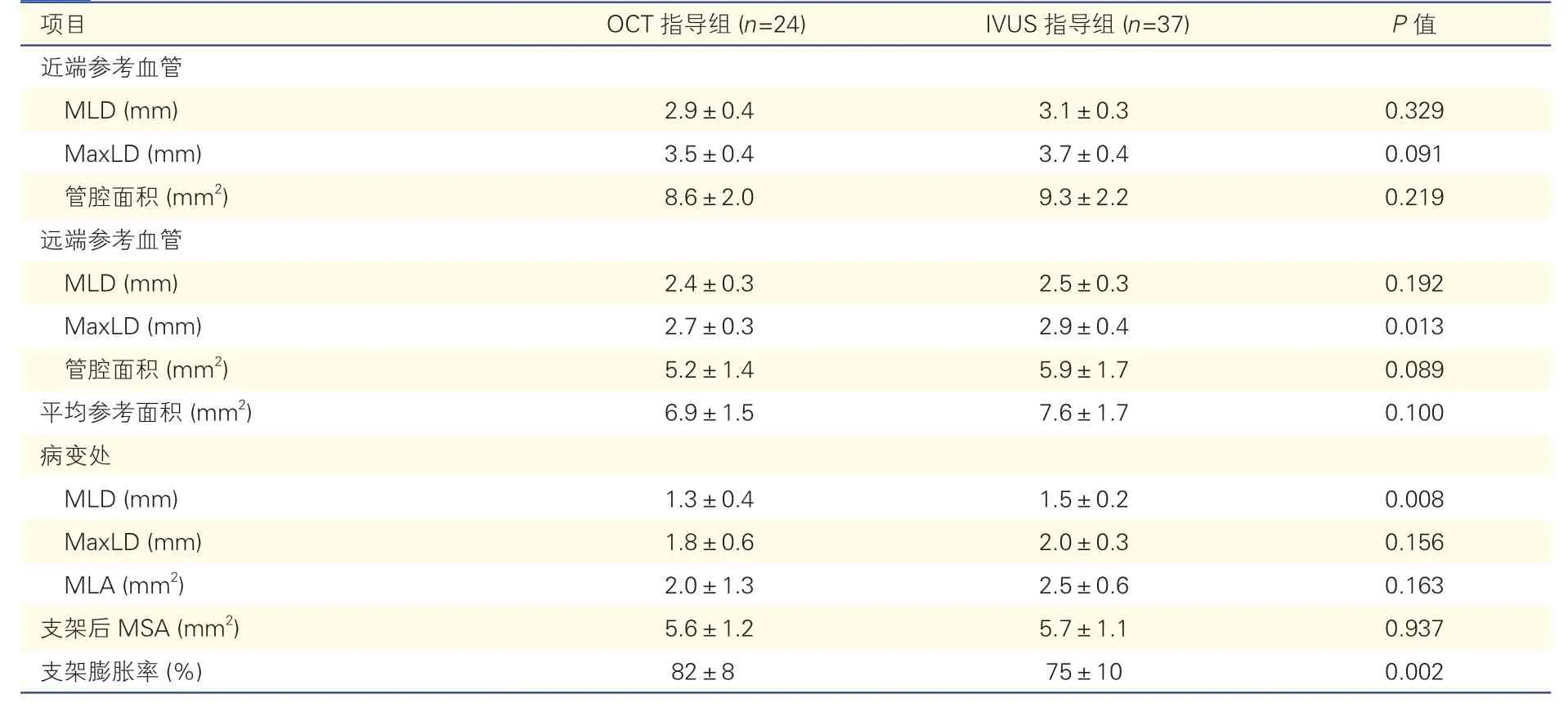
表3 OCT 指導組與IVUS 指導組患者共61 支病變血管腔內影像學結果比較()
注:OCT:光學相干斷層顯像;IVUS:血管內超聲;MLD:最小管腔直徑;MaxLD:最大管腔直徑;MLA:最小管腔橫截面積;MSA:最小支架橫截面積
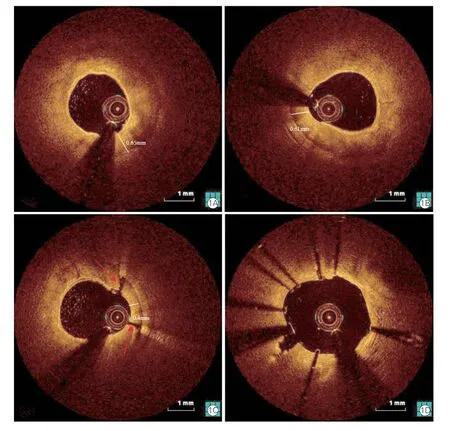
圖1 OCT 指導下旋磨術前后及支架置入術后效果
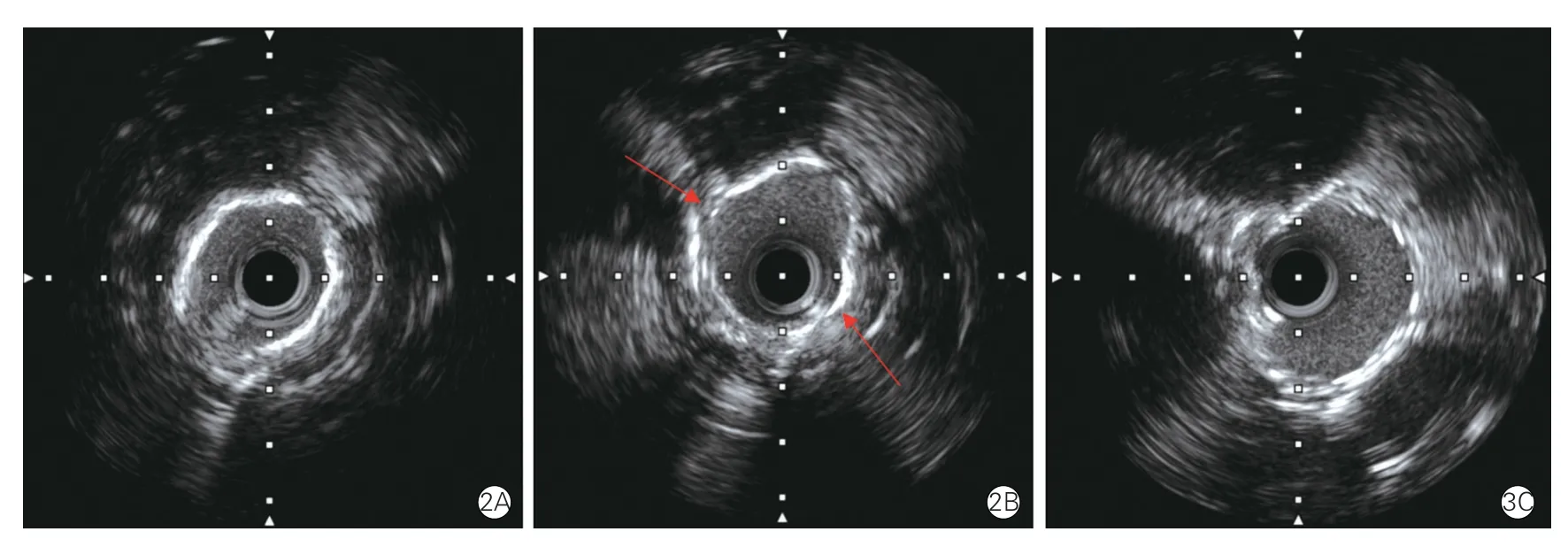
圖2 IVUS 指導下旋磨術前后及支架置入術后效果
3 討論
隨著經皮冠狀動脈介入治療患者逐年增加[7],需要處理的復雜病變也越來越多,而冠狀動脈嚴重鈣化病變目前仍然是介入治療領域的一大挑戰。冠狀動脈斑塊旋磨術是目前用于嚴重鈣化病變的最有效治療方法,但僅依據冠狀動脈造影不能準確量化鈣化病變,無法準確評估旋磨術效果以及支架膨脹、貼壁情況,并且由于嚴重鈣化病變順應性差,支架膨脹不全、貼壁不良和夾層等發生率較高,可能導致支架內血栓、支架再狹窄的風險增加。腔內影像學技術IVUS 和OCT 可獲得清晰的血管壁結構及管腔平面圖,對于鈣化病變的識別測量、指導手術策略、優化支架效果具有重要意義。既往研究證實,與冠狀動脈造影指導相比,IVUS 或OCT 指導的經皮冠狀動脈介入治療明顯降低了主要不良心血管病事件和心原性死亡發生率,可以獲得更好的臨床結局[8-9]。ILUMIEN III 和OPINION 研究一致顯示,OCT 指導的經皮冠狀動脈介入治療無論是手術即刻結果還是中期臨床預后均不劣于IVUS 指導的經皮冠狀動脈介入治療[10-11]。目前尚少見關于OCT 與IVUS 指導旋磨術后的對比研究,本研究顯示OCT指導下旋磨術與IVUS 指導下旋磨術即刻手術成功率一致,均達到100%,術中無冠狀動脈穿孔、緊急外科冠狀動脈旁路移植、死亡等嚴重并發癥發生,住院期間無不良心血管事件發生,這提示OCT 或IVUS 可以通過準確評估鈣化病變,對制定旋磨策略、指導旋磨頭的選擇、最大限度的修飾鈣化斑塊以減少手術嚴重并發癥和提高手術成功率具有重要作用。
嚴重鈣化病變影響冠狀動脈狹窄的有效擴張,基于OCT 的研究顯示當鈣化病變的范圍>180°,最大厚度>0.5 mm 并且長度>5 mm 時,則存在較高的支架膨脹不良的風險[12]。一般認為,當IVUS發現鈣化病變弧度超過270°時則需要旋磨治療,但是不到270°的鈣化病變有時也會造成支架通過困難、支架釋放后膨脹不全,可能會影響遠期療效。湯喆等[13]研究顯示,旋磨后鈣化環斷裂和最小殘余管腔面積是影響支架膨脹的主要因素,也有研究顯示,鈣化厚度和鈣化發生斷裂是支架良好膨脹的主要預測因素[14],當鈣化厚度小于670 μm 時能夠被球囊擴張出現鈣化環斷裂[15],另一項研究顯示,能夠被球囊擴張而出現鈣化環斷裂的臨界值是450 μm[16]。本研究顯示,OCT 指導下旋磨術可以獲得更高的支架膨脹率,與Kobayashi 等[17]的研究結果一致。分析原因是IVUS可以識別鈣化病變的范圍,但由于鈣化后聲影的存在,IVUS 無法評價鈣化的厚度和面積,而OCT 可以穿透鈣化沒有偽影,能夠準確識別鈣化病變厚度,通過測量旋磨術后鈣化病變厚度,明確鈣化病變的預處理情況,必要時可增加磨頭尺寸或再次旋磨,可能有助于獲得支架良好膨脹(如圖1~2)。
既往IVUS 的研究結果認為在非左主干病變中,置入藥物洗脫支架后最小支架管腔面積小于5.5 mm2是遠期不良心血管事件的預測因素[18]。另外基于OCT 的研究顯示預測支架置入術后血流儲備分數>0.9 的最佳臨界值是5.44 mm2[19]。盡管本研究患者都有嚴重的鈣化病變,但經過OCT 或IVUS 指導下旋磨術治療、支架置入和后擴張后,兩組患者的支架術后平均最小支架橫截面積分別達到5.6 mm2和5.7 mm2,這可能有助于患者獲得更好的遠期效果。
IVUS 是通過導管技術將超聲成像探頭置入血管腔內利用聲波反射進行成像,不受血流的影響,檢查過程中不需要阻斷血流。OCT 是應用近紅外光干涉的成像技術,無法穿透血流成像,因此操作過程中需要通過指引導管快速注射對比劑以清除管腔中的紅細胞,這可能會增加對比劑用量。本研究顯示,OCT 指導下旋磨術比IVUS 指導下旋磨術需要更多的對比劑用量,與Kobayashi 等[17]的研究結果一致,但對比劑用量的增加并未導致非透析患者腎功能的改變。
本研究仍存在一定的局限性,本研究為單中心回顧性研究,樣本量較少,對研究結論的闡述可能存在偏倚,其次本研究未對患者進行長期隨訪,遠期臨床效果尚需進一步明確,因此仍需多中心大樣本量的前瞻性實驗以證實。
總之,OCT 與IVUS 對指導旋磨術治療冠狀動脈鈣化病變具有重要作用,OCT 與IVUS 指導下有助于更合理的選擇磨頭、明確旋磨預處理程度、最大限度的修飾鈣化病變、提高手術成功率。而OCT 比IVUS 指導下的旋磨術可以獲得更高的支架膨脹率。
利益沖突:所有作者均聲明不存在利益沖突

