小鼠腹腔巨噬細胞亞群對病毒擬似物Poly I∶C的免疫應答效應比較
楊 驍,陳 沖
(1.西安交通大學第二附屬醫(yī)院科研中心實驗室,西安 710004; 2.天津醫(yī)科大學腫瘤醫(yī)院檢驗科,天津 300060)
巨噬細胞是免疫系統(tǒng)中的重要組分,對機體穩(wěn)態(tài)維持、病原清除起著至關重要的作用。巨噬細胞具有較強的可塑性,按其功能表型、駐留器官、來源發(fā)育等,可分為不同的細胞亞群。根據(jù)其釋放促炎/抑炎細胞因子或趨化因子的功能行為,可分為經(jīng)典活化(classically activated)的M1型巨噬細胞亞群和選擇性活化(alternatively activated)的M2型巨噬細胞亞群[1-3]。根據(jù)其各類駐留器官劃分,可分為庫佛細胞(肝組織)、朗格漢斯細胞(皮膚組織)、肺泡巨噬細胞(肺組織)、破骨細胞(骨組織)、小膠質(zhì)細胞(腦組織)等巨噬細胞亞群[4-5]。根據(jù)來源,可將其分為胎肝造血干細胞來源、胚胎造血干細胞來源和成體骨髓造血干細胞來源的巨噬細胞亞群[6]。有研究報道表明,腹腔巨噬細胞具有一定的溯源異質(zhì)性,其F4/80hi巨噬細胞亞群來源于肝造血干細胞,在穩(wěn)態(tài)環(huán)境下依賴于自我增殖維持細胞群體數(shù)量的恒定;F4/80lo巨噬細胞亞群由骨髓造血干細胞來源的單核細胞發(fā)育而來,在機體遭受細菌感染或病毒侵擾的24~72 h,被大量募集并向F4/80hi巨噬細胞亞群定向分化[7]。然而在病毒侵染早期,腹腔巨噬細胞F4/80hi亞群和F4/80lo亞群是否具有免疫應答功能的異質(zhì)性,仍未獲曾闡明。
聚肌胞(Poly I∶C)是一種天然雙鏈RNA(ds RNA)的類似物,能夠有效模擬病毒感染后所形成的ds RNA,刺激機體產(chǎn)生抗病毒免疫反應和炎癥反應[8]。已有報道表明,Poly I∶C可與成熟巨噬細胞表面Toll受體3(TLR3)受體結合,通過活化下游髓樣分化因子88(MyD88)蛋白或β干擾素TLR結構域銜接蛋白(TRIF)兩種方式,誘導Ι型干擾素(IFN)產(chǎn)生,進而觸發(fā)炎性反應[9]。然而,目前對于異質(zhì)性巨噬細胞抗病毒功能與機制的研究仍較少。因此,進一步深入研究巨噬細胞亞群感染早期病毒免疫應答作用與機制,對理解機體免疫系統(tǒng)早期病毒識別與應答調(diào)控具有重要意義。本實驗通過研究Poly I∶C免疫刺激對小鼠腹腔F4/80hi和F4/80lo巨噬細胞亞群各類促炎因子和轉錄因子基因表達水平的影響,并進一步探究信號通路相關機制,以期為病毒感染的免疫應答調(diào)控研究提供理論依據(jù)和新思路。
1 材料和方法
1.1 實驗動物
SPF級C67BL/6J雄性小鼠,6~8周齡,20只,體重20~22 g,購于北京維通利華實驗動物技術有限公司[SCXK(京) 2016-0006],于西安交通大學醫(yī)學部動物實驗中心[SYXK (陜) 2015-0002]SPF級環(huán)境繁育飼養(yǎng)。溫度20℃~25℃,相對濕度40%~70%,每天12 h晝夜明暗交替。本研究所有動物實驗依據(jù)優(yōu)化、減少、替代的3R原則進行實驗設計,并經(jīng)過西安交通大學動物實驗倫理委員會批準(XJTULAC2018-2225)。
1.2 主要試劑與儀器
小鼠CD11b、F4/80流式抗體(1∶200,Biolegend,美國);RPMI-1640培養(yǎng)基、胎牛血清(Gibco,美國);Poly I∶C(Sigma,美國);RNA提取試劑TRIzol(Invitrogen,美國);cDNA合成試劑盒(Thermo,美國);SYBR Green熒光定量盒(TaKaRa,日本);BCA蛋白濃度定量試劑盒(Thermo,美國);JNK抗體(1∶500,CST,美國);P-JNK抗體(1∶500,CST,美國);GAPDH抗體(1∶500,CST,美國);羊抗兔HRP二抗(1∶3000,北京中杉金橋生物技術有限公司);JNK磷酸化抑制劑SP600125(MedChemExpress,美國);引物序列合成(北京六合華大基因科技股份有限公司)。
1.3 實驗方法
1.3.1 流式分析和分選小鼠腹腔巨噬細胞
選取6~8周齡C67BL/6J小鼠,脫頸處死,使用預冷的PBS緩沖液反復沖洗腹腔,離心后重懸,置于冰上裂解紅細胞10 min。離心后重懸行細胞計數(shù),取5×106細胞,同時加入5 μL的CD11b-PE-Cy7和F4/80-APC抗體,避光冰上孵育30 min后,離心去上清。將細胞加入1 mL流式緩沖液重懸,過200目無菌濾網(wǎng)后上機進行流式細胞分選和分析,所使用流式細胞儀為ARIA ΙΙ(BD,美國),具體步驟參見文獻[10]。共分選20只小鼠腹腔巨噬細胞,獲得的小鼠CD11b+F4/80hi巨噬細胞亞群和CD11b+F4/80lo巨噬細胞亞群,一部分(8只小鼠樣本)用于熒光定量PCR檢測促炎因子和轉錄因子mRNA表達的檢測,一部分(6只小鼠樣本)用于JNK通路拮抗實驗,另一部分(6只小鼠樣本)用于Western blot檢測信號通路磷酸化水平的檢測,所有實驗均至少開展三次獨立重復實驗。
1.3.2 Poly I∶C免疫刺激和JNK信號通路拮抗實驗
將Poly I∶C干粉溶于PBS中,調(diào)整為終濃度2 mg/mL的儲液,凍存于-80℃冰箱備用。本實驗共設計兩個Poly I∶C濃度組,分別為對照組(0 μg/mL),實驗組(50 μg/mL),將作用后的F4/80hi亞群和F4/80lo亞群置于5% CO2濃度和37℃溫度下培養(yǎng)8 h。將JNK通路磷酸化抑制劑SP600125干粉溶于DMSO中,調(diào)整為終濃度10 mmol/L的儲液,低溫凍存?zhèn)溆谩T趯嶒灲M加入Poly I∶C刺激的同時,設置加入SP600125(10 μmol/L)處理組和同體積DMSO對照組(每組3個樣本,每個樣本為分選的6只小鼠細胞兩兩合并),同上述條件培養(yǎng)8 h。
1.3.3 實時熒光定量PCR檢測
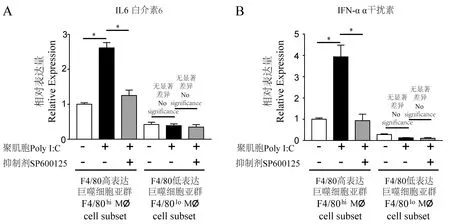
收集處理后的巨噬細胞亞群提取總RNA,采用Nanodrop微量分光光度計(Thermo,美國)測定提取RNA含量與質(zhì)量(1.8 1.3.4 Western blot 提取處理后的巨噬細胞亞群蛋白,BCA定量法測定蛋白濃度,聚丙烯酰胺凝膠電泳后,半干轉法電轉至PVDF膜,10%BSA封閉液室溫封閉1 h,加入比例稀釋后的JNK、p-JNK、GAPDH抗體工作液,置于往復式搖床4℃孵育過夜,二抗室溫孵育1 h。電化學發(fā)光顯影,用Image J軟件測定條帶的灰度值,以磷酸化JNK灰度值與JNK總蛋白灰度值的比值作為蛋白的相對表達量。共收集6只小鼠腹腔巨噬細胞樣本,由于CD11b+F4/80lo亞群占總細胞比例較低,為保證其細胞量不低于5×105,將收集的樣本兩兩合并,分別進行了3次獨立重復實驗。在結果部分對其中一次代表性實驗結果進行闡述。 表1 實時熒光定量PCR引物信息Table 1 Primers for qRT-PCR detection 經(jīng)PBS緩沖液灌注沖洗,收集小鼠腹腔細胞。隨后行CD11b-PE-Cy7和F4/80-APC抗體染色標記,通過流式分選,獲得F4/80hi亞群和F4/80lo亞群細胞。其中CD11b+細胞占總細胞比例為(56.23±3.71)%;CD11b+F4/80hi巨噬細胞亞群占總細胞比例為(43.67±4.20)%,占CD11b+細胞比例為(77.23±3.16)%;CD11b+F4/80lo巨噬細胞亞群分別為(9.58±0.48)%和(17.23±1.39)%。F4/80hi亞群和F4/80lo亞群數(shù)量比較,P<0.05,具體結果見圖1。 表2 Poly I∶C免疫刺激8 h后巨噬細胞促炎因子和相關轉錄因子基因的相對表達量Table 2 Relative expression value of pro-inflammatory factors and related transcription factor in macrophages with/without 8 h of Poly I∶C stimulation 利用上述引物(見表1),對Poly I∶C作用后巨噬細胞促炎因子IL6、iNOS、IFNα、IFNγ和信號通路相關轉錄因子IRF3、IRF7信使RNA的表達水平,進行熒光定量PCR檢測。加入無Poly I∶C普通培養(yǎng)基的F4/80hi亞群設置為對照組(RQ=1),統(tǒng)計兩個亞群巨噬細胞在Poly I∶C刺激前、后促炎因子和轉錄因子相對表達量(表2),并計算兩個亞群巨噬細胞在Poly I∶C刺激后促炎因子和信號通路相關轉錄因子表達倍數(shù)的變化,具體結果見表3。 巨噬細胞經(jīng)典M1型極化指標IL6和iNOS,相較于對照組,F(xiàn)4/80hi亞群IL6、iNOS表達增高(2.61±0.32)倍和(2.05±0.36)倍,F(xiàn)4/80lo亞群為(1.32±0.10)倍和(1.02±0.12)倍;同時F4/80hi亞群對Poly I∶C刺激的效應因子IFNα、IFNγ表達增加(3.90±0.54)倍和(2.29±0.29)倍,F(xiàn)4/80lo亞群為(1.37±0.10)倍和(1.22±0.10)倍。在病毒感染過程中,巨噬細胞通過胞膜模式受體識別病原,經(jīng)胞內(nèi)信號轉導上調(diào)核內(nèi)IRF3和IRF7轉錄,從而激活干擾素刺激反應原件(interferon stimulated response element, IRSE)的活性以發(fā)揮抗病毒和病原清除效應[11]。相較于對照組,F(xiàn)4/80hi亞群表達IRF3、IRF7表達增高(2.66±0.15)倍和(3.01±0.17)倍,F(xiàn)4/80lo亞群為(1.21±0.11)倍和(1.16±0.07)倍。綜上,F(xiàn)4/80lo亞群相關因子增高倍數(shù)均未能大于1.4倍,提示該亞群對Poly I∶C刺激不敏感;而F4/80hi亞群相關炎性因子和轉錄因子指標增高倍數(shù)均顯著高于F4/80lo亞群,P<0.05。 注:A:流式細胞術分選F4/80hi亞群和F4/80lo亞群劃門策略;B:目的細胞占總細胞數(shù)百分比(左)或占CD11b+細胞數(shù)百分比(右)。F4/80高表達亞群與F4/80低表達亞群比較,*P<0.05。圖1 F4/80hi亞群和F4/80lo亞群巨噬細胞相對數(shù)量Note. A, Gating Strategy for sorting F4/80hi subsetand F4/80losubset by Flow cytometre. B, Percentage of target cells in total cells (left panel) or in CD11b+ cells (right panel).F4/80hi subset Compared with F4/80lo subset,*P<0.05.Figure 1 The percentage of F4/80hi subset and F4/80losubset in total cells or CD11b+ cells 表3 Poly I∶C免疫刺激8 h后巨噬細胞促炎因子和相關轉錄因子基因表達倍數(shù)的變化Table 3 Fold changes of pro-inflammatory factors and related transcription factor in macrophages after 8 h of Poly I∶C stimulation 注:A:Western blot檢測JNK信號通路磷酸化與表達水平代表圖,采用GAPDH作為內(nèi)參;B:Image J 軟件對目的條帶灰度值量化統(tǒng)計分析。圖2 JNK信號通路磷酸水平差異的檢測Note. A, Phosphorylation and expression level of JNK signal pathway was detected by Western blot, GAPDH was loaded as internal reference. B, Intensities of the Western blot bands were quantitated by ImageJ software.Figure 2 Phosphorylation level of JNK signal pathway 前期研究發(fā)現(xiàn),Poly I∶C可誘導巨噬細胞IRF7表達上調(diào),通過激活JNK信號通路以促進M1型極化反應[12]。Poly I∶C作用F4/80hi亞群后,其JNK通路磷酸化水平(相對表達量為1.19.)相較于對照組(相對表達量0.29),呈升高趨勢。Poly I∶C作用F4/80lo亞群后,JNK通路磷酸化水平(相對表達量為0.064)相較于對照組磷酸化水平(相對表達量0.075),無明顯變化趨勢,具體結果見圖2。 為進一步研究JNK信號通路在腹腔異質(zhì)性巨噬細胞亞群應答Poly I∶C過程中的作用機制,在Poly I∶C作用的同時,加入JNK通路磷酸化抑制劑SP600125,以觀察阻斷JNK通路磷酸化對F4/80hi亞群和F4/80lo亞群促炎因子IL6和IFNα表達的影響。以無Poly I∶C和SP600125普通培養(yǎng)基的F4/80hi亞群為基線(RQ=1)。結果表明,未加入Poly I∶C刺激,F(xiàn)4/80hi亞群巨噬細胞,IL6相對表達量為1.00 ± 0.02,IFNα相對表達量為1.00 ± 0.03;Poly I∶C刺激后的F4/80hi亞群巨噬細胞,IL6相對表達量(2.64±0.05)和IFNα相對表達量(3.93±0.18)均顯著上調(diào),P<0.05;加入SP600125作用后,F(xiàn)4/80hi亞群巨噬細胞IL6相對表達量(1.25±0.05)和IFNα相對表達量(0.93±0.13)均顯著下調(diào),P<0.05。未加入Poly I∶C刺激,F(xiàn)4/80lo亞群巨噬細胞,IL6相對表達量為(0.32±0.02),IFNα相對表達量為(0.22±0.02);Poly I∶C刺激后的F4/80lo亞群巨噬細胞,IL6表達(0.37±0.01)和IFNα表達(0.17±0.02),與未加入Poly I∶C的F4/80lo亞群巨噬細胞組相比均無顯著差異;加入SP600125作用后,F(xiàn)4/80lo亞群巨噬細胞IL6相對表達量(0.34±0.02)和IFNα相對表達量(0.11±0.01),與加入Poly I∶C但未加入SP600125的F4/80lo亞群巨噬細胞組相比均無顯著差異,具體結果見圖3。 注: A: 促炎因子IL-6基因表達的變化; B:促炎因子IFNα基因表達的變化。F4/80高表達亞群Poly I∶C刺激前與刺激后比較;F4/80高表達亞群加入抑制劑與未加入抑制劑的比較,*P<0.05。圖3 阻斷JNK信號活化后促炎因子IL-6和 IFNα基因表達變化Note. A, Relative expression of IL-6. B, IFNα.F4/80hi subset oafter Poly I∶C stimulation compared with before Poly I∶C stimulation, F4/80hi subset with SP600/25 stimulation compared with without SP600/25 stimulation,*P<0.05.Figure 3 Relative expression level of pro-inflammatory factors IL-6 and IFNα when phosphorylation of JNK signal pathway was attenuated 流行性感冒病毒(流感病毒)其感染的嚴重程度,和病毒引起的以過度炎癥反應為特征的細胞因子風暴呈正相關[13]。部分宿主在感染H1N1流感病毒后,免疫細胞過度激活進而釋放大量促炎細胞因子,引發(fā)細胞因子風暴,可發(fā)展為急性肺損傷,甚至可進展為急性呼吸窘迫綜合征,導致呼吸衰竭與多器官損傷[14]。本研究通過研究異質(zhì)性巨噬細胞亞群對早期病毒感染差異化應答及相關機制,發(fā)現(xiàn)在Poly I∶C誘導的病毒感染模型中,F(xiàn)4/80hi巨噬細胞亞群在病毒感染早期活化程度顯著性高于F4/80lo亞群。F4/80hi巨噬細胞亞群釋放大量的促炎細胞因子IL6,IFNα、IFNγ,同時轉錄因子IRF3和IRF7顯著上調(diào),通過活化JNK信號通路推進其促炎表型的形成,而抑制JNK通路磷酸化可顯著抑制F4/80hi亞群致敏性。該結果進一步提示我們,定向干預F4/80hi巨噬細胞亞群過度激活,可能對抑制或延緩細胞因子風暴的發(fā)生起著積極重要作用。 固有免疫系統(tǒng)是機體抵抗病毒侵染的第一道防線,同時也是適應性免疫發(fā)展的基礎。近年來,固有免疫中樹突狀細胞(DC)和巨噬細胞在抗病毒中的作用備受關注。髓系DC(mDC)可以主動攝取乙肝病毒抗原肽,通過MHCΙ類分子途徑提呈抗原肽至CD8+T細胞,進而引發(fā)Th1型免疫反應[15]。而在巨細胞病毒感染中,漿細胞樣DC(pDC)可通過分泌干擾素誘導Th2型免疫反應[16]。有報道表明,M1型巨噬細胞過度活化可導致急性流感病毒感染患者細胞因子風暴的產(chǎn)生,在感染早期介入抑制M1型巨噬細胞的過度激活,可以有效改善預后[17]。在本研究中我們發(fā)現(xiàn),F(xiàn)4/80hi巨噬細胞亞群在早期病毒感染中促炎因子IL6、iNOS、IFNα、IFNγ表達上調(diào)。已有報道表明[18],F(xiàn)4/80hi巨噬細胞亞群成熟度和吞噬能力高于F4/80lo亞群。提示我們在病毒感染早期,可以通過氯磷酸鹽脂質(zhì)體類藥物清除過度活化的F4/80hi亞群,以降低細胞因子風暴產(chǎn)生風險。然而隨著病毒感染進程的推進,F(xiàn)4/80lo巨噬細胞亞群可能定向發(fā)育為F4/80hi亞群,此時采用氯磷酸鹽脂質(zhì)體清除巨噬細胞后是否能夠抑制過度激活、能夠真正利于機體病毒清除還有待進一步研究。 前期研究發(fā)現(xiàn),功能異質(zhì)性巨噬細胞亞群和組織特異性巨噬細胞亞群在白血病微環(huán)境中起著迥然相異的作用,其激活信號通路途徑也不盡相同[19-21]。相較于脾巨噬細胞亞群,骨髓巨噬細胞亞群IRF7基因表達顯著上調(diào)并活化JNK信號通路,誘導其促炎M1型表型與功能[12]。本研究發(fā)現(xiàn),F(xiàn)4/80hi巨噬細胞亞群在病毒感染后IRF7基因高表達,且JNK磷酸化激活,提示我們IRF7-JNK通路可能在成熟巨噬細胞抗病毒早期免疫應答過程中起著重要作用。因此,采用SP600125等抑制JNK通路激活的化學類抑制劑,亦可作為阻斷巨噬細胞過度激活的有效手段。 綜上,研究異質(zhì)性巨噬細胞在病毒感染免疫應答與活化中的作用與機制,進而探討并開發(fā)新的免疫抑制劑與靶向小分子抑制劑,對防止或延緩病毒侵染導致細胞因子風暴的發(fā)生具有重要意義,同時將為疾病的預防與治療提供積極的幫助。1.4 統(tǒng)計學方法


2 結果
2.1 腹腔F4/80hi亞群和F4/80lo亞群相對數(shù)量的比較

2.2 Poly I∶C免疫刺激下巨噬細胞亞群促炎因子和轉錄因子表達變化趨勢


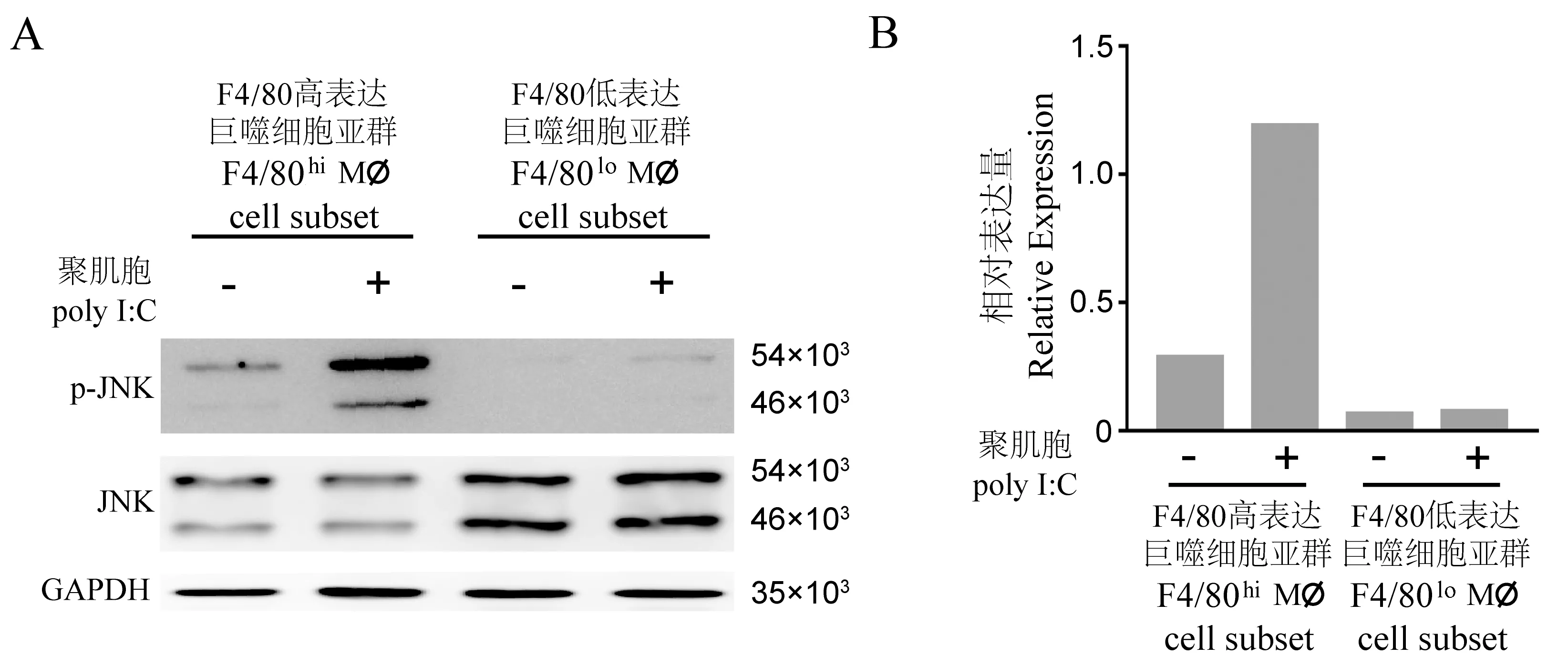
2.3 Poly I∶C免疫刺激下F4/80hi亞群和F4/80lo亞群信號通路的變化
2.4 阻斷JNK通路活化對Poly I∶C作用后F4/80hi亞群和F4/80lo亞群促炎因子表達的影響
3 討論

