三七原生質體的制備
王琪 雷秀娟 張浩 王英平
摘要:原生質體因打破了細胞壁的限制,成為遺傳轉化和體細胞雜交的理想受體。為了以酶解法制備高產量、高活力的三七原生質體,基于組織培養技術,以三七的愈傷組織為試驗材料,設置不同纖維素酶和果膠酶的濃度配比,同時探究三七愈傷組織不同培養天數、不同酶解時間、酶液不同滲透壓以及離心純化收集原生質體時不同離心力對原生質體制備的影響,確定三七愈傷組織原生質體分離的最佳條件,以獲得較高產量和活力的原生質體材料。結果表明,三七愈傷組織繼代培養15 d,酶液組成為15 mg/mL纖維素酶+7 mg/mL果膠酶+CPW液+0.7 mol/L甘露醇,酶解時間為 7 h,以800 r/min離心收集原生質體時其產量和活力較高。
關鍵詞:三七;原生質體;酶解法;純化;原生質體活力
中圖分類號: S567.23+6.01? 文獻標志碼: A
文章編號:1002-1302(2020)19-0045-03
收稿日期:2019-12-05
基金項目:中國農業科學院科技創新工程項目(編號:CAAS-ASTIP-2016-ISAPS)。
作者簡介:王 琪(1995—),女,山東淄博人,碩士研究生,從事基因編輯與原生質體融合研究。E-mail:1453865882@qq.com。
通信作者:王英平,博士,研究員,從事藥用植物資源與育種研究。E-mail:yingpingw@126.com。
原生質體是除去細胞壁后被質膜包裹的有生活力的細胞,具有細胞全能性[1]。因沒有細胞壁的限制,原生質體成為遺傳轉化、細胞雜交、新型育種的理想材料之一[2]。三七是五加科人參屬的一種極具藥用價值的草本植物,主產于我國云南省,具有活血化瘀、消腫定痛的功效[3]。本試驗對三七原生質體的制備條件進行研究,以期為三七的轉化試驗和雜交育種等奠定基礎。
1 材料與方法
1.1 主要儀器
試驗儀器主要有臺式冷凍離心機、普通光學顯微鏡、熒光顯微鏡、超凈工作臺、恒溫振蕩器、血球計數板、高壓滅菌鍋、電子天平、恒溫水浴鍋等。
1.2 主要試劑
試驗試劑主要有纖維素酶(上海源葉生物科技有限公司)、果膠酶(上海源葉生物科技有限公司)、甘露醇(美國Sigma公司)、熒光素雙醋酸酯(FDA)(美國Sigma公司)、細胞-原生質體清洗液(CPW液)(27.2 mg/L KH2PO4、101.0 mg/L KNO3、1 480.0 mg/L CaCl2·2H2O、246.0 mg/L MgSO4·7H2O、0.16 mg/L KI、0.025 mg/L CuSO4·5H2O )、蔗糖、瓊脂粉、天門冬氨酸(Asp)、核苷酸、氫氧化鈉、水解乳蛋白(國藥集團化學試劑有限公司)等。
1.3 試驗方法
1.3.1 三七愈傷組織繼代培養
試驗所用的三七愈傷組織為中國農業科學院特產研究所誘導培養。挑選質地較軟、易于分散、顏色鮮黃、生長狀態一致的愈傷組織進行繼代培養,培養基為MS基本培養基+1.5 mg/L 2,4-二氯苯氧乙酸+8 mg/L Asp+8 mg/L 核苷酸+0.5 g/L水解乳蛋白+60 g/L 蔗糖+5.5 g/L 瓊脂,繼代后的同一批材料分別暗培養5、10、15、30、40、60 d,探究三七愈傷組織不同的培養時間對于原生質體產量和活力的影響。
1.3.2 三七原生質體分離
以酶解法分離原生質體時,其產量和活力受酶的種類、酶液配比、酶解時間、滲透壓等多方面因素的影響[4]。原生質體分離的基礎條件為1%纖維素酶+0.5%果膠酶+13%CPW液[5],暗酶解6 h并以600 r/min轉速純化原生質體。對纖維素酶和果膠酶的濃度配比、酶解時間、甘露醇濃度設置不同水平進行單因素試驗,每組設3次重復。酶液用NaOH溶液調節pH值為58~60,附加0.3 mmol/L 2-(N-嗎啡啉)乙磺酸(MES)緩沖液作為pH值穩定劑,酶液經 0.22 μm 過濾器過濾滅菌使用。酶解前將酶液于37 ℃ 進行預熱活化,愈傷組織中酶液加入量為 10 mL/g,在100 r/min轉速的搖床上振蕩酶解,酶解溫度為25 ℃。
1.3.3 原生質體純化
以離心沉淀的方式對原生質體進行純化。將酶解產物經100 μm濾網過濾,除去較大的或酶解不完全的細胞團,收集濾液。將濾液離心2 min,用移液器回收上清酶液。向離心管底部沉淀加入10 mL CPW液,離心洗滌2 min棄上清,重復2次。用10 mL液體培養基離心1 min,洗滌原生質體1次。用5 mL培養液重懸原生質體。設置離心轉速為200、400、600、800、1 000、1 500、2 000 r/min 等7個水平,離心收集原生質體后觀察其形態并計算產量。
1.3.4 原生質體產量計算
用25×16血球計數板進行計數[6]。將純化收集的原生質體溫和顛倒幾次混勻后,吸取1.0 mL用培養液稀釋3~5倍,取10 μL 滴加在計數板上,每個樣品計數3次取平均值。原生質體數(個/mL)=80個小格內原生質體數÷80×400×10 000×稀釋倍數,原生質體產量(個/g)=原生質體數(個/mL)×純化懸浮體積÷酶解材料質量。
1.3.5 原生質體活力檢測
以熒光雙醋酸酯(FDA)染色法檢測原生質體活力[7]。FDA用丙酮溶液配制,使用濃度為5 mg/mL,取1 mL純化后的原生質體加入25 μL丙酮-FDA溶液,染色5~10 min,吸取100 μL制片,在熒光顯微鏡495 nm波長下進行觀察統計,有活力的原生質體在視野下呈現綠色熒光且活力越高熒光越強。每個試驗組取樣3次,每次觀察3個視野取平均值。原生質體活力=視野內發光細胞數/視野內細胞總數×100%。
2 結果與分析
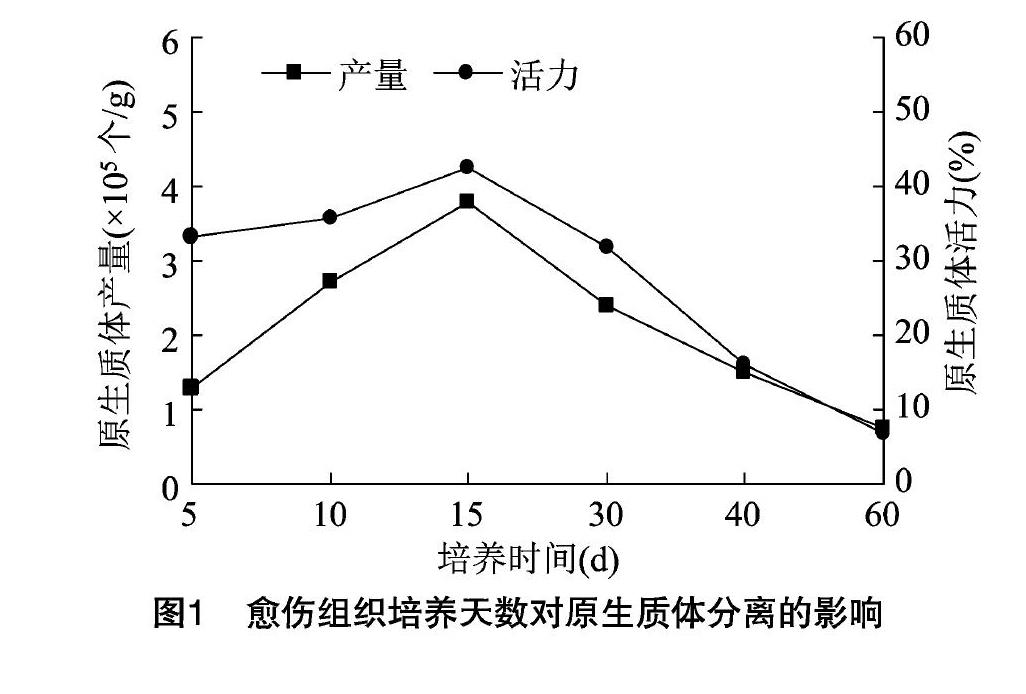
2.1 不同培養天數對原生質體產量和活力的影響
取同一時間繼代,分別培養5、10、15、30、40、60 d 的三七愈傷組織各0.5 g,加入5 mL酶液,設3組重復,數據取平均值。在100 r/min轉速搖床上酶解6 h,經CPW液洗滌2次,培養液洗滌1次,用5 mL培養液重懸并進行計數,統計原生質體的產量,以FDA染色法檢測原生質體活力。結果(圖1)表明,對培養15 d的愈傷組織進行酶解能獲得較高的產量和活力。培養30 d以后的愈傷組織產量和活力都明顯下降,原因可能是培養后期愈傷組織變得緊實密集,不易分散導致酶解不完全,且長時間不更換培養液,所需營養成分缺失,細胞次生代謝產物積累,細胞活力下降。
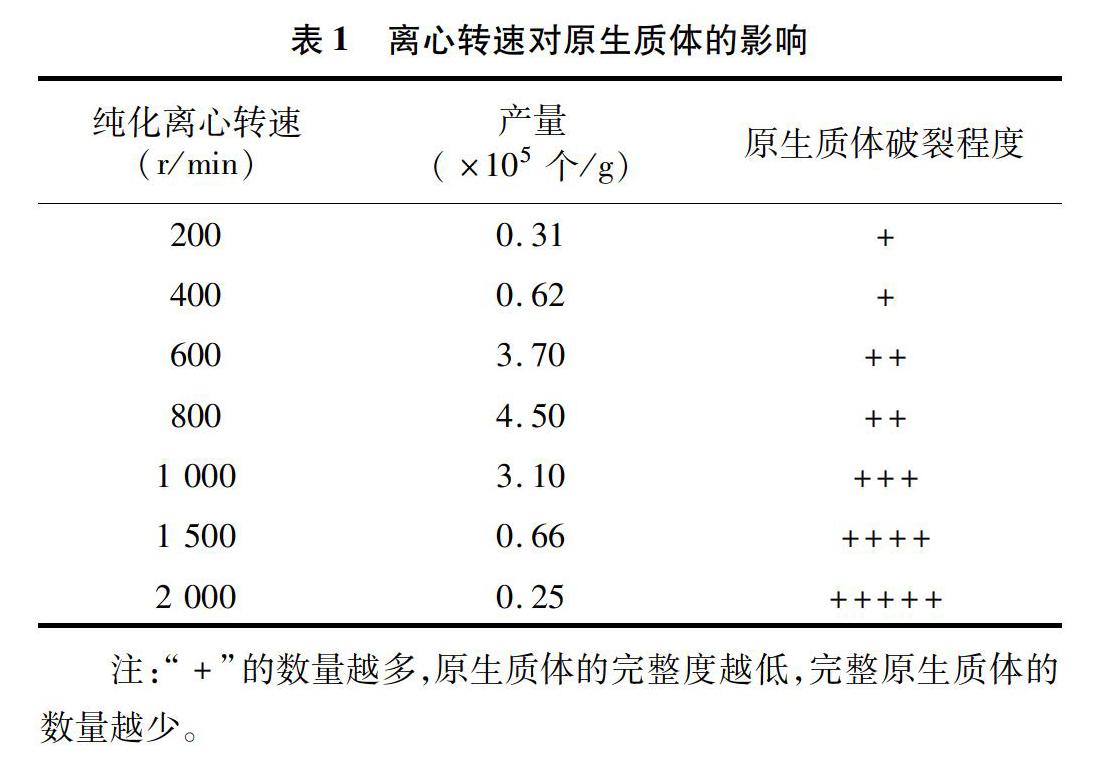
2.2 不同離心轉速對原生質體產量和完整度的影響
將繼代培養15 d的3 g愈傷組織用鑷子分散,加入30 mL酶液,在100 r/min轉速搖床上暗培養酶解 6 h,溫和顛倒混勻后用移液器吸4 mL培養液至7支15 mL離心管中,分別以200、400、600、800、1 000、1 500、2 000 r/min轉速離心,對酶解的原生質體進行洗滌純化。用CPW液洗滌2次,用培養液洗滌1次,加入5 mL培養液重懸原生質體,取1 mL懸浮液稀釋3倍,再吸取10 μL于血球計數板在顯微鏡下計數并觀察原生質體完整度,試驗重復3次。由表1可知,將離心轉速設為800 r/min時可以獲得較高的原生質體產量,且完整度較高。分析原因可能是離心轉速較低時,原生質體沉集不完全,會在純化過程中隨上清液流失;離心轉速較高時會增加原生質體與管壁的碰撞次數和壓力,導致原生質體破裂,細胞完整度下降,碎片增加且產量降低。
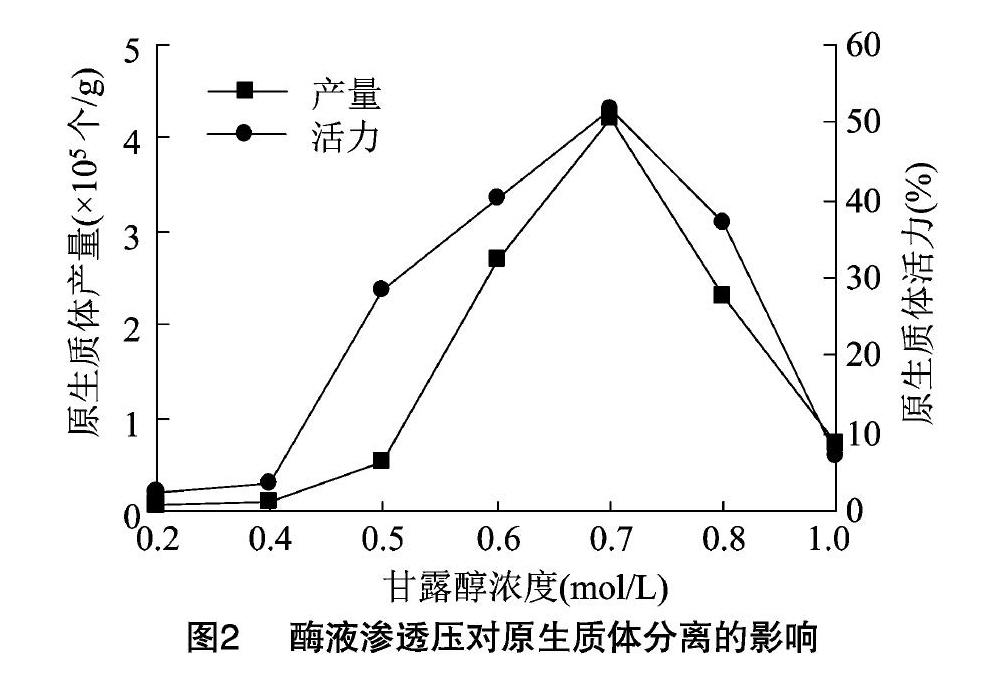
2.3 不同滲透壓對原生質體分離的影響
取繼代15 d的3 g愈傷組織用鑷子分散,加入30 mL酶液,取7支離心管,每管分裝4 mL酶解液,分別按0.2、0.4、0.5、0.6、0.7、0.8、1.0 mol/L加入對應濃度的甘露醇,在100 r/min轉速搖床上暗培養酶解6 h。結果(圖2)表明,甘露醇濃度在0.2~0.4 mol/L 之間時,原生質體的產量和活力很低,分析原因可能是該濃度的滲透壓相對于組織細胞過低,顯微鏡下很多細胞體積膨脹,細胞質外流,細胞破裂;甘露醇濃度在0.5~0.7 mol/L之間時,隨著滲透壓增加,原生質體的產量和活力逐漸增加,顯微鏡下細胞形態多為球形,細胞形態較為穩定;甘露醇濃度繼續增加后細胞體積減小,原生質體皺縮,產量和活力都下降,且在濃度為1.0 mol/L時產量大幅減少,活力也極低。因此以0.7 mol/L濃度的甘露醇調節酶液滲透壓時能獲得較高的原生質體產量和活力。
2.4 不同酶解時間對原生質體分離的影響
取培養15 d的0.5 g愈傷組織于5 mL酶液中酶解,材料的酶解時間設置7個水平,分別為3、5、7、8、9、11、13 h。在對應的培養時間取樣進行原生質體產量和活力的計算。如圖3所示,隨著酶解時間的增加,原生質體的產量和活力呈現先上升后下降的趨勢。酶解3 h左右在顯微鏡下能觀察到較多大的細胞團,游離的細胞數量少,原生質體的產量和活力較低;酶解5~9 h時,原生質體的釋放量逐漸增多,但活力呈現先下降后上升的趨勢;酶解9 h后,原生質體的產量明顯降低,顯微鏡下細胞碎片增多,活力急劇下降。酶解7 h與酶解8 h時原生質體的產量差異不明顯,但酶解7 h時原生質體的活力較高。高活力的原生質體更有利于后期的培養和應用,因此將酶解7 h設為最佳酶解時間。
2.5 不同酶液配比對原生質體分離的影響
纖維素酶液濃度(質量體積比)設置3個水平,分別為10、15、20 mg/mL,果膠酶液濃度(質量體積比)設置3個水平,分別為5、7、9 mg/mL,共計9種不同的酶液組合,酶解7 h后計算原生質體的產量和活力。如表2所示, 當纖維素酶濃度為20 mg/mL、
果膠酶濃度為7 mg/mL時,原生質體產量可達到682×105個/g,但活力僅為33.7%;當纖維素酶濃度為15 mg/mL、果膠酶濃度為7 mg/mL時,原生質體產量為644×105個/g,活力達到59.6%;當纖維素酶濃度為15 mg/mL,果膠酶濃度分別為7、9 mg/mL 時,二者的產量差異不明顯,但原生質體的活力差異明顯。原生質體的數量可以通過富集提高,而活力較高的原生質體更有利于后期的培養和應用,綜合考慮,將最佳酶液配比組合設置為 15 mg/mL 纖維素酶+7 mg/mL果膠酶。
3 討論與結論
原生質體的產量和活力受多種因素的影響,如材料的基因型和生理狀態、培養基成分、制備方式、制備條件等。本研究以酶解法分離三七原生質體,將繼代培養15 d的材料在15 mg/mL纖維素酶+7 mg/mL 果膠酶+CPW液+07 mol/L 甘露醇的酶液中酶解7 h,并以800 r/min純化收集原生質體時,能獲得較為理想的原生質體材料,產量為 6.44×105個/g,活力為59.6%。試驗結果為下一步進行原生質體制備條件的優化和原生質體的培養再生奠定了基礎。
參考文獻:
[1]彭 章,童華榮,梁國魯,等. 茶樹葉片和胚根原生質體的分離及PEG誘導融合[J]. 作物學報,2018,44(3):463-470.
[2]蔡 肖,康向陽. 小青楊葉肉原生質體分離條件的研究[J]. 中國農學通報,2011,27(10):18-22.
[3]李云鶴,王曉梅. 試論中藥三七對血液系統的藥理藥效作用[J]. 中國現代藥物應用,2016,10(8):253-254.
[4]Wei Z M,Xu Z H. Plant regeneration from protoplasts of soybean(Glycine max L.)[J]. Plant Cell Reports,1988,7(5):348-351.
[5]王 義,楊 晶,張 穎,等. 人參原生質體的分離培養[J]. 吉林農業大學學報,2009,31(3):268-272.
[6]李 曉. 馬鈴薯原生質體培養再生及利用CRISPR/Cas9瞬時轉化的研究[D]. 呼和浩特:內蒙古大學,2019.
[7]蘇 彤,姚陸銘,張 鑫,等. 大豆愈傷原生質體的制備和培養方式探究[J]. 大豆科學,2018,37(5):741-747.

