一種高效提取干燥植物樣品DNA的方法
任夢云 陳彥君 王建軍 王美興 黃益峰 杜龍崗 關瀟
摘要:野外采集樣品通常采用硅膠干燥的方法,但會不同程度降解DNA影響提取效果。為解決干燥植物樣品DNA難提取的問題,提出CTAB法與全式金植物基因組DNA提取試劑盒相結合的方法,并以4種中藥材為試驗材料,利用改良CTAB法、傳統CTAB法及試劑盒法等進行鑒定,并用PCR擴增和酶切驗證檢測提取DNA的質量。結果表明,CTAB法與全式金植物基因組DNA提取試劑盒相結合的方法能夠有效去除多酚和糖類物質對DNA提取的干擾,并有效富集DNA,尤其適用于臨近干燥或枯萎的植物干燥葉片,PCR擴增和酶切反應進一步證明利用該方法提取DNA能夠達到下游試驗的要求。本研究有效解決了傳統方法提取干燥樣品DNA低效的問題,能為接下來分子標記的開發、遺傳多樣性和后續遺傳學分析提供基礎。
關鍵詞:干燥植物;DNA提取方法;DNA產率;瓊脂糖凝膠;電泳;PCR擴增;酶切試驗
中圖分類號:Q94-34+1;S184 ??文獻標志碼: A
文章編號:1002-1302(2020)19-0048-04
收稿日期:2019-10-08
基金項目:浙江省農業(糧食)新品種選育重大科技專項(編號:2016C02050-9-2)。
作者簡介:任夢云(1991—),女,安徽淮北人,博士,助理研究員,從事分子生物學研究。E-mail:916103207@qq.com。
通信作者:關 瀟,博士,高級工程師,從事轉基因作物風險評估工作,E-mail:cynthia815@126.com;杜龍崗,碩士,副研究員,從事鮮食玉米新品種選育及相關耕作制度研究,E-mail:dlg138@163.com。
從植物組織中提取高質量的基因組DNA是進行分子生物學研究的第1步和必要條件[1]。高質量的基因組DNA是進行如簡單重復序列標記(SSR)、限制性內切酶片段長度多態性(RFLP)、隨機擴增多態性DNA標記(RAPD)、簡單重復序列間擴增(ISSR)等后續遺傳多樣性分析的基礎[2]。迄今為止,人們提出了諸多提取DNA的方法,目前最常用的提取方法是十二烷基苯磺酸鈉(SDS)法、十六烷基三甲基溴化銨(CTAB)法[3]。遠距離采樣一般無法對材料即刻提取DNA,通常采用硅膠脫水干燥保存。然而有研究表明,從硅膠保存的植物樣品中提取的基因組DNA會出現不同程度的降解現象,而且DNA的質量和濃度不及從新鮮樣品中提取到的DNA[4]。尤其枯萎的植物樣品中DNA易被核酸內源酶降解,硅膠干燥后DNA降解程度更加嚴重,造成DNA提取質量下降[5]。因此,亟待開發一種能夠適用于臨近枯萎植物干燥樣品的基因組DNA提取通用方法以適應研究要求。
本研究以山莨菪(Anisodus tanguticus)、桃兒七(Sinopodophyllum hexandrum)、四數獐牙菜(Swertia tetraptera)、橢圓葉花錨(Halenia elliptica)4種中草藥為材料,分別從紫外吸光度、凝膠電泳、PCR擴增、酶切驗證等方面對傳統CTAB法、改良CTAB法和試劑盒法3種DNA基因組的提取方法進行比較,以期尋找能提取干燥樣品較好質量DNA的方法。
1 材料與方法
1.1 材料
山莨菪、桃兒七、四數獐牙菜、橢圓葉花錨分別來源于甘肅省門源縣、碌曲縣神山山、臨潭縣貢巴寺和貢巴寺,樣本均于2016年9月采集。
本研究中的改良CTAB法裂解緩沖液與常規配方相同,具體如下:CTAB 20 mg/mL,NaCl 1.4 mol/L,二胺四乙酸(EDTA)0.01 mol/L,三羥甲基氨基甲烷(Tris)0.1 mol/L,調節pH值至8.0。
1.2 DNA提取
分別采用傳統CTAB法、北京全式金生物技術有限公司提供的DNA提取試劑盒(目錄號為EE111)法(簡稱試劑盒法)以及改良CTAB法(即利用傳統CTAB法與試劑盒法相結合的方法)提取4種植物的基因組DNA。改良CTAB法中所述的EB、BB1、CB1、WB1、RnaseA均來自北京全式金生物技術有限公司提供的DNA提取試劑盒(目錄號為EE111),根據該試劑盒說明書的記載,EB、BB1、CB1、WB1分別為溶解液、結合液1、清洗液1、洗液1。
取90 mg干燥植物材料,粉碎,分裝,分別用上述3種方法提取DNA,DNA提取試劑盒的方法嚴格按照操作說明進行。改良CTAB法步驟:(1)稱取30 mg干燥植物干材料,粉碎(如前所述);(2)加入已預熱CTAB裂解緩沖液和一定體積的RnaseA,渦旋振蕩,于65 ℃下水浴30~50 min,每隔5 min上下顛倒混勻;(3)轉移上清至干凈的離心管中,加入等體積的三氯甲烷-異戊醇(體積比為24 ∶1,下同),顛倒混勻,15 ℃,12 000 r/min,離心10 min,取上清;(4)轉移上清至干凈的離心管中,加入上清液2/3體積的預冷至-20 ℃的異丙醇,輕顛倒混勻,于-20 ℃下靜置30 min;(5)靜置液于15 ℃、12 000 r/min條件下離心10 min,倒掉上清,在離心管中加入400 μL EB溶液溶解沉淀,同時加入 400 μL 的三氯甲烷-異戊醇混合液,上下顛倒混勻,于15 ℃、12 000 r/min條件下離心 10 min,取上清;(6)轉移上清至干凈的離心管中,加入等體積的BB1,顛倒混勻,將混合液轉移至干凈的離心柱中,于15 ℃、12 000 r/min條件下離心 5 min;(7)棄液體,加入500 μL CB1,靜置5 min,于15 ℃、12 000 r/min 條件下離心5 min;(8)棄液體,加入500 μL WB1,于15 ℃、12 000 r/min條件下離心 5 min,重復本步驟至少1次;(9)棄液體,于15 ℃、12 000 r/min條件下離心5 min,徹底去除殘留的WB1;(10)棄離心管,將離心柱放置在干凈濾紙上風干5 min;(11)將離心柱轉移到干凈的離心管中,向離心柱中心膜上加入40 μL預熱至60~70 ℃的EB,靜置2 min,于15 ℃、12 000 r/min條件下離心 2 min,重復本步驟至少1次;(12)棄離心柱,收集所得離心液,即得植物基因組DNA;(13)測定DNA的濃度和純度,-20 ℃保存。
1.3 DNA產率和質量檢測
1.3.1 瓊脂糖凝膠電泳檢測
比較不同方法提取DNA的得率,瓊脂糖凝膠電泳時每個樣品上樣3 μL DNA溶液。配制1%瓊脂糖凝膠,電泳液為1×TBE緩沖液[生工生物工程(上海)股份有限公司],GoldView(北京賽百盛基因技術有限公司)染色,于100 V條件下電泳30 min。利用UPV紫外成像系統(EC3 system,美國)掃描成像。
1.3.2 分光光度計檢測
采用紫外分光光度計(Merinton,SMA4000)分別測量DNA溶液在230、260、280 nm處的吸光度。通過計算D260 nm/D280 nm和D230 nm/D260 nm的值分別獲得DNA溶液中蛋白、多糖、酚類的含量以及RNA的污染度,從而估算DNA濃度,公式為DNA樣品濃度(μg/μL)=D260 nm×稀釋倍數×50。
1.3.3 PCR檢測
通過PCR(德國Biometra公司)反應驗證改良CTAB法所獲得的DNA的質量,25 μL PCR反應體系包含12.5 μL 2×Taq PCR Master Mix、上下游引物各0.5 μL、2 μL基因組DNA(濃度約為40 ng/μL)、9.5 μL ddH2O。用于擴增ITS序列的1對通用引物的序列為ITS1(5′-AGAAGTCGTAACAAGGTTTC-3′)、ITS4(5′-TCCTCCGCTTATTTATATGC-3′)[6]。PCR反應程序:95 ℃預變性5 min;95 ℃變性30 s,52 ℃退火45 s,72 ℃延伸1 min 40 s,35個循環;72 ℃終延伸10 min,16 ℃,停止反應。
1.3.4 酶切驗證
20 μL酶切體系包括:5 μL DNA模板(200 ng/μL),2 μL 10×FlyCutTM Buffer,0.5 μL EcoRⅠ酶(20 U/μL),12.5 μL ddH2O。PCR程序為37 ℃ 10 min,65 ℃ 20 min。
2 結果與分析
2.1 DNA得率和質量
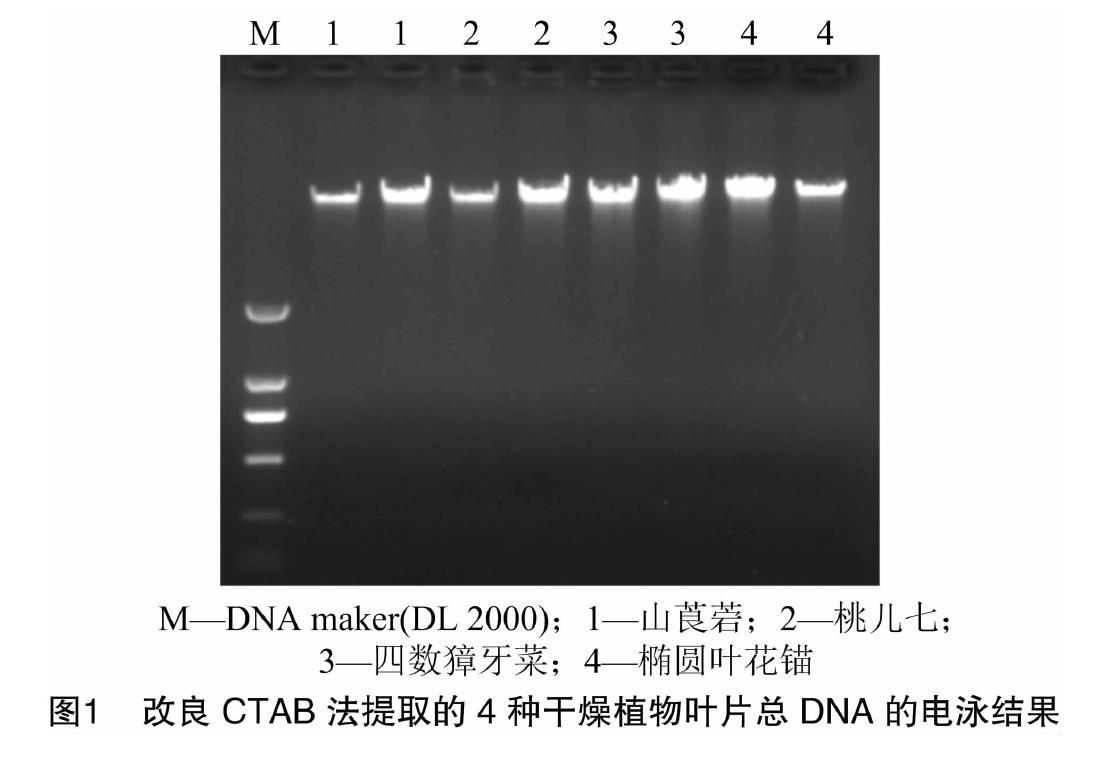
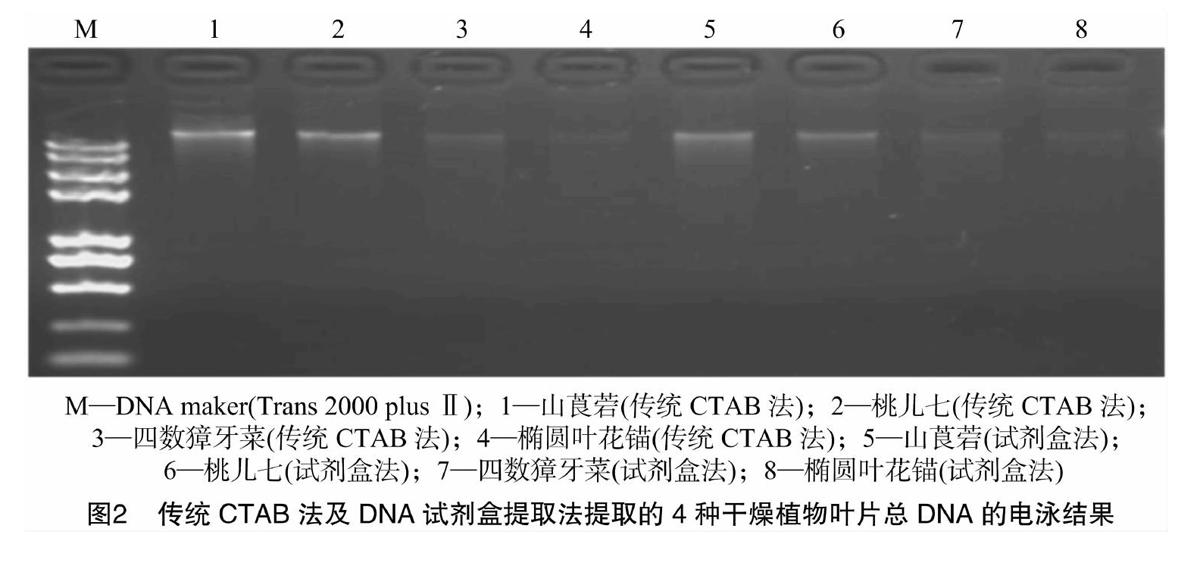
用3種不同的方法提取樣品基因組DNA,瓊脂糖凝膠電泳結果如圖1、圖2所示,DNA條帶清晰,無明顯降解拖尾現象,尤其改良CTAB法提取的DNA條帶清晰、明亮(圖1)。
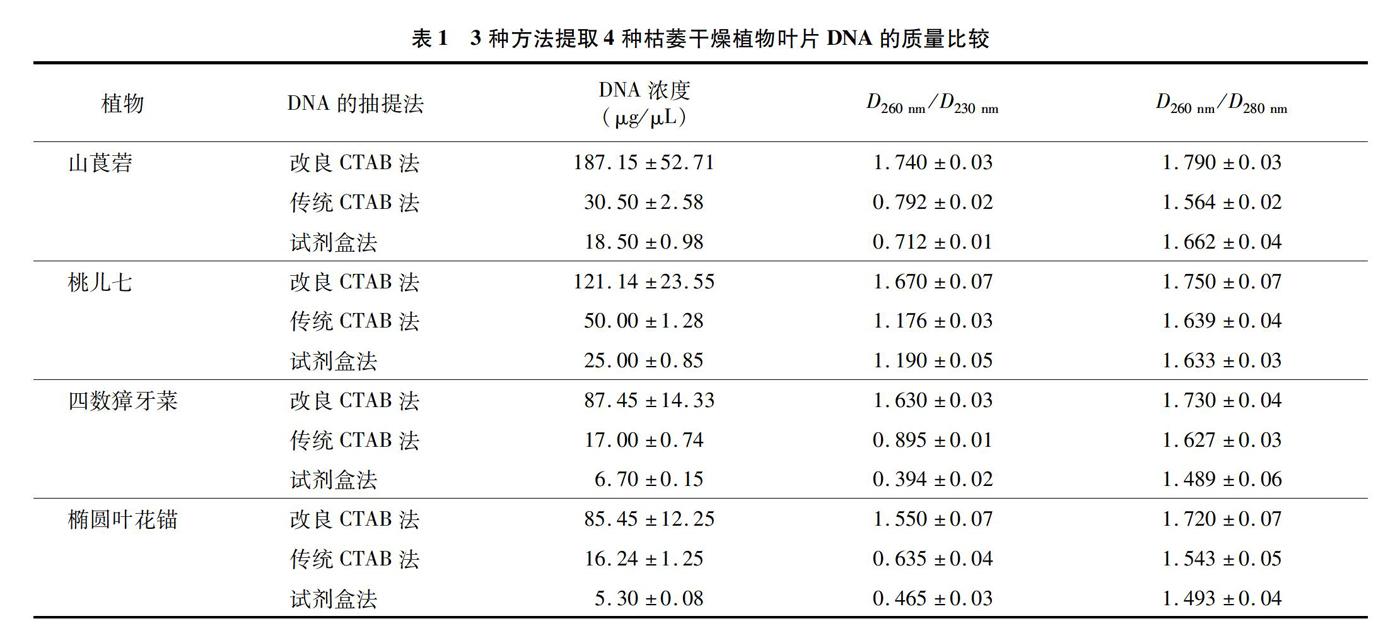
根據D260 nm/D280 nm的檢測值(表1)發現,改良CTAB法提取的DNA質量較好,傳統CTAB法和試劑盒法略差(D260 nm/D280 nm<1.7),說明這2種方法抽提的DNA中可能含有蛋白質雜質。改良CTAB法提取的DNA的濃度明顯高于其他2種提取方法,除山莨菪試劑盒法提取的DNA濃度最低。
2.2 PCR驗證和酶切試驗
DNA的提取是分子生物學研究中至關重要的第1步,因此DNA提取方法的適用性還需要下游試驗的驗證。本研究通過PCR和酶切進一步驗證該提取方法所獲得的DNA的質量。
利用ITS引物以本研究提取獲得的上述4種植物基因組DNA為模板,進行PCR擴增,結果見圖3。
4個樣品中都擴增出了清晰的目的條帶。PCR試驗結果證明,改良CTAB提取法獲得的植物基因組DNA符合下游試驗的要求。
EcoRⅠ限制性內切酶酶切電泳結果如圖4所示,酶切獲得的條帶在凝膠上呈均勻的彌散狀分布,這表明改良CTAB法的DNA純度良好,符合酶切試驗及下游試驗的要求。
3 討論與結論
在正常條件下,傳統CTAB法以及試劑盒法都可以用于植物基因組DNA的抽提,但是如果從DNA的濃度、純度和質量上綜合考慮來說,本試驗改良CTAB法提取干燥樣本植物基因組DNA效率最好。在實際工作中,仍然須要根據植物本身的特性和不同的試驗要求來選擇合適的提取方法[7-8]。
目前最好的植物基因組DNA提取材料是鮮樣或者是-80 ℃凍存保留的樣本材料[9-13]。但是當采樣地位于野外時,野外采樣一般無法對材料即刻提取DNA,通常采用硅膠干燥,而經過硅膠干燥保存的植物樣品的基因組DNA會發生不同程度的降解,提取的DNA質量和濃度遠比從鮮樣中提取的差。尤其枯萎的植物樣品中DNA易被核酸內源酶降解,硅膠干燥后DNA降解程度更加嚴重,提取質量下降。因此,針對長期遠距離采樣難保存樣品的問題,應尋找一種新的、簡便經濟實用的干燥樣本DNA提取方法。
本研究利用全式金基因組DNA提取試劑盒所改良的CTAB法,能夠有效去除多酚和糖類物質對DNA提取的干擾,尤其適應于臨近干燥或枯萎的植物干燥葉片,能夠有效地富集DNA,并消除顏色對DNA的影響。PCR試驗結果證明,改良CTAB法獲得的DNA能夠達到下游試驗的要求。與現有技術相比,該方法具有以下優點:(1)利用該方法從干燥植物樣品組織中獲得的DNA量顯著高于普通提取方法獲得的DNA,且DNA純度符合下游應用的要求。(2)經PCR和酶切試驗證明最終獲得的DNA能夠達到一般分子生物學研究的要求。(3)該提取方法具有通用、高效和簡便的特點。從表1和圖4可以看出,傳統CTAB法以及試劑盒法均不能從上述樣品中成功提取出DNA,紫外分光光度計檢測結果表明提取獲得的DNA純度較差,不符合下游試驗要求。本研究的改良CTAB法適合干燥樣本,干燥樣本操作方便,不受太多地理及環境因素的限定,適用于遠距離樣品的采集。
參考文獻:
[1]陳宗禮,陳昱宇,王睿婷,等. 組培棗苗基因組DNA提取方法及其含量的比較[J]. 基因組學與應用生物學,2011,30(1):110-116.
[2]李金璐,王 碩,于 婧,等. 一種改良的植物DNA提取方法[J]. 植物學報,2013,48(1):72-78.
[3]Murray M G,Thompson W F.Rapid isolation of high molecular weight plant DNA[J]. Nucleic Acids Research,1980,8(19):4321-4325.
[4]梁紅艷,付夢瑤,楊果果,等. 不同保存方法對檉柳基因組總DNA產量和質量的影響[J]. 基因組學與應用生物學,2016,35(8):2168-2172.
[5]Stange C,Prehn D,Arce-Johnson P.Isolation of pinus radiata genomic DNA suitable for RAPD analysis[J]. Plant Molecular Biology Reporter,1998,16(4):366.
[6]王國勛,張明理. 應用核DNA ITS序列探討廣義花楸屬(Sorbus L.)屬下系統關系[J]. 園藝學報,2011,38(12):2387-2394.
[7]李 萌,李 翔,龐曉明,等. 珍稀樹種廟臺槭不同組織DNA高效提取方法分析[J]. 分子植物育種,2019,17(4):1228-1237.
[8]Thomson D,Henry R.Use of DNA from dry leaves for PCR and RAPD analysis[J]. Plant Molecular Biology Reporter,1993,11(3):202-206.
[9]謝中穩,葛 頌,洪德元. 從普通野生稻硅膠干燥的小量葉片中制備DNA用于RAPD分析和總DNA庫的建立[J]. 植物學報,1999,41(8):807-812.
[10]吳 翼,劉 蕊,郭愛汕,等. 硅膠干燥對棕櫚科植物DNA提取效果的影響[J]. 江蘇農業科學,2019,47(18):83-86.
[11]Marla M P,Robert P A. In situ preservation of DNA in plant specimens[J]. Taxon,1989,38(4):576-581.
[12]Rogstad S H.Saturated NaCl-CTAB solution as a means of field preservation of leaves for DNA analyses[J]. Taxon,1992,41(4):701-708.
[13]Chase H W,Hills H H.Silica gel:an ideal material for field preservation of leaf samples for DNA studies[J]. Taxon,1991,40(2):215-220.

