TAT-SOD脂質體對UC模型大鼠的口服治療作用
周建森, 周秋婷, 葉 芬, 林春通, 劉航琪, 劉樹滔
(福州大學 生物工程研究所,福建 福州350002)
潰瘍性結腸炎(UC)是結腸的一種慢性特發性炎癥性腸病[1]。UC的發病機制很復雜,目前尚不明確。越來越多的證據表明,活性氧(ROS)在UC的發生和發展中起著至關重要的作用。ROS是一類含氧元素、具有高活性的小分子物質,主要包括·O2-、H2O2和·OH-。ROS是體內正常氧代謝的中間代謝產物,主要由線粒體呼吸鏈和NADPH氧化酶系統生成[2]。在正常情況下,機體的ROS和抗氧化水平處于一個動態平衡,并維持細胞和組織的正常功能。但是,當ROS超出平衡時,過量的ROS會造成生物分子(如磷脂、蛋白質、核酸)的氧化損傷,導致組織和細胞的結構和功能異常[3-4]。過量的ROS可以通過補充外源性的抗氧化劑來去除。
已有報道,多種抗氧化劑被應用于治療UC。例如,口服N-乙酰半胱氨酸(NAC)[5]、天然植物提取的多酚類化合物[6]等均可以改善UC動物模型結腸中的抗氧化狀態,減輕結腸炎癥。但是,這些抗氧化劑都是非特異性,可能有副作用,如引起惡心、嘔吐,甚至導致腎臟損傷等等[7-9]。
超氧化物歧化酶(SOD)是機體內源性自由基清除劑中重要的酶類抗氧化劑,也可望用于治療UC。它可以催化兩個超氧化物陰離子之間發生歧化反應,生成對人體傷害較低的過氧化氫和氧氣,其中的過氧化氫可以在過氧化物酶的作用下轉化成對人體完全無害的H2O和O2[10]。補充SOD傳統的方式是注射給藥。例如,靜脈注射人工合成的卵磷脂化的SOD可以降低UC小鼠的結腸損傷,但是其合成所用的交聯劑是否存在副作用仍存在疑問[11]。口服補充SOD是更加安全、方便的給藥方式,但是需要解決胃腸道消化使其失活的問題。已有一些口服SOD治療UC的研究。例如,蟲膠包被的SOD[12]、超穩定的SOD[13]均可抵抗胃腸道的消化并減輕UC小鼠的炎癥。前期研究發現,TAT-SOD是富含堿性氨基酸的TAT短肽與SOD的融合蛋白,它比SOD穩定并具有更好的細胞粘附性[14],這種生物粘附性可能會增強SOD與小腸上皮的黏附,從而延長SOD與腸道的結合。另外,脂質體包埋可保護藥物免受酸性條件下胃蛋白酶的破壞[15],可以提高SOD在腸道的生物利用度。作者嘗試探究TAT轉導肽修飾和脂質體包埋的SOD對UC模型大鼠的口服治療作用,以期為UC的輔助治療提供新的選擇。
1 材料與方法
1.1 實驗材料
TAT-SOD發酵液凍干粉:福州大學生物工程研究所提供;無水乙醇(分析純)、膽固醇(分析純)、胃蛋白酶(分析純):國藥集團化學試劑有限公司產品;大孔樹脂HPD500:滄州寶恩吸附材料科技有限公司產品;SOD:天津生命科學應用研究所產品;胰酶(分析純):美國Amersco公司產品;大豆卵磷脂(分析純):薩思化學技術(上海)有限公司產品;葡聚糖硫酸鈉(DSS):MPBiomedicals公司產品;BCA蛋白濃度測定試劑盒:上海碧云天生物技術有限公司產品;TritonX-114:美國Sigma公司產品;細菌內毒素檢測試劑盒:福州新北生化工業有限公司產品;SD大鼠:上海禹堃實驗動物有限公司產品;大鼠血清脂多糖(LPS)檢測試劑盒:江蘇酶標生物科技有限公司產品。
1.2 實驗方法
1.2.1 發酵液中的TAT-SOD的乙醇沉降 稱取發酵液凍干粉狀20 g溶解于100 mL蒸餾水中,充分溶解發酵液。分取5 mL發酵液上清置于離心管中,調整無水乙醇的添加量,使無水乙醇最終體積分數為70%。充分混勻后于-20℃下靜置30 min。4℃條件下,以13 000 r/min離心10 min,收集沉淀溶于5 mL SOD酶活力測定用PBS中,使用鹽酸羥胺法測定SOD酶活力[17]。使用BCA蛋白質濃度測定試劑盒檢測蛋白質含量,具體步驟見試劑盒說明書[16]。
1.2.2 大孔樹脂純化TAT-SOD經過乙醇沉淀重溶的樣品在4℃下以12 000 r/min離心10 min,取復溶液過大孔樹脂柱,并用0.5 mol/L NaCl溶液進行洗脫,流量為0.6 mL/min,每管5 min,測定在280 nm吸光值,得到除去大部分色素的樣品。測定在400 nm及490 nm波長的吸光值,通過吸光值的變化,表征發酵液的脫色率[18]。
1.2.3 TritonX-114相分離法去除細菌內毒素 收集以上所得TAT-SOD溶液與Triton X-114以體積比99∶1混合;于4℃下、800 r/min條件下攪拌30 min;將樣品轉移至37℃水浴10 min;經25℃、13 000g離心10 min,并取上層水相;以上各步至少循環2次;收集上層的TAT-SOD溶液,使用細菌內毒素檢測試劑盒檢測其中的內毒素含量,具體步驟見試劑盒說明書[20]。
1.2.4 TAT-SOD脂質體的制備 將以上去除內毒素的TAT-SOD溶液,通過逆相蒸發法,包埋于脂質體。將大豆卵磷脂和膽固醇以質量比2∶1加入到裝有30 mL乙醚的茄型瓶中充分溶解;再將溶有適量TAT-SOD的磷酸鹽緩沖溶液(pH 7.4)10 mL加入到有機相中,經常溫水浴超聲(100 W)5 min;超聲形成的乳液經抽真空旋轉蒸發(40℃水浴)充分去除有機相,最終得到TAT-SOD脂質體(L-TATSOD)[21]。
1.2.5 TAT-SOD脂質體在模擬消化液中的降解情況 將TAT-SOD脂質體分別與模擬胃液(SGF)和模擬腸液(SIF)以體積比1∶3混合,于37℃水浴240 min,并分別檢測0,15,30,60,120,240 min時 的SOD酶活力[22]。
1.2.6 動物實驗 選取SD雄性大鼠30只,初始體質量(220±15)g,隨機分成5組,每組6只,分別為模型組、正常組、L-TAT-SOD組、L-SOD組(SOD脂質體組)和TAT-SOD組。造模期間,正常組自由飲用滅菌水,其余組大鼠連續7 d自由飲用3.0 g/dL葡聚糖硫酸鈉(DSS)溶液,構建急性結腸炎模型鼠[23]。造模成功后,分別給予每只大鼠10 000 U/kg的SOD劑量,灌胃給藥。實驗分組如下:正常組,全程飲用不含DSS滅菌水+灌胃生理鹽水;L-SOD組,全程飲用含3.0 g/dL DSS滅菌水+灌胃L-SOD;TAT-SOD組,全程飲用含3.0 g/dL DSS滅菌水+灌胃TAT-SOD;L-TAT-SOD組,全程飲用含3.0 g/dL DSS滅菌水+灌胃L-TAT-SOD。
1.2.7 結腸損傷評價(DAI評分) 通過疾病活動指數(DAI)評價大鼠的結腸損傷情況:每天記錄大鼠體質量、排便情況,評分后取平均值得出結腸炎模型大鼠DAI評分以及其變化趨勢[24]。
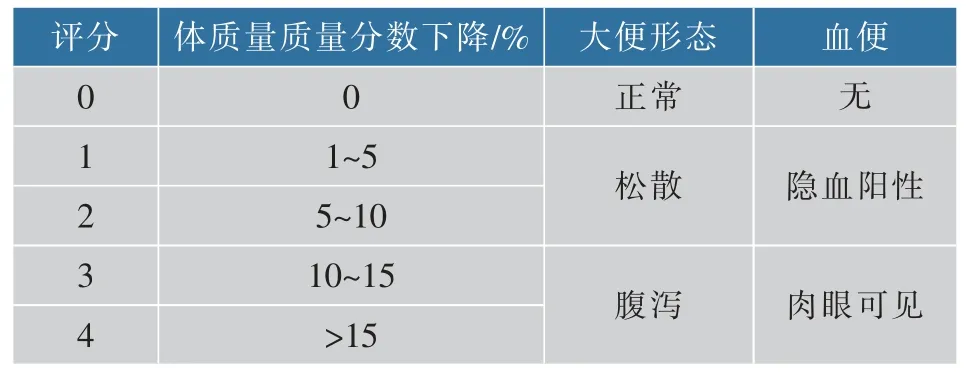
表1 DAI評分Table 1 DAI score
1.2.8 結腸密度的測定 給藥7 d后,解剖大鼠腹腔,找到結腸,測定結腸密度[25]。
1.2.9 結腸組織的HE染色 取大鼠結腸組織做固定、脫水、石蠟包埋、切片、HE染色,再于顯微鏡下觀察[26]。
1.2.10 血清中酶活和LPS的測定 從小鼠腹主動脈取血并按照鹽酸羥胺法測血清中酶活。用試劑盒測定血清中的LPS含量,具體步驟見試劑盒說明書。
1.3 數據處理方法
用SPSS 24對數據進行統計分析,P<0.05表示差異顯著,記為“*”。
2 結果與分析
2.1 TAT-SOD的制備
發酵液經過乙醇沉淀、大孔樹脂分離、TritonX-114相分離,并檢測其酶活、蛋白質質量分數、脫色率和細菌內毒素等。酶活回收率最終為57.93%,脫色率為94.72%,細菌內毒素由5.6×10-3EU/U降為0.4×10-3EU/U,遠低于人體給藥的SOD的內毒素限度(5.0×10-3EU/U),去除率為99.30%[26]。
2.2 TAT-SOD脂質體的制備
相比于TAT-SOD,制備樣品能形成納米顆粒,且其平均粒徑為(261.9±1.664)nm,說明已經成功制備TAT-SOD脂質體(L-TAT-SOD);其平均電位為(-41.3±4.40)mV≤-30 mV,具有較高的穩定性;其PDI為0.226±0.020。數據表明,已經成功制備L-TAT-SOD,且具有較高的穩定性,結果見圖1。
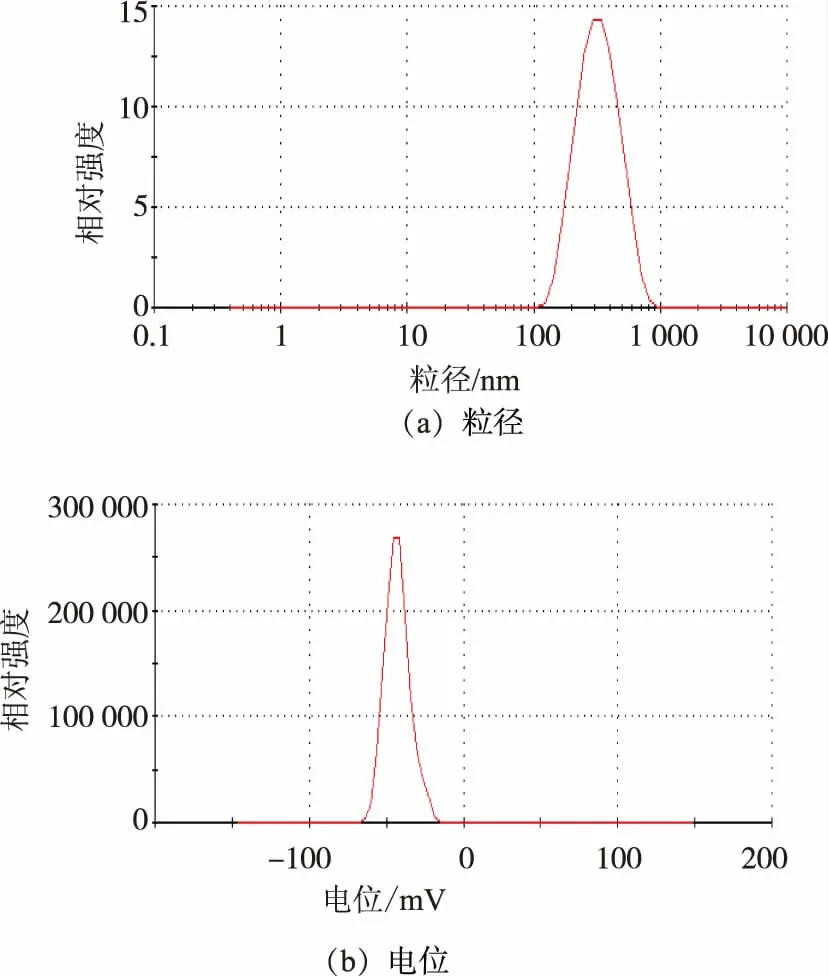
圖1 L-TAT-SOD的粒徑、電位Fig.1 Particle size and Zeta potential distribution of L-TAT-SOD
2.3 L-TAT-SOD在體外模擬人工胃液(SGF)、人工腸液(SIF)的酶活回收率
如圖2所示,在SGF的作用下,SOD和TATSOD的酶活迅速降低,15 min后幾乎失活;脂質體包埋的L-SOD、L-TAT-SOD的酶活損失則比較少,240 min后穩定于85%左右。這些說明,在模擬胃液中,脂質體包埋能有效保護SOD的活性,TAT轉導肽的修飾對SOD活性的保護沒影響。
如圖3所示,在SIF的作用下,不同SOD樣品的酶活都有小幅度的下降,240 min后穩定于90%左右,其酶活保留率順序為:L-TAT-SOD>L-SOD>TAT-SOD>SOD。這些說明,在模擬腸液中,脂質體包埋和TAT轉導肽的修飾都能一定程度地保護SOD的活性,且兩者對SOD的協同保護更加明顯。
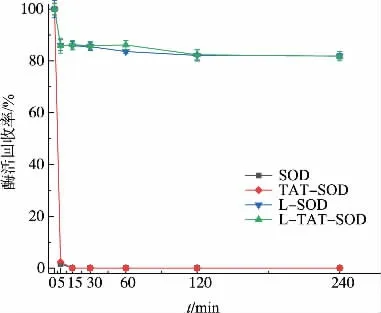
圖2 不同SOD在SGF中的酶活回收率Fig.2 Enzyme activity recovery of different SOD in SGF
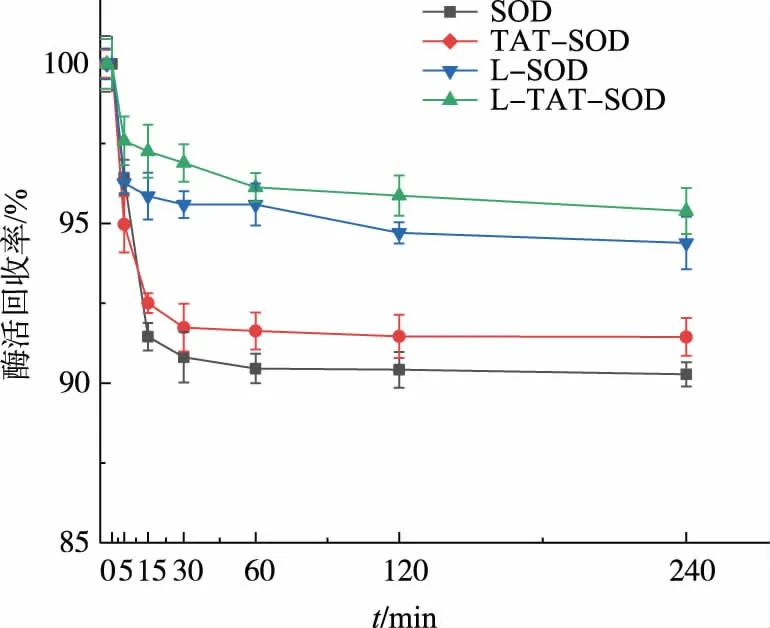
圖3 不同SOD在SIF中的酶活回收率Fig.3 Enzyme activity recoveryof different SOD in SIF
2.4 L-TAT-SOD對UC大鼠模型的DAI評分的影響
DAI評分越高,表明結腸損傷程度越高,正常生理狀況的DAI評分為0。如圖4所示,經過灌胃給藥7天的過程中,與模型組相比,L-TAT-SOD、L-SOD、TAT-SOD組的DAI評分都呈現顯著性降低(P<0.05),且呈現持續下降的趨勢。最終,L-TAT-SOD、L-SOD、TAT-SOD組的DAI評分分別降低了(71.37±8.97)%、(69.33±6.15)%、(66.67±7.26)%。不同SOD組別之間,L-TAT-SOD組的DAI評分在第1、2、3天顯著性低于TAT-SOD組(P<0.05),在第4、5、6、7天無顯著性差異。而L-TAT-SOD組與LSOD組之間、L-SOD組與TAT-SOD組之間的差異性較低,但存在一定趨勢。這些部分組別之間存在無顯著性差異的情況,可能是動物實驗誤差范圍較大造成的,這有待實驗驗證。
這些數據表明,從趨勢以及DAI評分的降低情況來看,治療效果:L-TAT-SOD>L-SOD>TAT-SOD,其中L-TAT-SOD的效果最好。
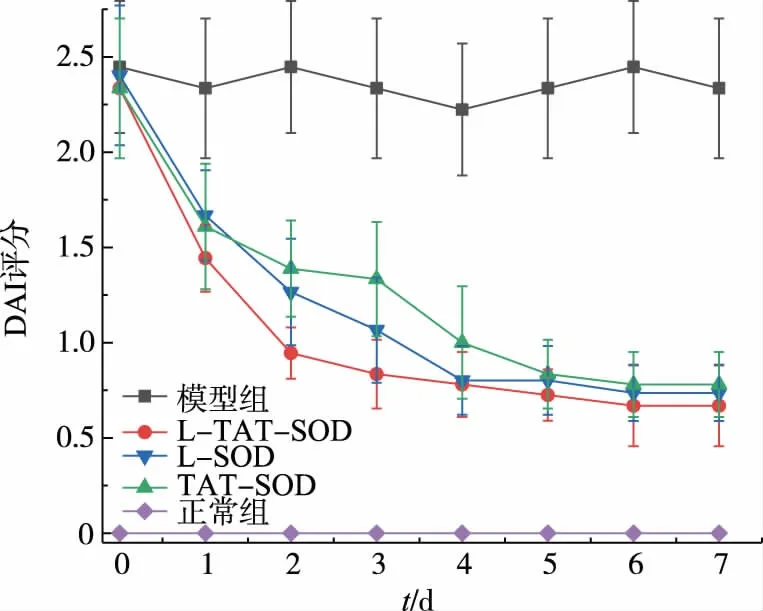
圖4 不同SOD對DAI評分的影響Fig.4 Effect of different SOD on DAI score
2.5 L-TAT-SOD對UC大鼠模型的結腸密度的影響
結腸受損后,易纖維化致使密度變大[27]。因此,可以通過測定結腸密度來評估結腸組織的受損情況。如圖5所示:L-TAT-SOD組(0.086±0.012)、LSOD組(0.093±0.014)、TAT-SOD組(0.092±0.016)和與模型組(0.121±0.020)相比,其結腸密度測量值均顯著(P<0.05)低于模型組(0.121±0.020),與正常組(0.088±0.004)相比,無顯著性差異。表明L-TATSOD、L-SOD、TAT-SOD對DSS誘導的結腸炎癥均有較好的治療效果,且L-TAT-SOD的效果最好,最接近正常組。
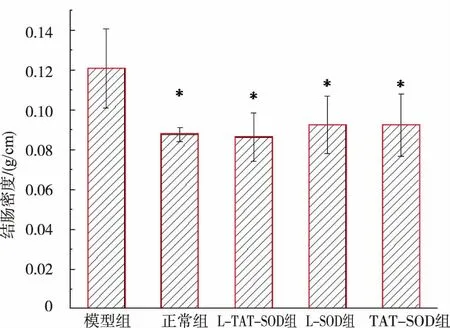
圖5 不同SOD對結腸密度的影響Fig.5 Effect of different SOD on colon density
2.6 結腸組織切片染色觀察
如圖6所示,TAT-SOD組、L-SOD組、L-TATSOD組結腸組織表現較為相似,與模型組相比,其隱窩結構正常、杯狀細胞正常、黏膜下層僅有少量炎性細胞浸潤。表明TAT-SOD、L-SOD、L-TATSOD對DSS誘導的結腸炎屏障損傷有明顯的修復作用。
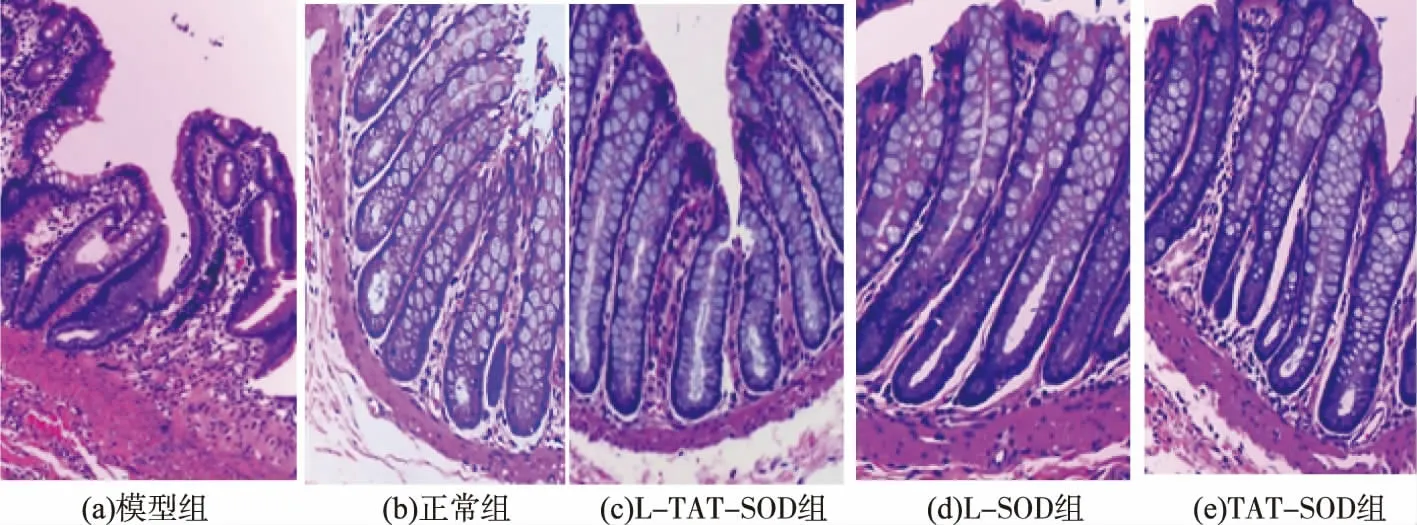
圖6 不同SOD對結腸組織的影響(HE,×100)Fig.6 Effects of different SOD on colonic tissue(HE,×100)
2.7 L-TAT-SOD對UC大鼠模型的血清中SOD酶活的影響
通過測定用藥對UC模型大鼠的血清中的SOD酶活的影響,來評估其對機體的抗氧化水平的調節情況。如圖7所示,模型組與正常組相比,其血清酶活均顯著(P<0.05)低于正常組。表明DSS誘導的結腸炎癥的產生,伴隨著機體的抗氧化酶水平的下降。而L-TAT-SOD組、L-SOD組和TAT-SOD組的血清酶活均顯著(P<0.05)高于模型組和正常組。而L-TAT-SOD組的血清酶活顯著(P<0.05)高于LSOD組、TAT-SOD組。這些結果表明:L-TAT-SOD、L-SOD、TAT-SOD均能通過口服灌胃來提高血清的SOD酶活,增強機體的抗氧化能力;而且,L-TATSOD的改善效果要優于L-SOD和TAT-SOD。根據模型組大鼠血清SOD酶活顯著低于正常組的數據,推測3種SOD樣品可能是通過改善UC狀況,從而提高血清酶活。
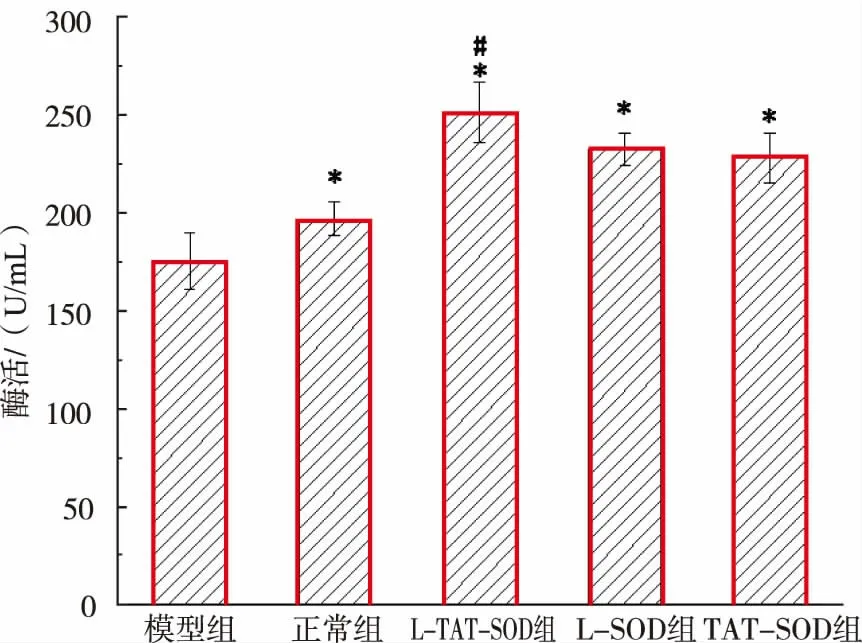
圖7 不同SOD對血清SOD酶活的影響Fig.7 Effect of different SOD on SOD enzyme activity in serum
2.8 L-TAT-SOD、TAT-SOD、L-SOD對UC大鼠模型的血清中LPS質量濃度的影響
UC模型大鼠腸道菌群產生的脂多糖(LPS)相比正常的大鼠更容易通過損傷的腸道屏障進入血液[28]。通過測定血清中LPS含量可評估腸道損傷情況,結果如圖8所示,血清中LPS含量卻無顯著性差異。LPS主要來源于革蘭氏陰性菌的細胞壁[29],而ROS本身也具有抗革蘭氏陰性菌的活性[30],由此推測,這可能是UC大鼠腸道中含有豐富的ROS,抑制了革蘭氏陰性菌的生長,從而使得腸道中可產生LPS的革蘭氏陰性菌的數量減少。UC大鼠的腸道屏障雖然受到破壞,受損的腸道更容易受到細菌的感染,但是ROS可能會造成腸道菌群整體數量下降,從而導致所測的LPS表觀上并無顯著性差異。
3 結語
近年來,SOD作為特異性的抗氧化劑來治療潰瘍性結腸炎,受到越來越多關注[12-13]。SOD作為酶類抗氧化劑,可反復利用,能高效清除多余的ROS,有很大的應用潛力和市場需求。盡管SOD來源較廣,可從動植物中提取得到,但是,其提純的步驟較為復雜[31]。作者通過基因工程菌表達的SOD,更容易獲得,提純工藝也更為簡單[32]。TAT-SOD發酵凍干粉僅通過乙醇沉淀、大孔樹脂吸附、TritonX-114等步驟,就去除了大部分色素和細菌內毒素,獲得了高比活(11 003 U/mg)的TAT-SOD;與天然SOD相比,TAT-SOD添加了富含堿性氨基酸的短肽TAT,提高了其對細胞表面的黏附能力[14],這為SOD應用于UC模型大鼠治療提供了良好的基礎。
圖8 不同SOD對血清LPS質量濃度的影響Fig.8 Effect of different SOD on LPS content in serum
天然SOD本身存在相對分子質量大、傳遞時難透過細胞膜、半衰期短、難耐酸、容易被胃蛋白酶降解等缺點,限制了其臨床應用。前人用卵磷脂化和季銨化殼聚糖等化學修飾的方法,顯著提高其靜脈注射后SOD在血液中的半衰期,但是,靜脈注射給藥方式的舒適度有待提高[11]。利用脂質體包埋TATSOD,在體外模擬消化液降解的試驗中,能夠保護80%以上的TAT-SOD活性免受胃液環境的破壞,達到口服給藥的要求,進一步提高了UC模型大鼠治療時的生活質量評分(QOL)。
作者通過葡聚糖硫酸鈉(DSS)誘發的大鼠結腸炎模型來評估TAT-SOD及L-TAT-SOD的治療效果。結果表明,L-TAT-SOD能夠顯著地降低結腸炎大鼠的DAI評分。此外,結腸組織的切片染色結果顯示,L-TAT-SOD能夠減少杯狀細胞的丟失、減少炎性細胞的浸潤,這可能是SOD可以部分恢復UC模型大鼠結腸中緊密連接蛋白 (如ZO-1和occlaudin-1)的表達水平[13],改善腸道屏障,從而抵抗炎性細胞的入侵。L-TAT-SOD還能夠顯著提高結腸炎大鼠血清中的SOD酶活水平。鑒于模型組大鼠血清SOD酶活顯著低于正常組的數據,推測LTAT-SOD可能是通過改善UC狀況,來實現SOD水平的升高[13];也有可能是通過降低ROS水平來改善腸道環境,部分恢復腸道菌群的平衡狀態,進一步提高機體的免疫力和自愈能力來實現。此外,相對于UC模型,DSS誘導的大鼠結腸炎被認為更像是急性腸道炎癥[12],所以,L-TAT-SOD對慢性腸道炎癥模型的治療效果有待進一步的驗證。
與口服SOD樣品相比,作者制備的SOD樣品原料來源更廣、制造成本更低[12]。與從嗜熱菌中分離得到的超穩定SOD相比,分離純化步驟更簡單[13]。
綜上所述,口服L-TAT-SOD、L-SOD、TATSOD對于DSS誘導的結腸炎大鼠均有積極的治療效果。其中,L-TAT-SOD的治療效果最好,TATSOD和L-SOD的治療效果相當。這可能是因為脂質體包埋有效避免其在胃腸道中酸解和酶解[22],TAT短肽富含堿性氨基酸的結構提高了SOD對腸道的黏附能力[14],可能也會改善SOD的作用。因此,口服L-TAT-SOD作為治療潰瘍性結腸結腸炎的輔助治療手段具有良好的應用前景。

