一株具有抑菌活性地衣芽孢桿菌的鑒定
于秀菊 孫錚 韓小濤 李鈺鈺
摘 要:為了開發豬用微生態制劑,本試驗對前期從呂梁黑豬腸道中篩選到的1株抑菌活性較強的菌株PB-2進行活化、抑菌活性檢測、菌落形態觀察和16S rDNA同源序列分析。結果顯示分離純化到的菌株PB-2對李斯特菌和金黃色葡萄球菌等革蘭氏陽性菌具有顯著的抑菌效果,菌株鑒定表明PB-2為地衣芽孢桿菌。
關鍵詞:抑菌活性;地衣芽孢桿菌;16S rDNA
枯草芽孢桿菌、地衣芽孢桿菌、短小芽孢桿菌和凝結芽孢桿菌等有益芽孢桿菌是我國農業農村部認定的可直接飼喂動物的飼料級微生物添加劑。芽孢桿菌(Bacillus sp.)是一類好氧型或兼性厭氧型革蘭氏陽性菌,是動植物微生態的優勢菌之一,不僅種類繁多,而且來源廣泛,在土壤、水體、空氣及動物腸道中都存在[1-2]。芽孢桿菌也是抑菌物質的生產者,其產生的細菌素是繼乳酸菌細菌素之后的又一類主要的細菌素,與乳酸菌研究最多的Nisin相比,該類細菌素在耐受性方面表現突出[3],已作為益生菌廣泛應用于食品、水產養殖、醫藥和生物農藥等領域。研究數據顯示,在過去的5年中,研究人員從多種樣品中篩選出有益芽孢桿菌,并分離純化出新的細菌素。有益芽孢桿菌的開發和應用可能是解決抗生素問題的一個有效方案。
1 ?菌株
菌株PB-2為筆者所在研究小組在前期試驗中從呂梁黑豬腸道中分離純化得到的。大腸桿菌、沙門菌、李斯特菌、金黃色葡萄球菌、表皮葡萄球菌和藤黃微球菌保存于山西農業大學基礎獸醫學實驗室。
牛津杯法抑菌實驗所用下層板為2%瓊脂。上層板用的是含有107 CFU/mL指示菌的0.75% TSA培養基(胰蛋白胨15 g,大豆蛋白胨5 g,氯化鈉30 g,瓊脂7.5 g,水1 000 mL)或15 mL 0.75%的BHI(腦心浸液)培養基,待上層凝固后,將一定間隔放置的牛津杯拔出,形成上層板。
2 ?方法
2.1 菌株的活化和抑菌活性檢測
將-80 ℃保存的PB-2甘油菌活化后,按照1∶100的體積比接種于LB液體培養基中,30 ℃培養24 h,10 000 g,4 ℃下離心20 min,收集上清液,用0.22 μm濾器過濾獲得無細胞的培養上清。運用牛津杯法檢測其抑菌活性[4]。
2.2 PB-2菌株的鑒定
菌落形態:將菌株PB-2劃線接種于LB平板上,培養12 h,觀察單菌落的形態特征。
革蘭氏染色:參考革蘭氏染色試劑盒的說明書進行革蘭氏染色,在Leica DMIRB 顯微鏡油鏡下觀察PB-2的形態。
16S rDNA法鑒定:以提取的菌體DNA作為模板,采用16S通用引物進行PCR擴增,上下游引物序列分別為:5′-AGAGTTTGATCMTGGCTCAG-3′和5′-TACGGYTACCTTGTTACGACTT-3′。用1%瓊脂糖凝膠電泳鑒定PCR產物。將擴增產物送至北京六合華大基因科技有限公司進行測序。運用NCBI的BLAST進行比對,分析分離菌的同源性,鑒定其菌種歸屬。
3 ?結果
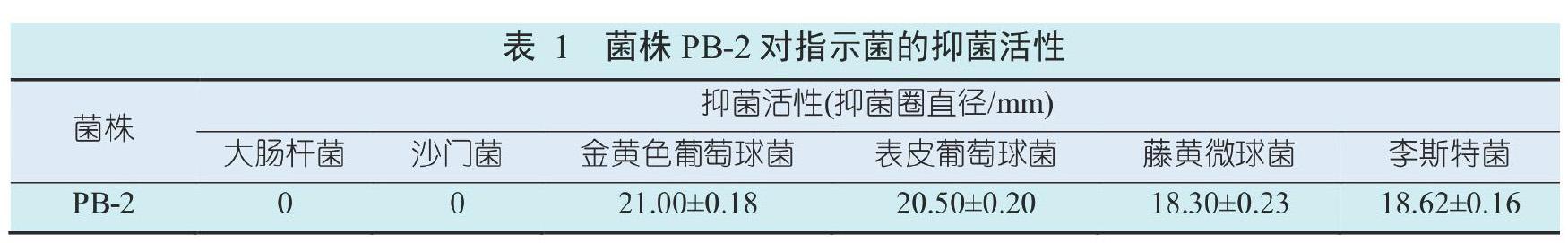
3.1 菌株PB-2的抑菌活性
菌株PB-2的發酵上清對革蘭氏陽性菌具有明顯的抑菌活性(表1)。
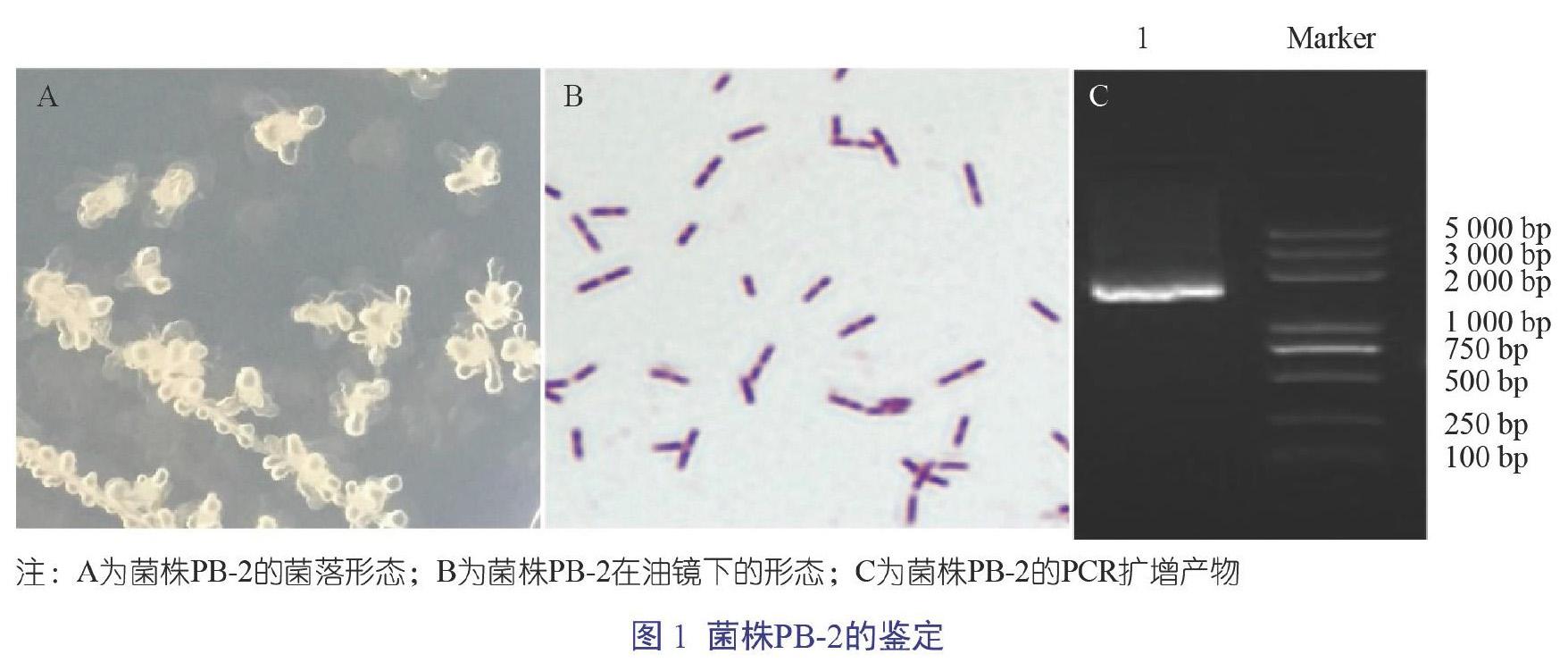
3.2 菌株PB-2的鑒定
PB-2菌落呈白色略帶黃色,菌落邊緣不整齊,表面不光滑且不透明,形成“黏液狀的花形”菌落形態(圖1A);經革蘭氏染色后,油鏡下觀察可見菌株PB-2呈紫色短桿狀,細胞單個或成對存在(圖1B);PB-2的PCR擴增產物大小為1 400 bp,瓊脂糖電泳結果見圖1C;將PB-2 16S rRNA測序結果與NCBI的BLAST進行比對,結果顯示該菌株與Bacillus licheniformis 16S rRNA基因序列相似度高達99%。
4 ?討論
自然界蘊藏著豐富的可維持菌群平衡的益生菌資源[5]。本文對從呂梁黑豬腸道中分離的一株細菌PB-2進行研究,發現其對革蘭氏陽性菌具有明顯的抑菌活性,通過細菌染色和形態學觀察初步鑒定為芽孢桿菌。根據文獻報道,16S rDNA序列同源性大于99%,可以認為屬于同一種;同源性為95%~98%可以認為是同屬不同種;同源性在95%以下可以認為屬于不同屬。本文根據菌株PB-2的16S rDNA鑒定結果確定該菌株為地衣芽孢桿菌。
瓊脂擴散方法是分離和篩選具有拮抗作用微生物的最經典的方法[6],在分離和篩選動物、植物和環境來源的拮抗微生物方面得到了普遍的應用。Ren等利用該方法從發酵乳中分離到具有拮抗作用的乳酸菌[7];Ge等運用瓊脂擴散方法從泡菜中分離到副干酪乳桿菌,并從該菌中純化得到新型細菌素HD1-7[8]。本試驗采用這種方法,對分離到的PB-2進行抑菌活性測定,結果表明該菌株對金黃色葡萄球菌、李斯特菌具有抑制效果。
參考文獻:
[1] Mohammadi F, Eshaghi M, Razavi S, et al. Characterization of bacteriocin production in Lactobacillus spp. isolated from mother's milk[J]. Microb Pathog, 2018, 118: 242-246.
[2] Xin H, Ji S, Peng J, et al. Isolation and characterisation of a novel antibacterial peptide from a native swine intestinal tract-derived bacterium[J].Int J Antimicrob Agents, 2017, 49(4): 427-436.
[3] 谷笑笑,王振華,潘康成. 益生芽孢桿菌對動物免疫功能影響研究進展. 2016,43(9):2079-2085.
[4] Lü X, Hu P, Dang Y, et al. Purification and partial characterization of a novel bacteriocin produced by Lactobacillus casei TN-2 isolated from fermented camel milk (Shubat) of Xinjiang Uygur Autonomous region,China[J]. Food Control, 2014, 43(5):276-283.
[5] 韓凱會, 王非夢, 張麗, 等. 發酵飼料用具有潛在益生功能芽孢桿菌的篩選及性質研究[J]. 飼料研究, 2020, 43(2): 56-59.
[6] 國家藥典委員會. 中國藥典[M].北京: 中國醫藥科技出版社, 2015
[7] Ren D, Zhu J, Gong S, et al. Antimicrobial Characteristics of Lactic Acid Bacteria Isolated from Homemade Fermented Foods[J]. Biomed Res Int, 2018, 2018: 5416725.
[8] Ge J, Sun Y, Xin L, et al. Purification and Partial Characterization of a Novel Bacteriocin Synthesized by Lactobacillus paracasei HD1-7 Isolated from Chinese Sauerkraut Juice[J]. Sci Rep, 2016, 14(6): 19366.

