交枝頂孢發酵液對根結線蟲脅迫下番茄防御酶活性的影響
姚玉榮 李林 霍建飛 郝永娟 王萬立

摘 ? ?要:為明確根結線蟲脅迫下交枝頂孢發酵液對番茄南方根結線蟲的作用機制,采用溫室苗期人工接種方式,研究了不同濃度的交枝頂孢發酵液對南方根結線蟲脅迫下番茄葉片中保護酶的影響。結果顯示,接種60 d后交枝頂孢發酵液處理顯著降低番茄根結指數,發酵液原液、發酵液稀釋2倍液及發酵液稀釋4倍液對南方根結線蟲的防效為70.32%、62.18%和47.26%。線蟲脅迫條件下不同濃度的交枝頂孢發酵液可顯著提高根結線蟲脅迫下番茄葉片SOD、POD、CAT、PPO和PAL的活性。交枝頂孢發酵液中次級代謝產物對根結線蟲病有顯著的防控效果。
關鍵詞:番茄;交枝頂孢;根結線蟲;發酵液;保護酶
中圖分類號:S641.2 文獻標識碼:A 文章編號:1673-2871(2020)10-059-05
Abstract:To explore the mechanism of Acremonium implicatum fermentation to tomato under the root-knot nematode stress, the effects of nematode infection on five protective enzymes of tomatoes were investigated with or without seedling inoculation in greenhouse. Results showed that after 60 days, the root knot index of tomato treated with fermentation was significantly reduced, and the control effects of the fermentation on Meloidogyne incognita were 70.32%, 62.18% and 47.26% respectively for crude fermatation solution, 2 fold diluted one and 4 fold diluted one. In addition, compared with the control higher levels of SOD, POD, CAT, PPO and PAL activities were observed in the tomatoes pretreated with A. implicatum fermentation and inoculated with nematodes. It indicated that the secondary metabolites of A. implicatum could effectively enhance tomato resistance to root knot nematode.
Key words:Acremonium implicatum; Root knot nematode; Fermentation; ?Protective enzymes
根結線蟲(Meloidogyne incognita)是危害番茄的重要病原之一,每年造成巨大的損失。隨著我國農業產業結構調整,保護地蔬菜生產迅猛發展,使得大部分蔬菜產區根結線蟲病害日趨嚴重。目前,生產上對根結線蟲病害防治主要為化學殺線劑,但一些殺線劑因高毒、高殘留而被禁用,因此亟需開發低毒、高效且環境友好的藥劑。真菌次級代謝產物作為新興的生物農藥能夠直接作用于植物線蟲,作用快、藥效高、環境相容性好而成為國內外研究的熱門[1-2]。
研究發現,當植物遭受逆境脅迫時,活性氧(reactive oxygen species,ROS)急劇增加,這表明ROS在植物逆境響應中發揮著非常重要的作用。ROS主要包括超氧陰離子(O2·-)、過氧化氫(H2O2)、羥基自由基(·OH)和單線態氧(1O2)等。在植物體內ROS扮演著雙重角色,低濃度的ROS可以作為信號分子參與植物生長發育;當植物遭受逆境脅迫時,ROS急劇增加,高濃度的ROS會導致膜質過氧化、破壞細胞膜結構和功能,致使植株受害[3-6]。植物體啟動抗氧化酶系統來適應環境變化,抵抗逆境造成的脅迫,氧化酶系統主要包括超氧化物歧化酶(superoxide dismutase, SOD)、過氧化物酶(peroxidase, POD)、過氧化氫酶(catalase, CAT)、多酚氧化酶(polyphenol oxidase, PPO)以及苯丙氨酸解氨酶(phenylalanine ammonialyase, PAL)等[7-8],這些氧化酶活性與植物對根結線蟲的抗性緊密相關。研究發現,大豆胞囊線蟲脅迫下抗感品種PPO、POD、PAL、SOD以及β-1,3葡聚糖酶活性均顯著提高,且抗性品種增幅顯著高于感病品種[9];在南方根結線蟲脅迫下抗病黃瓜品種SOD、POD、PAL活性顯著高于感病黃瓜品種[10]。Molinari等[11]發現,在根結線蟲脅迫條件下,番茄體內活性氧積累,引起過敏性反應并誘導番茄獲得抗性。
內生真菌交枝頂孢(Acremonium implicatum)對根結線蟲有很好的防治效果[12-13],但在根結線蟲脅迫條件下用內生真菌交枝頂孢發酵液處理后,植物保護酶活性及其防御相關機制尚不清楚。本研究以南方根結線蟲脅迫條件下的番茄植株為研究對象,測定不同濃度交枝頂孢發酵液處理后,番茄葉片中SOD、POD、CAT、PPO和PAL等酶活性,以期明確在根結線蟲脅迫條件下交枝頂孢發酵液可以提高番茄植株抗性的機制。
1 材料與方法
1.1 材料
供試菌株:番茄內生真菌交枝頂孢(Acremonium implicatum)菌種保藏號CGMCC8300,由中國農業科學院蔬菜花卉研究所真菌與病毒實驗室提供。
供試線蟲:南方根結線蟲(Meloidogyne incognita),來源于天津市植物保護研究所溫室辣椒苗上培養。將感染南方根結線蟲的病根洗凈,在解剖鏡下挑取新鮮卵塊,用0.1% NaClO 表面消毒,再用清水洗凈置于28 ℃恒溫培養箱中孵化,孵化得到南方根結線蟲二齡幼蟲J2,濃度調至1 000條·mL-1備用。
番茄品種:‘金棚一號,由西安皇冠蔬菜研究所提供。
1.2 發酵液的制備
將保藏的交枝頂孢轉接到PDA平板中,于28 ℃恒溫培養箱中培養活化。挑取活化的交枝頂孢菌絲接種于裝有200 mL PDB的三角瓶中(接種量為每瓶2塊d=5 mm的菌塊)28 ℃,150 r·min-1培養。發酵液于10 000 r·min-1離心10 min,得到上清液。上清液用0.22 μm的微孔濾膜過濾,得到發酵濾液。
1.3 試驗設計
試驗于2018年3—4月在天津市現代農業科技創新基地(武清區)溫室進行。試驗設置8個處理,每個處理3次重復,隨機區組排列。
番茄種子經過55 ℃溫水浸種30 min后,置于30 ℃左右的溫水浸泡6 h,28 ℃培養箱中催芽48 h,待其出芽后點到50孔育苗穴中,置于溫室培養。待番茄2片真葉完全展開后移栽到花盆(外徑150 mm×高125 mm)中。每個處理分為2組試驗,2組試驗均用交枝頂孢發酵液原液、發酵液稀釋2倍液、發酵液稀釋4倍液澆灌處理土壤,等量清水做空白對照。第1組番茄不接種線蟲,第2組每株番茄靠近根部接種南方根結線蟲1 000條,每個處理15株,3次重復。
1.4 發酵液對根結線蟲的防治效果
定植60 d,調查番茄根部根結線蟲發病情況并記錄病級,計算根結指數及防治效果。病級分級方法—0級:根系無根結;1級:根系有少量小根結;3級:2/3根系有小根結;5級:根系布滿小根結并有次生根結;7級:根系形成須根團[14]。
病情指數=Σ(病株數×相應病級數)×100/(調查的總株數×7);
防治效果/%=(空白對照病情指數-處理病情指數)×100/空白對照病情指數。
1.5 番茄葉片抗氧化保護酶活力測定
番茄苗定植60 d后測定葉片中酶活性指標。稱取番茄葉片組織,按質量(g)∶體積(mL)=1∶10的比例加入磷酸緩沖液(pH=7.8);將葉片剪碎后放入勻漿中,冰浴充分研磨,離心得到上清液即為酶提取液,每個處理3次重復。可溶性蛋白含量采用BCA法測定,以牛血清蛋白做標樣。可溶性蛋白含量以及抗氧化保護酶SOD、POD、CAT、PPO以及PAL的活性測定采用江蘇科銘生物技術有限公司生產的BCA法蛋白含量測定試劑盒、超氧化物歧化酶試劑盒(WST-8法)、過氧化物酶試劑盒(愈創木酚法)、過氧化氫酶試劑盒(過氧化氫法)、多酚氧化酶試劑盒(鄰苯二酚法)以及苯丙氨酸解氨酶試劑盒(L-苯丙氨酸硼酸緩沖液法)。具體試驗步驟以及酶活計算方法參見試劑盒說明書。酶活測定所需的主要儀器包括:多功能微孔板檢測儀(BioTek, Synergy H1)、臺式離心機(eppendorf, 5430R)、移液器(eppendorf)等。
1.6 數據統計分析
試驗數據采用Microsoft office excel 2010分析,統計分析采用SPSS21軟件,采用Duncans新復極差法進行顯著性分析。
2 結果與分析
2.1 交枝頂發酵液對南方根結線蟲的防治效果
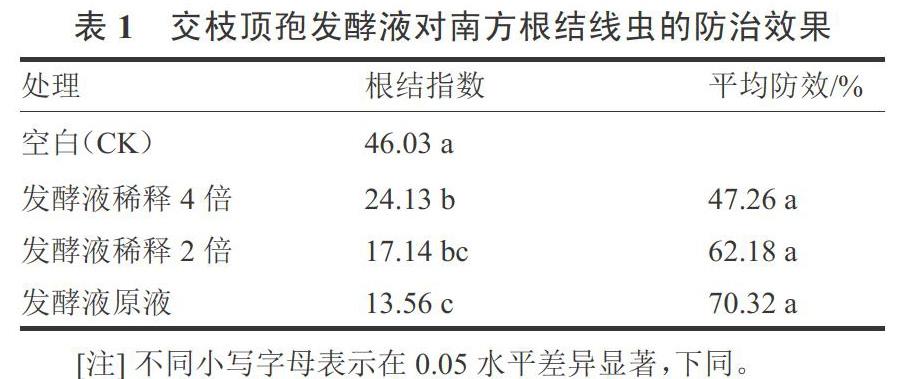
內生真菌交枝頂孢發酵液處理均能夠顯著降低南方根結線蟲對番茄的危害,其中發酵液原液及發酵液稀釋2倍液對南方根結線蟲防治效果較好,防效分別達到70.32%和62.18%,發酵液稀釋4倍液處理的根結指數較高(表1)。
2.2 交枝頂孢代謝產物對番茄超氧化物歧化酶(SOD)活性的影響
交枝頂孢發酵液處理感染南方根結線蟲的番茄葉片SOD活力結果見圖1。未接種根結線蟲時,交枝頂孢發酵液處理后SOD活性顯著增加,施用發酵液原液處理SOD活性最高。接種根結線蟲后番茄葉片SOD酶活性顯著下降,在根結線蟲脅迫下,施用不同濃度的交枝頂孢發酵液,番茄葉片SOD活性顯著增加,且隨著交枝頂孢發酵液濃度的增加SOD活力增加。試驗結果表明,交枝頂孢次級代謝產物能夠提高番茄葉片SOD活性,增強番茄清除活性氧能力。
2.3 交枝頂孢代謝產物對番茄過氧化物(POD)活性的影響
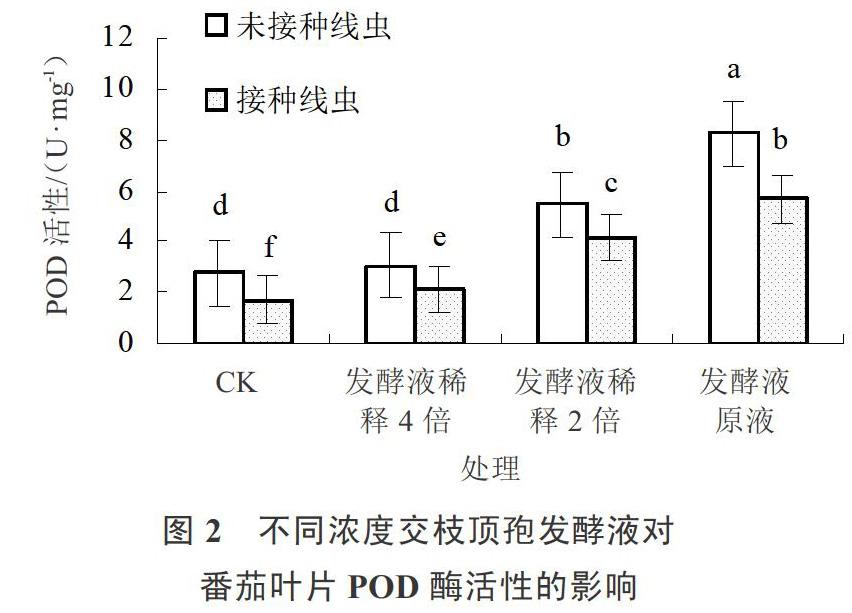
交枝頂孢發酵液處理感染南方根結線蟲的番茄葉片POD活力結果見圖2。未接種根結線蟲時,交枝頂孢發酵液處理后POD活性顯著增加,施用發酵液原液處理POD活性最高。接種根結線蟲后番茄葉片POD酶活性顯著下降。在根結線蟲脅迫下,不同濃度的交枝頂孢發酵液能夠顯著提高POD活性,且隨著發酵液濃度的增加呈現上升趨勢。
2.4 交枝頂孢代謝產物對番茄過氧化氫酶(CAT)活性的影響
交枝頂孢發酵液處理感染南方根結線蟲的番茄葉片CAT酶活力結果見圖3。未接種根結線蟲時,交枝頂孢發酵液處理后CAT酶活性顯著增加,發酵液原液處理CAT酶活性最高。接種根結線蟲后番茄葉片CAT酶活性顯著下降。施用交枝頂孢發酵液后,根結線蟲侵染的番茄葉片CAT酶活力顯著增加,且隨著交枝頂孢發酵液濃度的增加CAT酶活力增加。交枝頂孢發酵液通過提高番茄CAT活性,降低H2O2對番茄的損傷,提高對根結線蟲的抗性。
2.5 交枝頂孢代謝產物對番茄多酚氧化酶(PPO)活性的影響
交枝頂孢發酵液處理感染南方根結線蟲的番茄葉片PPO酶活力結果見圖4。未接種根結線蟲時,交枝頂孢發酵液處理后PPO活性顯著增加,施用發酵液稀釋2倍液處理PPO活性最高。接種根結線蟲后番茄葉片PPO活性顯著下降。在根結線蟲脅迫的條件下,發酵液對PPO酶活力的影響趨勢表現為先增加后降低,發酵液稀釋2倍液PPO酶活力最強。這一結果表明,發酵液濃度是根結線蟲防治的關鍵因素,必須選擇合適的濃度才能夠有效防治根結線蟲。
2.6 交枝頂孢代謝產物對番茄苯丙氨酸解氨酶(PAL)活性的影響
交枝頂孢發酵液處理感染南方根結線蟲的番茄葉片PAL活力結果見圖5。未接種根結線蟲時,交枝頂孢發酵液處理后PAL活性提高,發酵液原液處理PAL酶活力最高,相比清水對照酶活力增加71.95%。接種根結線蟲后番茄葉片PAL活性顯著下降。在根結線蟲脅迫下,不同濃度的交枝頂孢發酵液處理,番茄葉片PAL活性顯著增加,且隨著發酵液濃度的增加,PAL酶活力呈上升趨勢。
3 討論與結論
試驗結果表明,不同濃度的交枝頂孢發酵液均能降低番茄根結指數,對根結線蟲具有較好的防治效果,發酵液原液對番茄根結線蟲的防效為70.32%,稀釋2倍的防效為62.18%,稀釋4倍的防效較低為47.26%。說明交枝頂孢發酵液中對根結線蟲起防治作用的主要是發酵液中的次級代謝產物。發酵液中次級代謝產物提高了番茄葉片中防御酶SOD、POD、CAT以及PPO和PAL活性。
研究表明,SOD是植物體內清除自由基的關鍵酶,作為植物抗氧化酶系統防御的第一道防線,在清除自由基和延緩植物衰老方面發揮重要的作用[15-17]。POD和CAT主要起到酶促降解H2O2的作用[18-20],POD防止膜質過氧化、參與木質素積累[21-22]。PAL是酚類物質、木質素、植保素以及黃酮合成的關鍵酶,當植物受到病原菌侵染后,PAL活性提高,抗菌物質合成增加[23-27],促進木質素合成,強化植物細胞壁,阻礙線蟲侵染[28]。PPO是酚類物質氧化成的關鍵酶,保護植物免受酚類物質毒害[29-30]。植物可以通過這些抗氧化酶保護系統的協同作用,提高抗性。
試驗中番茄經交枝頂孢發酵液處理后,SOD、POD、CAT、PPO及PAL活性均顯著提高,這與李頌等[31]對黑曲霉與番茄根結線蟲病的研究結果一致。交枝頂孢發酵液使得番茄葉片中防御酶活性提高,這可能是交枝頂孢發酵液中次級代謝產物中誘導因子與番茄體內抗性反應相關,能夠激活番茄防御酶活性,誘導番茄對根結線蟲的相關抗性反應。在根結線蟲脅迫下,細胞產生的ROS能夠有效的啟動黃瓜抗氧化酶系統[32]。研究發現大豆胞囊線蟲脅迫導致大豆生長受阻,葉片膜質透性增加,相對導電率增加,SOD、CAT、POD等保護酶活性降低[33]。楊宇虹等[34]發現,煙草接種南方根結線蟲后,抗、感病品種POD活性均提高,但抗病品種增加幅度大于感病品種;陳增齊等[35]研究發現,番茄幼苗經球孢白僵菌發酵液處理后,PAL、POD、PPO及SOD活性顯著提高。
綜上所述,番茄接種根結線蟲后,葉片中防御酶活性降低。交枝頂孢發酵液處理后,在根結線蟲脅迫條件下,番茄葉片中抗氧化酶SOD、POD、CAT、PPO以及PAL活性顯著提高。說明交枝頂孢發酵液中次級代謝產物直接或間接參與番茄體內防御相關代謝過程,降低根結線蟲對番茄的傷害,提高抗性。交枝頂孢發酵液如何影響防御酶活性來誘導植物抗性,仍需進一步深入研究。
參考文獻
[1] OYEKANMI E O,COYNE D L,FAGADE O E,et al.Improving root-knot nematode management on two soybean genotypes through the application of Bradyrhizobium japonicum,Trichoderma pseudokoningii and Glomus mosseae in full factorial combinations[J].Crop Protection,2006,26(7):1006-1012.
[2] EL-NAGDI W M A,YOUSSEF M M A.Soaking faba bean seed in some bio-agents as prophylactic treatment for controlling Meloidogyne incognita root-knot nematode infection[J].Journal of Pest Science,2004,77(2):75-78.
[3] DENNESS L,MCKENNA J F,SEGONZAC C,et al.Cell wall damage-induced lignin biosynthesis is regulated by a reactive oxygen species-and jasmonic acid-dependent process in Arabidopsis[J].Plant Physiology,2011,156(3):1364-1374.
[4] 王娟,李德全.逆境條件下植物體內滲透調節物質的積累與活性氧代謝[J].植物學通報,2001(4):459-465.
[5] MILLER G,SHULAEV V,MITTLER R.Reactive oxygen signaling and abiotic stress[J].Physiologia Plantarum,2008,133(3):481-489.
[6] MITTLER R.Oxidative stress,antioxidants and stress tolerance[J]. Trends in Plant Science,2002,7(9): 405-410.
[7] AHMED S,NAWATA E,HOSOKAWA M,et al.Alterations in photosynthesis and some antioxidant enzymatic activities of mungbean subjected to waterlogging[J].Plant Science,2002,163(1):117-123.
[8] 賀文婷,彭德良.植物對線蟲脅迫的生理生化響應機制[J].植物保護,2007(2):11-15.
[9] 李海燕,段玉璽,陳立杰,等.大豆胞囊線蟲3號生理小種脅迫下不同抗性大豆品種的生化響應[J].大豆科學,2014,33(5):783-786.
[10] 葉德友,錢春桃,王暄.南方根結線蟲侵染對黃瓜植株生長和抗氧化系統的影響[J].植物保護學報,2012,39(4):321-326.
[11] MOLINARI S.Changes of catalase and SOD activities in the early response of tomato to Meloidogyne attack[J].Nematologia Mediterranea,1999,27(1):167-172.
[12] TIAN X L,YAO Y R,CHEN G H,et al.Suppression of Meloidogyne incognita by the endophytic fungus Acremonium implicatum from tomato root galls[J].International Journal of Pest Management,2014,60(4):239-245.
[13] YAO Y R,TIAN X L,SHEN B M,et al.Transformation of the endophytic fungus Acremonium implicatum with GFP and evaluation of its biocontrol effect against Meloidogyne incognita[J].World Journal of Microbiology and Biotechnology,2015,31(4):549-556.
[14] 中華人民共和國國家標準農藥田間藥效試驗準則(一)[M].北京:中國標準出版社,2000.
[15] LIU J W,ZHANG R H,ZHANG G C,et al.Effects of soil drought on photosynthetic traits and antioxidant enzyme activities in Hippophae rhamnoides seedlings[J].Journal of Forestry Research,2017,28(2):255-263.
[16] 竇俊輝,喻樹迅,范術麗,等.SOD與植物脅迫抗性[J].分子植物育種,2010,8(2):359-364.
[17] MARTINEZ C A,LOUREIRO M E,OLIVA M A,et al.Differential responses of superoxide dismutase in freezing resistant Solanum curtilobum and freezing sensitive Solanum tuberosum subjected to oxidative and water stress[J].Plant Science,2001,160(3):505-515.
[18] 李強,姚霞,孫楷,等.不同光質對茅蒼術生長、抗氧化酶活性及揮發油含量的影響[J].中國實驗方劑學雜志,2018,24(10):27-32.
[19] ZHANG Y N,YAN X,GUO H M,et al.A novel protein elicitor BAR11 from Saccharothrix yanglingensis Hhs.015 improves plant resistance to pathogens and interacts with catalases as targets[J].Frontiers in Microbiology,2018,9:700.
[20] SAHEBANI N,HADAVI N.Induction of H2O2 and related enzymes in tomato roots infected with root knot nematode (M. javanica) by several chemical and microbial elicitors[J].Biocontrol Science and Technology,2009,19(3):301-313.
[21] DINIZ I,AZINHEIRA H,Figueiredo A,et al.Fungal penetration associated with recognition,signaling and defence-related genes and peroxidase activity during the resistance response of coffee to Colletotrichum kahawae[J].Physiological and Molecular Plant Pathology,2019,105:119-127.
[22] 袁慶華,桂枝,張文淑.苜蓿抗感褐斑病品種內超氧化物歧化酶、過氧化物酶和多酚氧化酶活性的比較[J].草業學報,2002,11(2):100-104.
[23] TREUTTER D.Significance of flavonoids in plant resistance and enhancement of their biosynthesis[J].Plant Biology,2005,7(6):581-591.
[24] TONNESSEN B W,MANOSALVA P,Lang J M,et al.Rice phenylalanine ammonia-lyase gene OsPAL4 is associated with broad spectrum disease resistance[J].Plant Molecular Biology,2015,87(3):273-286.
[25] 馬俊彥,楊汝德,敖利剛.植物苯丙氨酸解氨酶的生物學研究進展[J].現代食品科技,2007,23(7):71-74.
[26] FRASER C M,CHAPPLE C.The phenylpropanoid pathway in Arabidopsis[M].The Arabidopsis Book,2011.
[27] 郭鵬飛,雷健,羅佳佳,等.柱花草苯丙氨酸解氨酶(SgPALs)對生物脅迫與非生物脅迫的響應[J].熱帶作物學報,2019,40(9):1742-1751.
[28] RITTER H,SCHULZ G E.Structural basis for the entrance into the phenylpropanoid metabolism catalyzed by phenylalanine ammonia-lyase[J].The Plant Cell,2004,16(12):3426-3436.
[29] SHETTY N P,KRISTENSEN B K,Newman M A,et al.Association of hydrogen peroxide with restriction of Septoria tritici in resistant wheat[J].Physiological and Molecular Plant Pathology,2003,62(6):333-346.
[30] BOECKX T,WINTERS A L,WEBB K J,et al.Polyphenol oxidase in leaves:is there any significance to the chloroplastic localization[J].Journal of Experimental Botany,2015,66(12):3571-3579.
[31] 李頌,段玉璽,朱曉峰,等.黑曲霉次生代謝產物對番茄抗根結線蟲病效果的影響[J].中國蔬菜,2011(4):44-49.
[32] APEL K,HIRT H.Reactive oxygen species:metabolism,oxidative stress,and signal transduction[J].Annual Review of Plant Biology,2004,55:373-399.
[33] 陳潔敏,韓效國.孢囊線蟲對大豆生理生化特性的影響[J].萊陽農學院學報,1996(2):8-11.
[34] 楊宇虹,秦西云,劉敬業.過氧化物酶與煙草南方根結線蟲病的抗性研究[J].煙草科技,1997(3):46-47.
[35] 陳增齊,段玉璽,陳立杰,等.球孢白僵菌Snf907發酵液對番茄根結線蟲病的控病效果及防御酶活性影響[J].農藥,2009,48(4):304-306.

