mTOR抑制劑雷帕霉素對癲癇后腦損傷保護機制研究
周弟彌 甘露 周成芳 陳琳
南華大學附屬第二醫院神經內科(湖南衡陽421001)
癲癇是由于大腦神經元異常放電引起反復癇性發作的腦功能失調綜合征。癲癇的發病機制尚不完全清楚,目前的抗癲癇藥物僅控制癲癇癥狀,而不影響疾病的病理過程[1],并且約有三分之一的患者為難治性癲癇[2]。因而探討癲癇的發病機制,尋找新的抗癲癇藥物有著重要意義。
哺乳動物雷帕霉素靶蛋白(mammalian target of repamycin,mTOR)是一種與PI3K/Akt通路相關的蛋白激酶[3]。研究報道,mTOR不僅可以調節神經元和神經膠質的多種生理過程,還參與了突觸結構和可塑性,這可能導致在病理條件下異常的神經元信號傳導[4-5]。筆者推測,PI3K/Akt/mTOR信號通路很可能參與了癲癇的病理過程。小膠質細胞是中樞神經系統內固有免疫效應細胞,是促炎癥因子和氧化應激的重要來源。研究[6]表明,活化的小膠質細胞可激活mTOR信號通路,引起神經元樹突狀損傷,并可能引起隨后癲癇的病程[7]。基于以上原因,本研究選取了小膠質細胞為研究對象。
雷帕霉素(Repamycin,RAPA)是一種mTOR抑制劑,研究[8-9]表明RAPA對mTOR的抑制作用可減少癲癇發作的強度和頻率,但是對于RAPA是否可以用于癲癇的治療及其作用機制國內外鮮有報道。本實驗通過建立大鼠癲癇模型,并予RAPA干預治療,觀察小膠質細胞活化,PI3K/Akt/mTOR及NF?kB/IL?6信號通路的表達變化,探討RAPA在癲癇后腦損傷中的作用及機制。
1 材料與方法
1.1 實驗試劑KA和RAPA(美國Sigma?Aldrich),BCA蛋白定量試劑盒(中國碧云天公司),PVDF膜(Millipore公司),ECL化學發光劑(Santa Cruz公司),Trizol試劑(GIBCO BRL公司),PI3K、Akt、mTOR、NF?kB、IL?6及β?actin小鼠抗大鼠抗體(Ab?cam公司),活化小膠質細胞標志物Iba1(美國Cell Signaling Technology),qRT?PCR及cDNA合成試劑盒(美國Thermo Scientific)。
1.2 癲癇模型的建立及分組選取40只6 ~8周齡雄性SD大鼠,隨機分為4組,Control組、KA組、KA+ RAPA 5 mg/kg組及KA+RAPA 10 mg/kg組,每組10只,通過腹腔注射海人酸KA 15 mg/kg制作大鼠癲癇模型,參考Racine分級標準,出現Ⅳ~V級癇性發作為造模成功[10];KA誘導癲癇前2 h腹腔注射RAPA(5 mg/kg或10 mg/kg)預治療,Control組僅注射生理鹽水。大鼠癲癇后24 h斷頭取腦,收集大腦皮層組織,保存于-80 ℃冰箱,用于后續實驗。
1.3 免疫組化染色觀察小膠質細胞活化大鼠癲癇后24 h先用10%水合氯醛(0.3 g/kg)腹腔注射麻醉,斷頭,沿中線切開頭皮并沿矢狀縫剪開顱骨,取出大腦,分離大腦皮層組織,浸入4%多聚甲醛溶液中固定24 h。常規脫水、透明、浸蠟、包埋后,在皮質區連續切片,片厚5 μm。石蠟切片置于60 ℃烤箱中烘烤2 h,脫蠟至水,用pH 7.4的PBS沖洗三次。將脫蠟水化后的組織切片放入沸騰的檸檬酸鹽緩沖液進行抗原修復,10 min后從緩沖液中取出玻片,用PBS沖洗3次。每張切片加1滴3%H2O2,室溫下孵育10 min,以阻斷內源性過氧化物酶的活性。PBS沖洗后每張切片加小鼠抗大鼠一抗Iba1(1∶100),室溫下孵育2 h。PBS沖洗后每張切片加兔抗小鼠二抗,室溫下孵育30 min。PBS沖洗后每張切片加1滴新鮮配制的DAB液顯色,顯微鏡下觀察切片染色情況。光鏡下對每張切片隨機選取5個面積相同的高倍視野(積相同的倍),肉眼計數每個視野Iba1染色陽性細胞數,取平均值即為活化的小膠質細胞數。
1.4 Western blot 檢測PI3K、Akt、mTOR、NFkB、IL-6 蛋白含量大鼠癲癇后24 h斷頭取腦,分離大腦皮質,用玻璃棒將皮質勻漿至無肉眼可見碎片。加入RIPA裂解液與PMSF蛋白酶抑制劑,再次勻漿直到組織充分破碎。4 ℃下12 000 r/min離心10 min,離心的上清液即是總蛋白。取上清液,BCA法測定蛋白濃度。按說明書配制10%分離膠和濃縮膠并放至電泳槽內。樣品與5×Loading buf?fer按體積4∶1混合,98 ℃煮沸5 min;上樣時蛋白總量保持一致。向電泳槽中先加入電泳液,恒壓電泳,蛋白從濃縮膠移動到分離膠;電泳結束后取出電泳架,切去多余的分離膠及濃縮膠;在轉膜槽中加入轉膜液,將蛋白轉移到PVDF膜;轉膜結束后用PBS浸泡PVDF膜,后用5%脫脂牛奶封閉,室溫下水平搖床封閉2 h;棄去封閉液,敷一抗(小鼠抗大鼠):PI3K(1∶2 000)、Akt、(1∶1 000)、mTOR(1∶2 000)、NF?kB(1∶1 000)、IL?6(1∶5 000),4 ℃孵育過夜;用PBS洗膜后敷二抗(兔抗小鼠1∶2 000),在室溫下孵育2 h,用PBS清洗10 min。等體積混合ECL發光液A和B,將PVDF膜浸泡在發光液中;約5 min后用顯影儀掃描膠片;用Image J軟件分析蛋白條帶。
1.5 qRT-PCR方法檢測PI3K、Akt、mTOR mRNA表達量取分離的大腦皮層組織,加入Trizol裂解液和氯仿,經過分離、沉淀、干燥等步驟得到總RNA。按照Thermo Scientific cDNA合成試劑盒的說明,加入樣本RNA、逆轉錄酶、上游引物和下游引物合成模板cDNA。按照qRT?PCR試劑盒的要求,加入cDNA、上游引物和下游引物在PCR儀上進行DNA擴增。qRT?PCR循環擴增條件如下:PI3K,變性:95 ℃,45 s;退火:58 ℃,45 s;延伸:72 ℃,1 min;30個循環;Akt,變性:95 ℃,45 s;退火:52 ℃,1 min;延伸:70 ℃,1 min;30個循環;mTOR,變性:95 ℃,45 s;退火:56 ℃,45 s;延伸:72 ℃,1 min;30個循環;GAPDH(內參),變性:95 ℃,30 s;退火:58 ℃,30 s;延伸:72 ℃,30 s;28個循環;DNA擴增結束后4 ℃冷卻,分析數據。qRT?PCR引物見表1。
1.6 統計學方法所有數據以均數±標準差表示,統計分析使用SPSS 20.0軟件。兩組間比較使用t檢驗,多組間比較使用單因素方差分析(ANOVA)。P <0.05表示差異有統計學意義。

表1 qRT?PCR 引物核苷酸序列Tab.1 qRT?PCR primer nucleotide sequence
2 結果
2.1 癲癇模型成功率共30只大鼠注射了KA,結果KA組有2只由于驚厥持續狀態而導致死亡,KA+RAPA 5 mg/kg組及KA+RAPA 10 mg/kg組分別有1只未出現驚厥發作,造模成功率86.7%。最終每組選取8只大鼠用于后續實驗。
2.2 RAPA減少小膠質細胞的活化Iba1免疫組化觀察大鼠癲癇后24 h小膠質細胞活化情況(圖1),活化的小膠質細胞可被染成褐色或棕褐色。Control組背景為淡藍色,以靜止小膠質細胞為主,胞體較小,有著細長的放射狀分支,偶爾可見散在的活化小膠質細胞(圖1A)。KA組背景呈黃褐色,細胞胞體變圓、體積變大,突起變短或消失,細胞呈阿米巴狀或圓形(圖1B);與Control組比較,小膠質細胞活化數量顯著增加(P <0.05,圖2)。KA+RAPA 5 mg/kg及KA+RAPA 10 mg/kg組背景顏色變淺,細胞體積較前變小(圖1C、D);與KA組比較,活化的小膠質細胞顯著減少(P <0.05,圖2)。免疫組化染色提示RAPA可以減少癲癇后小膠質細胞活化,對腦損傷有保護作用。
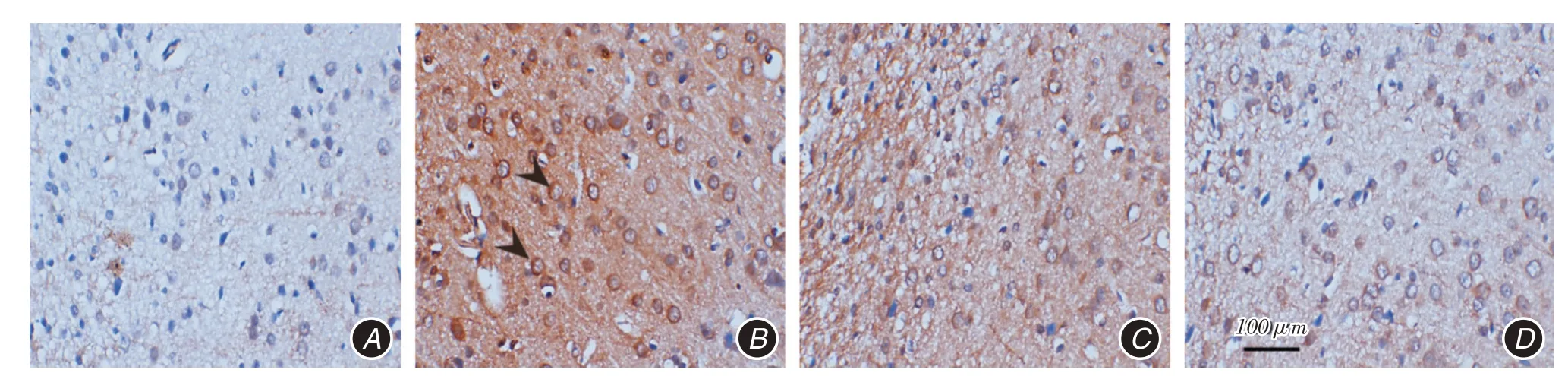
圖1 免疫組化觀察癲癇后24 h 腦皮層組織小膠質細胞活化(×400)Fig.1 Microglia activation was observed by Immunohistochemistry in cerebral cortex tissues 24 hours after epilepsy(×400)

圖2 Iba1 免疫組化染色并計數活化的小膠質細胞數Fig.2 The number of activated microglia were counted by Iba1 immunohistochemical staining
2.3 RAPA減少PI3K、Akt、mTOR蛋白水平為了探討RAPA對PI3K/Akt信號通路的影響,Western bolt測定了大鼠癲癇后24 h大腦皮層PI3K、Akt、mTOR蛋白表達水平(圖3A)。將條帶進行光密度檢測進一步得出了蛋白的相對表達量(圖3B)。由圖可以看出,癲癇后KA組PI3K、Akt、mTOR蛋白表達較Control組顯著增加(P <0.05),RAPA治療組PI3K、Akt、mTOR蛋白表達顯著低于和KA組(P <0.05);進一步比較發現,KA+RAPA10 mg/kg組顯著低于KA+RAPA5 mg/kg組mTOR蛋白表達(P <0.05)。
Western bolt結果顯示,癲癇后KA組PI3K/Akt信號通路蛋白表達明顯高于對照組,而RAPA能抑制KA誘導的PI3K/Akt信號通路改變;其中對mTOR蛋白表達抑制作用,KA+RAPA 10 mg/kg組顯著強于KA+RAPA 5 mg/kg組。
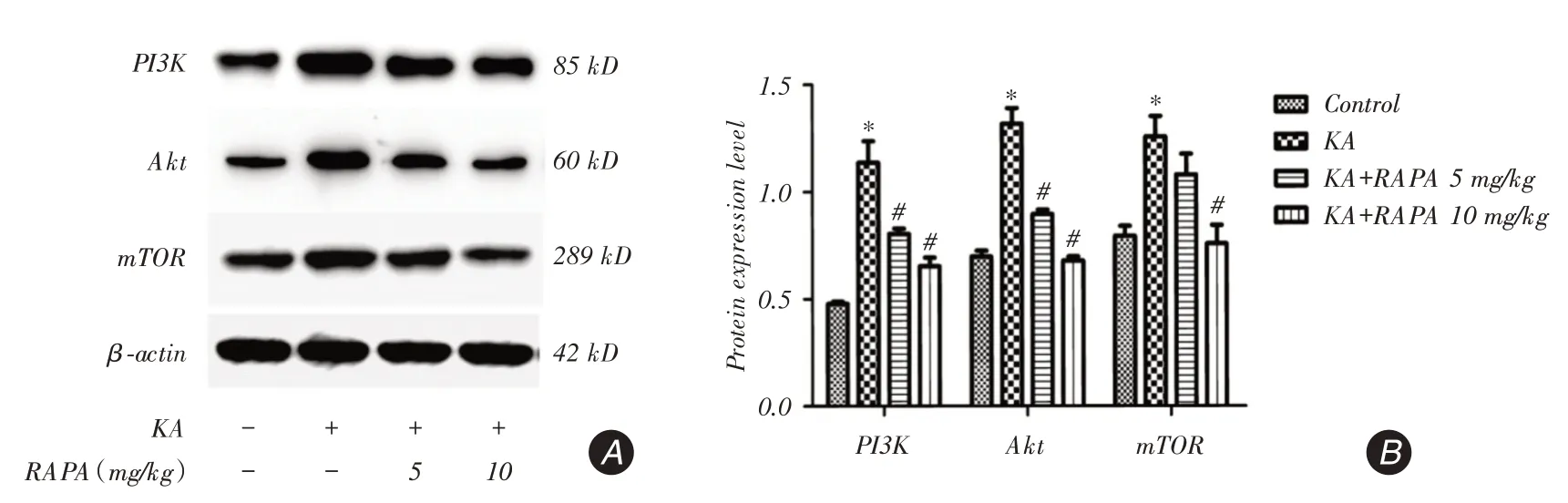
圖3 Western blot 檢測癲癇后24 h 大腦皮質PI3K、Akt、mTOR 蛋白表達量Fig.3 The protein expression of PI3K,Akt and mTOR were detected by Western blot in the cerebral cortex 24 h after epilepsy
2.4 RAPA減少PI3K、Akt、mTOR mRNA水平為了進一步探討RAPA對PI3K/Akt信號通路的影響,qRT?PCR測定了大鼠癲癇后24 h大腦皮層PI3K、Akt、mTOR mRNA表達水平(圖4)。具體結果如下:(1)癲癇后KA組PI3K、Akt、mTOR mRNA表達顯著增加(P <0.05),而10 mg/kg RAPA治療組能抑制三者表達增加(P <0.05);其中5 mg/kg RAPA治療組能抑制Akt mRNA表達增加(P <0.05);(2)進一步比較發現,KA+RAPA 10 mg/kg組顯著低于KA+RA?PA 5 mg/kg組PI3K、mTOR mRNA表達(P <0.05)。
qRT?PCR結果顯示癲癇后KA組PI3K、Akt、mTOR mRNA表達較對照組顯著增加,而RAPA能抑制KA誘導的PI3K/Akt信號通路改變。RAPA對PI3K和mTOR的抑制作用與劑量有關。
2.5 RAPA 抑制NF-kB/IL-6 炎癥通路為了探討RAPA對NF?kB/IL?6信號通路的影響,Western blot測定了大鼠癲癇后24 h大腦皮層NF?κB、IL?6蛋白表達水平(圖5A)。將蛋白條帶進行光密度分析(圖5B),可以發現癲癇后KA組NF?κB、IL?6蛋白表達較Control組顯著增加(P <0.05),RAPA(5 mg/kg或10 mg/kg)治療后顯著降低了兩者的表達水平(P <0.05);進一步比較發現,KA+RAPA 10 mg/kg組顯著低于KA+RAPA 5 mg/kg組IL?6蛋白表達(P <0.05)。
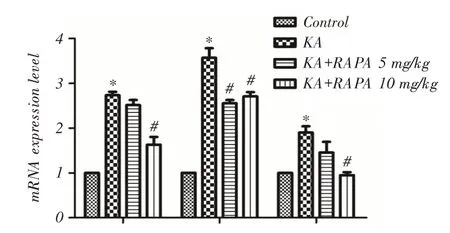
圖4 qPCR 檢測癲癇后24 h 大腦皮質PI3K、Akt、mTOR mRNA 表達量Fig.4 The mRNA expression of PI3K,Akt and mTOR were detected by qPCR in the cerebral cortex 24 h after epilepsy
該結果提示癲癇后可以激活NF?kB/IL?6炎癥信號通路,而RAPA能抑制KA誘導的炎癥信號通路改變;其中對炎癥因子IL?6抑制作用與劑量有關,在本實驗中RAPA 10 mg/kg效果更佳。
3 討論
癲癇是常見的神經系統疾病,它的病理特征包括小膠質細胞的增殖,神經元數量的減少甚至消失,抑制性神經遞質與興奮性神經遞質之間的失衡等[11]。現有的抗癲癇藥物主要通過調節神經遞質受體(如γ?氨基丁酸、谷氨酸和乙酰膽堿受體)或離子通道從而抑制神經元興奮性[12-13],而不能從癲癇的發生機制去控制發作。本實驗選擇了海人酸KA誘導癲癇模型,因為該模型類似于人類顳葉癲癇模型,且該模型穩定性和重復性好。
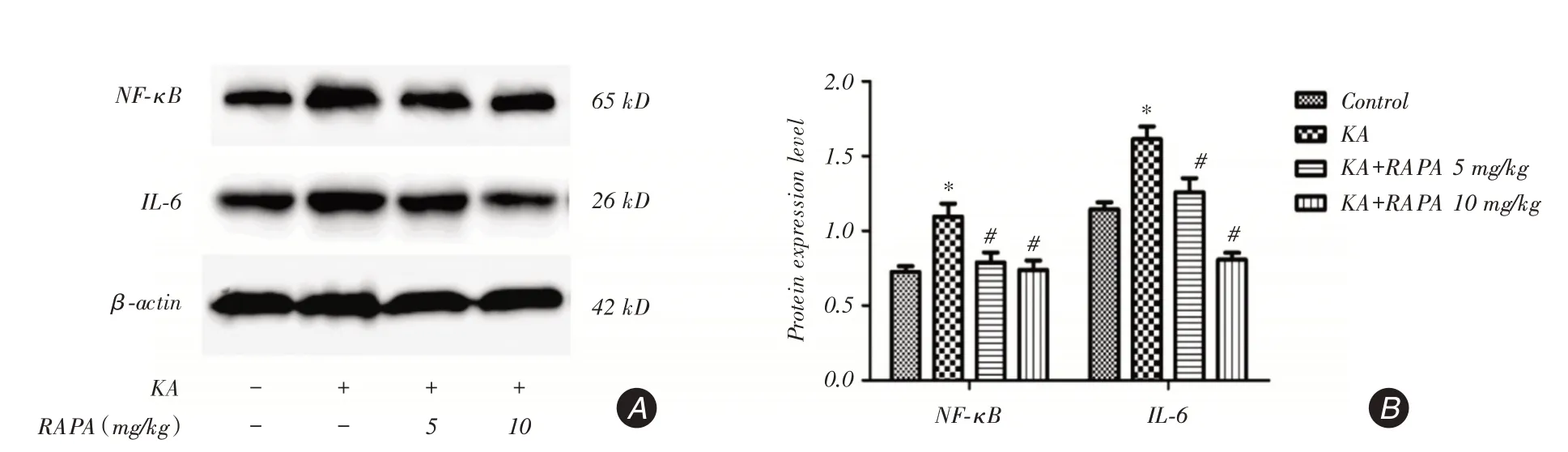
圖5 Western blot 檢測癲癇后24 h 大腦皮質NF?κB、IL?6 蛋白表達水平Fig.5 The protein expression of NF?κB and IL?6 were detected by Western blot in the cerebral cortex 24 h after epilepsy
小膠質細胞是中樞神經系統的主要抗原呈遞細胞[14]。在正常情況下,小膠質細胞處于靜止狀態,受到異常刺激時可被激活,迅速增殖并遷移到受傷的部位,介導神經炎癥以及誘導神經元凋亡[15]。因此,抑制小膠質細胞的激活和增殖可能是減輕癲癇后損傷的有效措施。本實驗用KA誘導大鼠癲癇模型,免疫組化結果顯示KA組活化的小膠質細胞數量較對照組明顯增高,證實了小膠質細胞的活化參與了癲癇的病理過程。具體機制考慮活化的小膠質細胞分泌多種免疫效應分子,例如白介素IL?1、IL?6、IL?8、腫瘤壞死因子和氧自由基等[16],會破壞神經元、神經膠質細胞和血腦屏障,引起中樞神經系統的局部或廣泛損傷,可引起癲癇發作并加重癲癇后腦損傷[17]。
磷脂酰肌醇?3激酶(phosphatidylinositide 3?ki?nases,PI3K),是一種胞內磷脂酰肌醇激酶,是多種生長因子和信號傳導復合物。Akt是PI3K下游的作用靶點,可通過磷酸化底物調控凋亡、蛋白合成、代謝和細胞周期[18-19]。mTOR是PI3K相關激酶家族的成員,也是PI3K/Akt信號的下游因子。PI3K/Akt/mTOR信號通路通過抑制細胞凋亡在細胞生長中起重要作用,包括蛋白質合成、腫瘤生長和血管生成[20]。本實驗測定了大鼠癲癇后大腦皮層PI3K/Akt信號通路變化,發現PI3K、Akt、mTOR蛋白和mRNA表達較對照組明顯增高,提示PI3K/Akt信號通路參與了癲癇的病理過程。考慮原因如下:(1)mTOR過度激活能導致大腦皮質畸形和癲癇表型的基因表達[21];(2)PI3K/Akt信號通路參與細胞的合成與增殖,促進了小膠質細胞的合成,從而加劇了免疫炎癥反應;(3)PI3K/Akt信號激活缺氧誘導因子,同時調控葡萄糖轉運蛋白(GLUT),導致神經元過度激活[22]。但也有報道指出,PI3K/Akt信號通路對癲癇有保護作用,這是因為該通路可以減少神經元的凋亡和缺血性腦損傷[23],同時可能由于mTOR在細胞內存在mTORC1和mTORC2兩種不同的復合體,可調節不同的細胞過程有關。
NF?κB是細胞質中一種重要的核轉錄因子,可啟動或抑制有關基因的轉錄。白介素?6(IL?6)是一種炎癥細胞因子,受到NF?κB的調節作用,在機體的炎癥、免疫及應激反應中起到重要作用[24]。Western blot測定了大鼠癲癇后大腦皮層NF?κB、IL?6蛋白表達量,發現它們的表達量較對照組明顯增高,提示NF?κB信號通路參與了癲癇的病理過程。主要病理機制可能是機體受到刺激時,小膠質細胞從靜止狀態轉變為M1型活化狀態,激活了NF?κB炎癥信號通路,導致IL?6、IL?1β和TNF?α等炎癥細胞因子水平明顯增高以及誘導神經元的凋亡[25];同時NF?κB可進一步激活神經膠質細胞釋放促炎細胞因子,這種細胞因子的釋放能夠增加局部神經元興奮性,從而導致癲癇發作[26]。
雷帕霉素RAPA是mTOR特異性抑制劑,既往的研究中,RAPA可能通過調節特定離子通道如鉀離子通道或控制神經元信號傳導的蛋白質而間接影響神經元興奮性[27]。在本實驗中,KA誘導大鼠癲癇,觀察到PI3K/Akt/mTOR信號通路被激活、小膠質細胞活化增加以及NF?κB炎癥信號通路表達增加,而RAPA干預治療對這些病理過程有明顯的抑制作用,表明RAPA可以減少通過減少癲癇的病理過程從而起到腦損傷的保護作用。同時從實驗結果可以發現,RAPA在劑量為10 mg/kg比5 mg/kg治療效果更好,說明RAPA對腦損傷的保護作用可能有劑量依賴性。
RAPA目前臨床上主要用于器官移植的抗排斥反應、自身免疫性疾病及抗腫瘤的治療[28],在癲癇方面的研究還很有限。在本研究中,不僅證實了RAPA對癲癇后腦損傷有保護作用,同時也從病理學機制上做了進一步闡述,為臨床上難治性癲癇藥物的開發提供了新的思路。由于實驗的局限性,未能對RAPA更多的干預劑量進行研究。在今后的試驗中,將進一步增加藥物對照組,以探討RAPA最合適治療劑量;同時將對癲癇后行為學的改變進行研究,為臨床治療提供更多的理論基礎。
RAPA可以通過調節PI3K/AKt/mTOR信號通路抑制小膠質細胞增殖和活化,同時通過抑制NF?κB信號通路減少了炎癥因子的表達,表明RAPA對癲癇后腦損傷有潛在的保護作用,為癲癇和其他神經系統退行性疾病的治療提供了新的策略。

