化學反應速率和化學平衡圖象分析
◇ 湖北 樊會武 湯 芹
化學反應速率和化學平衡圖象分析一直是高考考查的重要考型,試題往往在真實的問題情境中考查學生的“理解與辨析、分析與推測、歸納與論證、探究與創新”等關鍵能力和模型認知、證據推理等核心素養,需要學生充分提取信息,創新思維方式,運用必備知識去解決生產實踐問題或科學探究問題.
1 必備知識——圖象的分類與特征
根據橫坐標的不同含義把圖象分為兩大類,這兩類圖象的特征分別如下.
1.1 時間(t)類
1)圖象中總有一個轉折點,這個點所對應的時間是達到平衡所需的時間,根據時間的長短可確定化學反應速率的大小,結合濃度、溫度、壓強對化學反應速率的影響規律,可確定濃度的大小、溫度的高低或壓強的大小.
2)圖象中總有一段或幾段平行于橫軸的直線,直線上的點表示可逆反應處于平衡狀態.
3)這幾段直線的相對位置可確定化學平衡移動的方向.固定其他條件不變,若是因溫度升降引起的平衡移動,可確定可逆反應是吸熱還是放熱的;若是因壓強增減引起的平衡移動,就可確定在可逆反應中氣態反應物的化學計量數和與氣態生成物的化學計量數和之間的相對大小.
1.2 反應條件類——壓強(p)或溫度(T)類
1)圖象均為曲線.
2)在不限定相同反應時間的前提下,曲線上的點表示可逆反應在相應壓強或溫度下處于平衡狀態;而不在曲線上的點表示可逆反應在相應壓強或溫度下未達到平衡狀態,但能自發進行至平衡狀態.
3)平衡曲線的相對位置、變化趨勢決定了化學平衡移動的方向.固定其他條件不變,若是溫度變化引起的平衡移動,即可確定可逆反應中是吸熱還是放熱的;若是因壓強改變引起的平衡移動,即可確定在可逆反應中氣態反應物的化學計量數和與氣態生成物的化學計量數和之間的相對大小.
2 關鍵能力——常用的分析方法
2.1 先拐先平
在時間類曲線中,不同條件下先出現拐點的曲線先達到平衡.它所代表的壓強大、溫度高,對于反應mA(g)+nB(g)?xC(g)+yD(g) ΔH,這時若轉化率增高,則反應中m+n>x+y或ΔH>0,若轉化率降低,m+n<x+y或ΔH<0,若轉化率相等,m+n=x+y.
2.2 定一議二
在以反應條件作為橫軸的圖象中,要先確定一個量不變(常作等溫線或等壓線),再討論另外幾個量的關系(因平衡移動原理只適用于“單因素”的改變).
識記規律:先拐先平,拐點平衡;高溫高壓,平衡先達;定一議二,線上平衡.
3 核心素養——圖象出現峰值的討論模型
圖1
1)以時間為橫軸的圖象中,反應過程中速率先增大后減小模型的分析.
a)“先增大”的原因可能有:① 反應放熱,使反應溫度升高;② 反應產物可作催化劑;③ 反應消耗或生成了酸堿,改變了環境的酸堿性.
b)“后減小”的原因一般是隨著反應的進行,反應物濃度減小.
2)平衡轉化率或產率出現先增大后減小的原因可能有:a)使用催化劑時,溫度升高,催化劑的活性和選擇性下降;b)沒有使用催化劑時,溫度升高,副反應增多,甚至反應物因分解而消耗,沒有轉化為指定的產物.
3)限定反應時間相同,非平衡轉化率和平衡轉化率出現峰值的討論.
對于恒容絕熱容器(不與外界交換能量)或持續加熱的放熱反應(ΔH<0),平衡轉化率隨著溫度的升高而下降,若每隔一段時間測反應的轉化率,得到一個先增大后減小的圖象,則達到峰值之前是非平衡轉化率,峰值之后是平衡轉化率.
分析時,要抓住反應中溫度在不斷升高這個條件,且是經過相同的時間段進行測定,因此決定前后兩段變化的主要因素不同:a)開始一段時間,未達到平衡,升高溫度反應速率加快,非平衡狀態下的轉化率逐漸增加.b)一段時間后反應達到平衡,升高溫度平衡向吸熱反應方向移動,平衡轉化率降低.
若正反應是吸熱反應(ΔH>0),隨著溫度的升高,反應速率增大,達到平衡需要的時間縮短,故在限定時間時,非平衡態下的轉化率也逐漸增大,且向平衡轉化率逼近.
4)多因素影響問題的思維模型:若有多個因素同時對結果有影響,則需比較這幾個因素對結果是正相關還是負相關以及哪一個因素起主導作用,最后由起主導作用的因素決定結果.當多個因素導致圖象呈現峰值,則需要考慮前一階段是多個因素協同增強,后一個階段則是多個因素相互制約或協同減弱.
4 圖象分析實例
例1(2020年天津卷,節選)95℃時,將Ni片浸在不同質量分數的硫酸中,經4h腐蝕后的質量損失情況如圖2所示,當ω(H2SO4)大于63%時,Ni被腐蝕的速率逐漸降低的可能原因為________.
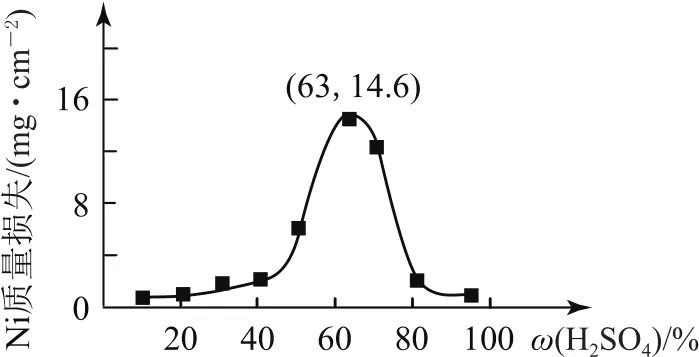
圖2
解析
在溫度一定的情況下,將Ni片浸在不同質量分數的硫酸中,隨著硫酸濃度的增大,反應速率會逐漸增大,理論上相同時間(4h)內,Ni的質量損失會逐漸增大,但圖象呈現一種先增大后減小的變化趨勢,說明出現峰值以后有特殊原因產生,聯系元素及化合物知識或周期律(表)的結構,可知Ni的性質與Fe相似.答案為隨H2SO4質量分數增加,Ni表面逐漸形成致密氧化膜,所以被腐蝕的速率逐漸降低.
例2(2020年江蘇卷)CH4與CO2重整生成H2和CO的過程中主要發生下列反應:
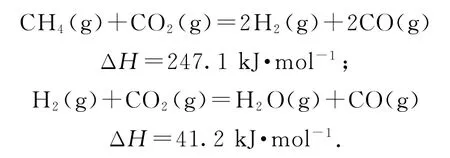
在恒壓、反應物起始物質的量比n(CH4)∶n(CO2)=1∶1條件下,CH4和CO2的平衡轉化率隨溫度變化的曲線如圖3所示.下列有關說法正確的是( ).
A.升高溫度、增大壓強均有利于提高CH4的平衡轉化率
B.曲 線B表 示CH4的平衡轉化率隨溫度的變化
C.相同條件下,改用高效催化劑能使曲線A和曲線B相重疊
D.恒壓、800K、n(CH4)∶n(CO2)=1∶1條件下,反應至CH4轉化率達到X點的值,改變除溫度外的特定條件繼續反應,CH4轉化率能達到Y點的值

圖3
解析
圖3是以溫度為橫軸的圖象,研究的是平衡轉化率隨溫度變化的曲線.CH4和CO2反應是吸熱反應,升高溫度,平衡向吸熱反應方向即正向移動,CH4轉化率增大,CH4和CO2反應是體積增大的反應,增大壓強,平衡逆向移動,CH4轉化率減小,選項A錯誤;根據已知的2個反應得到總反應為CH4(g)+2CO2(g)=H2(g)+3CO(g)+H2O(g),加入的CH4與CO2物質的量相等,CO2消耗量大于CH4,因此CO2的轉化率大于CH4,因此曲線B表示CH4的平衡轉化率隨溫度變化,選項B正確;使用高效催化劑,只能提高反應速率,但不能改變平衡轉化率,選項C錯誤;800K時CH4的轉化率為X點,可以通過改變CO2的量來提高CH4的轉化率達到Y點的值,選項D正確.答案為B、D.
例3(2019年江蘇卷)在恒壓、NO和O2的起始濃度一定的條件下,催化反應相同時間,測得不同溫度下NO轉化為NO2的轉化率如圖4中實線所示(圖中虛線表示相同條件下NO的平衡轉化率隨溫度的變化).下列說法正確的是( ).
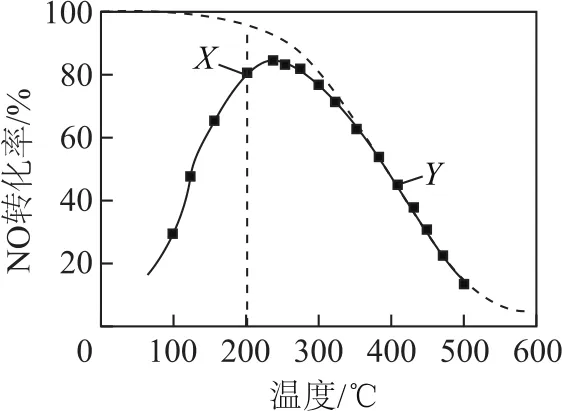
圖4
A.反應2NO(g)+O2(g)=2NO2(g)的ΔH>0
B.圖中X點所示條件下,延長反應時間能提高NO轉化率
C.圖中Y點所示條件下,增加O2的濃度不能提高NO轉化率
D.380℃下,c起始(O2)=5.0×10-4mol·L-1,NO平衡轉化率為50%,則平衡常數K>2000
解析
本題考查平衡圖象和平衡移動的相關知識.因恒壓、NO和O2的起始濃度一定、催化反應時間相同,故不同溫度下測定的轉化率不一定是平衡轉化率.圖中虛線為NO的平衡轉化率,可知升高溫度,NO的平衡轉化率降低,故ΔH<0,選項A錯誤;X點對應溫度下的平衡點在X點的正上方,NO的轉化率比X點大,延長反應時間,NO的轉化率會增大,選項B正確.Y為平衡點,增大O2的濃度可以提高NO的轉化率,選項C錯誤;NO的平衡轉化率為50%,平衡時NO和NO2的濃度相等,在平衡常數表達式中數據可以抵消,所以c起始(O2)=5.0×10-4mol·L-1,K>2000,選項D正確.答案為B、D.
例4(2020年天津卷,節選)用H2還原CO2可以在一定條件下合成CH3OH(不考慮副反應):CO2(g)+3H2(g)?CH3OH(g)+H2O(g) ΔH<0.恒壓下,CO2和H2的起始物質的量比為1∶3時,該反應在無分子篩膜時甲醇的平衡產率和有分子篩膜時甲醇的產率隨溫度的變化如圖5所示,其中分子篩膜能選擇性分離出H2O.
(1)甲醇平衡產率隨溫度升高而降低的原因為________.
(2)P點甲醇產率高于T點的原因為________.
(3)根據圖5,在此條件下采用該分子篩膜時的最佳反應溫度為________°C.
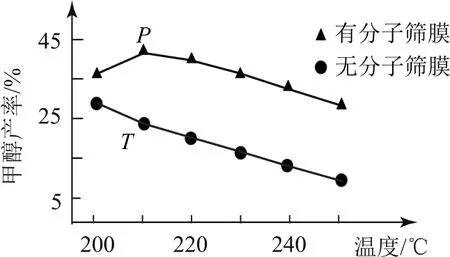
圖5
解析
這是以溫度為橫軸的反應條件類平衡圖象.(1)由于該反應的ΔH<0,故溫度升高,平衡逆向移動(平衡常數減小),即甲醇平衡產率隨溫度升高而降低.(2)由于分子篩膜能選擇性分離出H2O,故使用分子篩膜能從反應體系中不斷分離出H2O,有利于反應正向進行,甲醇產率升高.(3)使用分子篩膜時,甲醇平衡產率先增大后減小,故需選擇產率最高時對應的溫度作為最佳反應溫度,由圖可知,最佳反應溫度為210℃.
例5(2020年全國卷Ⅰ,節選)硫酸是一種重要的基本化工產品.接觸法制硫酸生產中的關鍵工序是SO2的催化氧化:

研究表明,SO2催化氧化的反應速率方程為v=式中,k為反應速率常數,隨溫度t升高而增大,α為SO2平衡轉化率,α′為某時刻SO2轉化率,n為常數.在α′=0.90時,將一系列溫度下的k、α值代入速率方程,得到v-t曲線,如圖6.
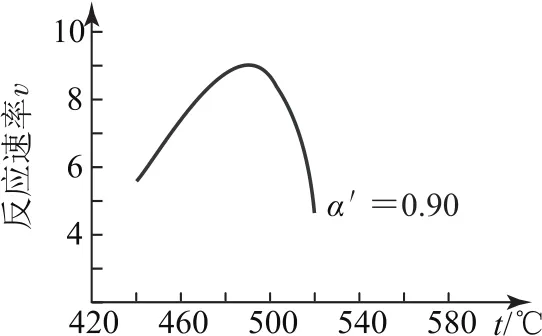
圖6
曲線上v最大值所對的溫度稱為該a′下反應的最適宜溫度tmt.<tm時,v逐漸提高;t>tm時,v逐漸下降.原因是________.
解析
由反應方程式可知,升高溫度,平衡逆向移動,α降低.根據反應速率方程可知,升高溫度,k增大使v逐漸提高,但α降低使v逐漸下降.t<tm時,k增大對v的提高大于α減小引起的降低;t>tm后,k增大對v的提高小于α減小引起的降低.
例6(2020年浙江卷,節選)NO氧化反應:2NO(g)+O2(g)?2NO2(g)分兩步進行,其反應過程能量變化示意圖如圖7所示.
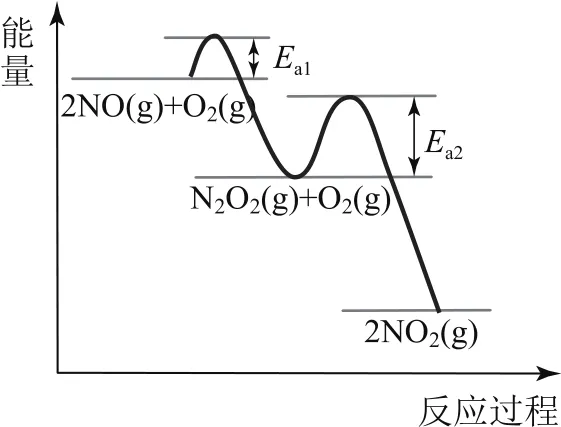
圖7
Ⅰ.2NO(g)?N2O2(g) ΔH1;
Ⅱ.N2O2(g)+O2(g)?2NO2(g) ΔH2.
①決定NO氧化反應速率的步驟是________(填“Ⅰ”或“Ⅱ”).
②在恒容的密閉容器中充入一定量的NO和O2氣體,保持其他條件不變,控制反應溫度分別為T3和T4(T4>T3),測得c(NO)隨t(時間)的變化曲線如圖8所示.轉化相同量的NO,在溫度________(填“T3”或“T4”下消耗的時間較長,試結合反應過程能量圖(圖8)分析其原因________.
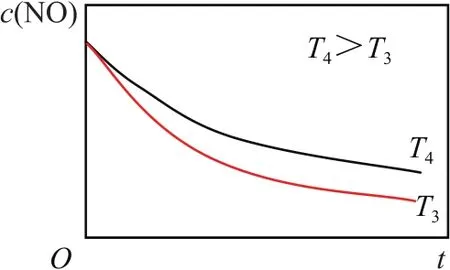
圖8
解析
① 由圖可以看出Ea1<Ea2,故步驟Ⅱ反應更難進行,反應速率更慢,故步驟Ⅱ是決速步驟;② 圖8是一個以時間為橫軸的圖象,曲線斜率可表征反應速率.由圖可以看出T3溫度下反應速率更快,故轉化相同量的NO,在溫度T4下消耗的時間較長.但是T4>T3,說明溫度對反應速率的影響并未起到決定性作用.結合反應過程能量圖可以發現ΔH1<0、ΔH2<0,溫度升高,反應Ⅰ平衡逆向移動,c(N2O2)減小,濃度降低的影響大于溫度升高對反應Ⅱ速率的影響.
例7(2016年江蘇卷,節選)鐵炭混合物(鐵屑和活性炭的混合物)、納米鐵粉均可用于處理水中污染物.在相同條件下,測量總質量相同、鐵的質量分數不同的鐵炭混合物對水中Cu2+和Pb2+的去除率,結果如圖9所示.
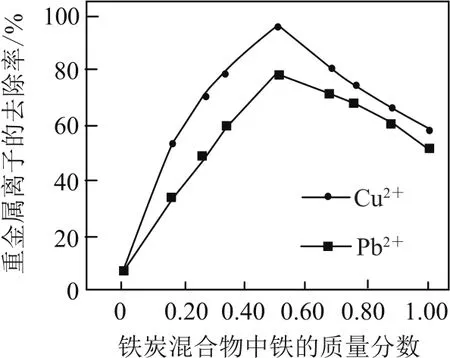
圖9
① 當鐵炭混合物中鐵的質量分數為0時,也能去除水中少量的Cu2+和Pb2+,其原因是________.
②當鐵炭混合物中鐵的質量分數大于50%時,隨著鐵的質量分數的增加,Cu2+和Pb2+的去除率不升反降,其主要原因是________.
解析
① 活性炭疏松多孔,表面積大,吸附力強,可吸附水中少量的Cu2+和Pb2+;② 鐵置換出的Cu、Pb附著在鐵的表面,阻止反應進一步發生.
例8(2017年江蘇卷,節選)砷(As)是一些工廠和礦山廢水中的污染元素,使用吸附劑是去除水中砷的有效措施之一.
H3AsO3和H3AsO4水溶液中含砷的各物種的分布分數(平衡時某物種的濃度占各物種濃度之和的分數)與pH的關系分別如圖10-甲和圖10-乙 所示.
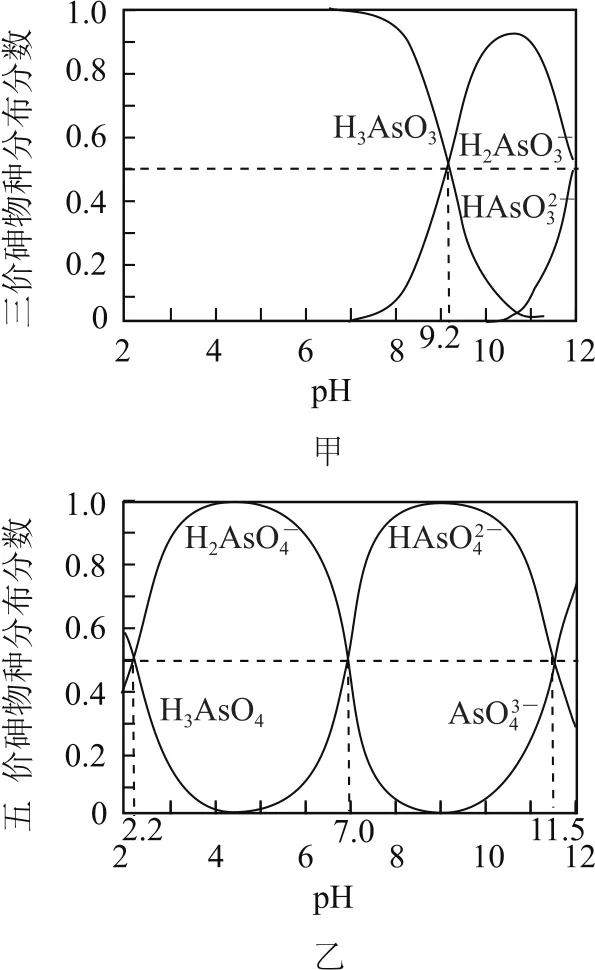
圖10
溶液的pH對吸附劑X表面所帶電荷有影響.pH=7.1時,吸附劑X表面不帶電荷;pH>7.1時帶負電荷,pH越高,表面所帶負電荷越多;pH<7.1時帶正電荷,pH越低,表面所帶正電荷越多.pH不同時吸附劑X對三價砷和五價砷的平衡吸附量(吸附達平衡時單位質量吸附劑X吸附砷的質量)如圖11所示.
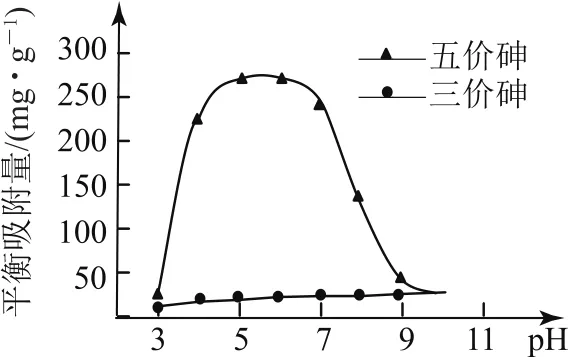
圖11
① 在pH為7~9時,吸附劑X對五價砷的平衡吸附量隨pH升高而迅速下降,其原因是________.
②在pH為4~7時,吸附劑X對水中三價砷的去除能力遠比五價砷的弱,這是因為________.提高吸附劑X對三價砷去除效果可采取的措施是________.
解析
例9(2015年江蘇卷,節選)煙氣(主要污染物SO2、NOx)經O3預處理后用CaSO3水懸浮液吸收,可減少煙氣中SO2、NOx的含量.O3氧化煙氣中SO2、NOx的主要反應的熱化學方程式為:
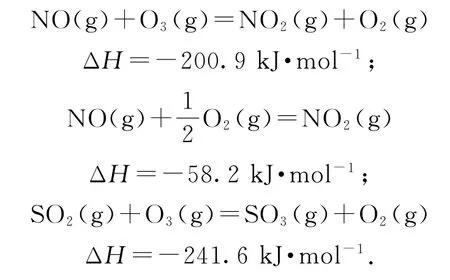
室溫下,固定進入反應器的NO、SO2的物質的量,改變加入O3的物質的量,反應一段時間后體系中n(NO)、n(NO2)和n(SO2)隨反應前n(O3)∶n(NO)的變化如圖12所示.
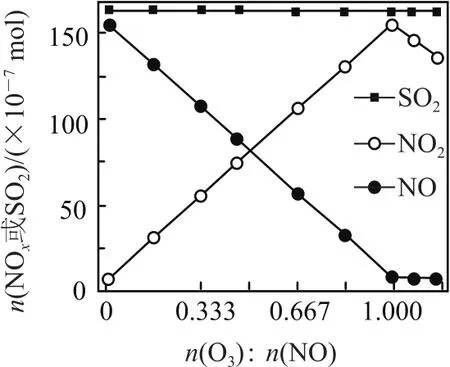
圖12
① 當n(O3)∶n(NO)>1時,反應后NO2的物質的量減少,其原因是________.
② 增加n(O3),O3氧化SO2的反應幾乎不受影響,其可能原因是________.
解析
① 當n(O3)∶n(NO)>1時,NO2的物質的量減少的原因可能是O3的強氧化性將NO2氧化成更高價氮氧化物;② 增加n(O3),O3氧化SO2的反應幾乎不受影響的原因可能是SO2與O3的反應速率比較慢,在有限的反應時間內沒有明顯變化.
解釋曲線中包含的特殊現象或特殊原因時,需要我們充分調動元素及其化合物的知識,或者充分挖掘題給信息,幫助我們正確作答.

