抓住圖象“五點”關鍵,突破酸堿混合圖象問題
◇ 甘肅 楊文軍
近幾年高考試題中酸堿中和滴定圖象是考查的熱點,也是難點,特別是2019年、2020年全國卷Ⅰ都涉及酸堿中和滴定圖象問題.這類題縱坐標以pH、水電離出的c(H+)、水電離出的 H+濃度的負對數[-lgc水(H+)]、溫度、分布系數等與橫坐標體積的變化曲線圖為背景,具體考查曲線的分析、電離平衡常數的計算、溶液中粒子濃度的關系等,明確實驗操作、鹽類水解、弱電解質的電離、離子濃度三個守恒關系等知識點是解題的關鍵.本文對酸堿中和滴定圖象進行分析,利用“五點”法對特殊點常考的知識點進行歸納,對分析這一類圖象問題起到了很好的借鑒作用.
1 滴定曲線特點
1)氫氧化鈉滴定等濃度、等體積的鹽酸及醋酸的滴定曲線(如圖1).
2)鹽酸滴定等濃度、等體積的氫氧化鈉及氨水的滴定曲線(如圖2).
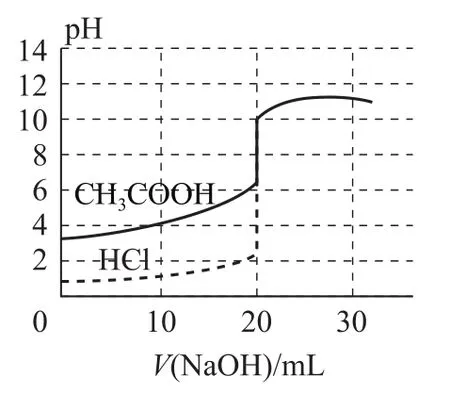
圖1
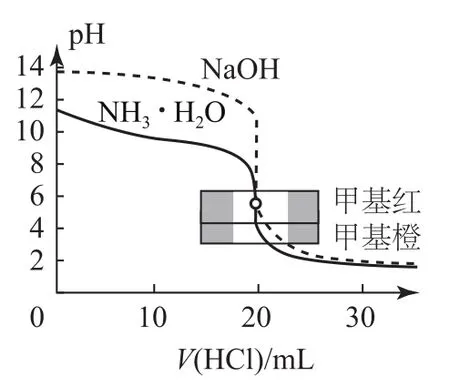
圖2
曲線起點不同:強堿滴定強酸、弱酸的曲線,強酸起點低;強酸滴定強堿、弱堿的曲線,強堿起點高.
突躍點變化范圍不同:強堿與強酸反應(強酸與強堿反應)的突躍點變化范圍大于強堿與弱酸反應(強酸與弱堿反應).
室溫下,當等體積、等濃度的一元強堿和一元強酸反應時,pH=7;但當等體積、等濃度的一元強堿和一元弱酸(或一元強酸和一元弱堿)反應時,pH>7(或pH<7).
指示劑的選擇:強酸滴定弱堿用甲基橙,強堿滴定弱酸用酚酞;強酸與強堿的滴定,用甲基橙和酚酞均可.
2 滴定曲線上的特殊點的分析
典例常溫下,用0.1000mol·L-1NaOH溶液滴定20.00mL0.1000mol·L-1HA 溶液,隨著NaOH溶液體積(V)的改變溶液pH變化所得滴定曲線如圖3所示.
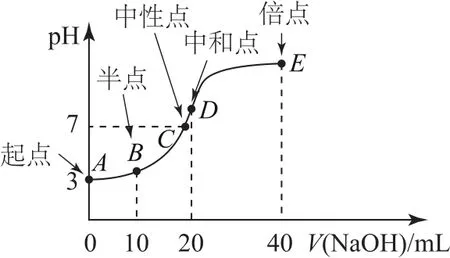
圖3
典例分析酸堿反應方程式為NaOH+HA=NaA+H2O.
① 當V=0時,酸未反應,此時即為“起始”點,溶液為20.00mL0.1000mol·L-1HA溶液.看圖后知0.1000mol·L-1HA 溶液的 pH=3,c(H+)<0.1000mol·L-1,說明該酸為弱酸
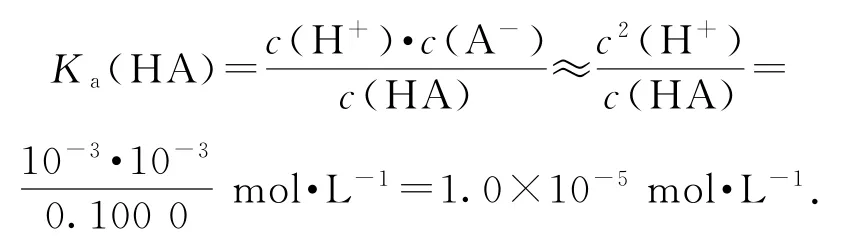
② 當V=10mL時,HA只反應了一半,此時即為“半”點,且得到等物質的量的HA和NaA,此時溶液顯酸性,HA的電離程度大于A-的水解程度.關于此點各粒子濃度由大到小順序為c(A-)>c(Na+)>c(HA)>c(H+)>c(OH-);物料守恒式為
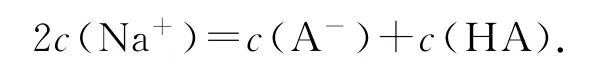
③ 當10mL<V<20mL時,加入NaOH溶液后恰好顯中性的點即為“中性”點,得到溶液中溶質為HA和NaA,但不等量.此點常涉及考查的知識點為判斷滴定后溶液呈中性時所加堿的體積比20mL大還是小.
④ 當V=20mL時,HA恰好完全反應,此時即為“恰好”反應點,得到溶液中溶質為NaA.看圖或分析鹽組成不難判斷出此時溶液顯堿性.
⑤ 當V=40mL時,NaOH溶液過量,所加NaOH溶液是HA物質的量的2倍,此時即為“倍”點,且得到等物質的量的NaOH和NaA的溶液.此點常涉及考查的知識點為混合溶液的物料守恒:
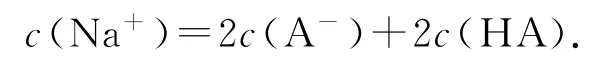
3 以酸堿中和滴定為背景的不同圖象考查
題型1pH與體積圖象
例125℃時,在20.0mL0.10mol·L-1氨水中滴入0.10mol·L-1的鹽酸,所加鹽酸的體積與溶液的pH關系如圖4所示.已知該溫度下0.10mol·L-1NH3·H2O 的電離度為1.32%,下列有關敘述正確的是( ).
A.該滴定過程應該選擇酚酞作為指示劑
B.M點對應的鹽酸體積為20.0mL
C.M點處的溶液中
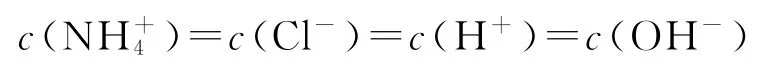
D.N點處的溶液中pH<12
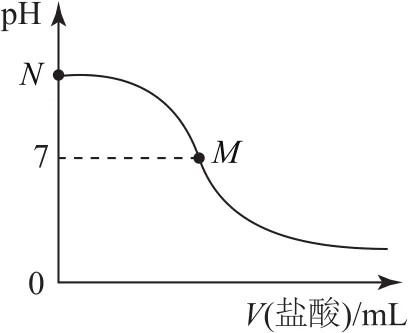
圖4
解析
強酸弱堿相互滴定時,由于生成強酸弱堿鹽而顯酸性,而石蕊的變色范圍為5~8,無法控制滴定終點,故應選擇甲基橙作指示劑,選項A錯誤;從圖上看,此時M點即為“中性”點,如果M點鹽酸體積為20.0mL,則二者恰好完全反應生成NH4Cl,NH4Cl中NH+4水解導致該點溶液應該呈酸性,要使溶液呈中性,則氨水應該稍微過量,所以鹽酸體積小于20.0mL,選項B錯誤;M處溶液呈中性,則存在c(H+)=c(OH-),根據電荷守恒得c(NH+4)=c(Cl-),該點溶液中溶質為NH4Cl和NH3·H2O,水電離程度很小,該點溶液中離子濃度大小順序為選項C錯誤;N點為“起始”點,該點是濃度為0.10mol·L-1的氨水,電離度為1.32%,則該點溶液
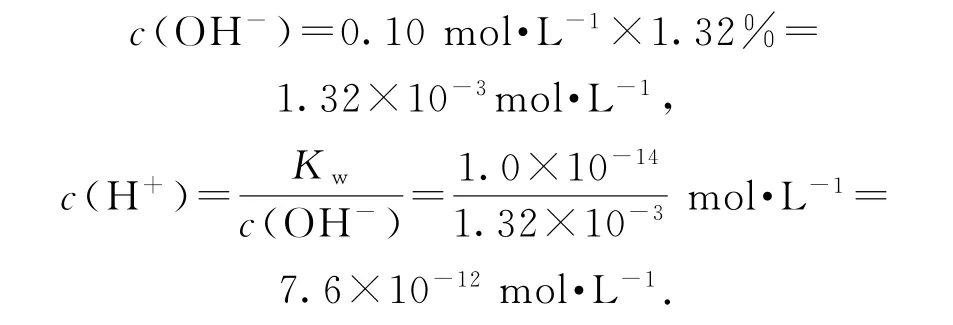
所以該點溶液的pH<12,選項D正確.答案為D.
題型2水電離出的c(H+)與反應物溶液體積圖象
例225℃時,已知醋酸的電離常數Ka為1.8×10-5.將2.0mol·L-1NaOH 溶液逐滴加入20 mL2.0mol·L-1CH3COOH溶液中,所加NaOH溶液體積與溶液中水電離出的c(H+)的變化曲線如圖5所示.下列說法不正確的是( ).

圖5
A.a點溶液中:c(H+)=6.0×10-3mol·L-1
B.b點溶液中:
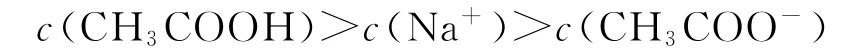
C.c點溶液中:
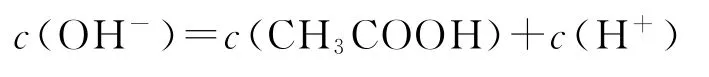
D.d點溶液中:
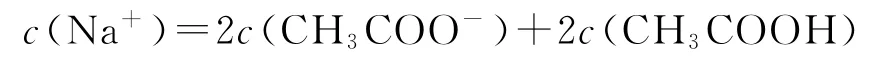
解析
a為“起始”點,溶質為CH3COOH,相當于已知Ka、c(酸),求c(H+).
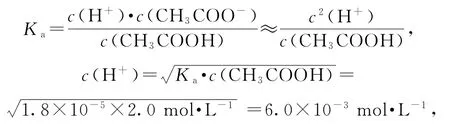
選項A正確;b點為“半”點,溶質為等物質的量的CH3COONa和 CH3COOH.CH3COO-+H2O?CH3COOH+OH-,水解平衡常數的電離大于CH3COO-的水解,所以c(CH3COO-)>c(Na+)>c(CH3COOH),選項B錯誤;c點為“恰好”反應點,溶液的溶質只有CH3COONa.該溶液中電荷守恒為c(Na+)+c(H+)=c(CH3COO-)+c(OH-),物料守恒為c(Na+)=c(CH3COO-)+c(CH3COOH),兩式聯立可推導出質子守恒為c(OH-)=c(CH3COOH)+c(H+),選項C正確;d點為“倍”點,溶質有等物質的量的CH3COONa和NaOH.物料守恒為c(Na+)=2c(CH3COO-)+2c(CH3COOH),選項D正確.答案為B.
題型3水電離出的c(H+)的負對數[-lgc水(H+)]與體積圖象
例3常溫下,將0.1mol·L-1NaOH溶液滴入20.00mL0.1mol·L-1HA溶液中,所加NaOH溶液體積與溶液中由水電離出的H+濃度的負對數[-lgc水(H+)]的關系如圖6所示,下列說法不正確的是( ).
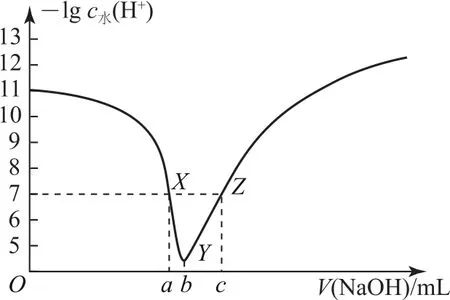
圖6
A.常溫下,HA的電離常數約為10-5
B.X點和Z點兩溶液的pH均為7
C.V(b)=20.00mL
D.X點后溶液中均存在c(Na+)>c(A-)
解析
所加NaOH溶液體積為零時,即為“起始”點,圖象上觀察到-lgc水(H+)=11,推出c水(H+)=c水(OH-)=10-11mol·L-1,根據水的離子積求出溶液中
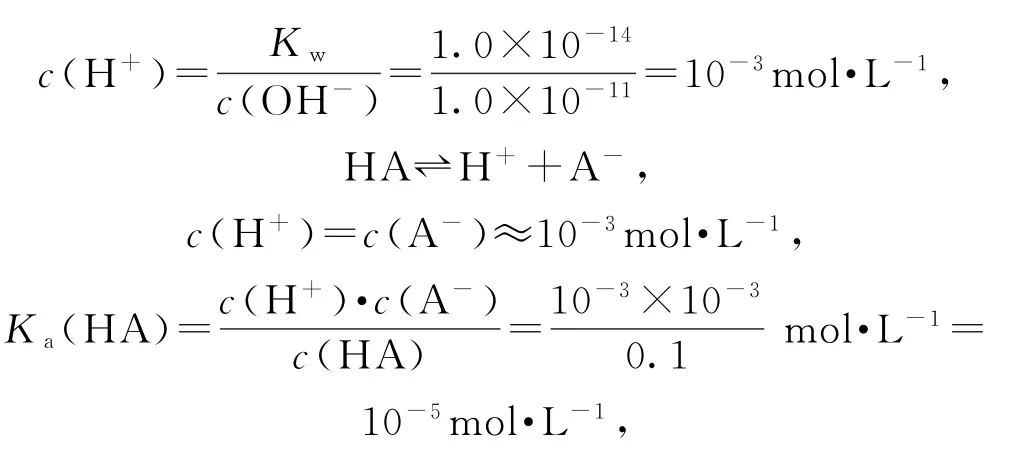
選項A正確;Y點水電離出的H+最大,說明HA與NaOH溶液恰好完全反應生成NaA,即Y點為“恰好”反應點.X點在恰好反應點之前,溶質為HA和NaA,但不等量,此時溶液呈中性,即溶液的“中性”點,HA的電離程度和A-的水解程度相同,最終對水的電離平衡無影響,c水(H+)=c水(OH-)=10-7mol·L-1.Z點溶質為NaOH和NaA,A-的水解對水電離促進程度和NaOH電離對水電離的抑制程度相同,最終水電離的c水(H+)=c水(OH-)=10-7mol·L-1,但此時溶液顯堿性,即Z點pH大于7,選項B錯誤;O~b點水的電離程度增大,當達到b點時水的電離程度達到最大,即溶質為NaA,說明HA和NaOH恰好完全反應,即Y點為“恰好”反應點.一元酸和一元堿按物質的量1∶1反應,所以b=20.00mL,選項C正確;X點為溶液的“中性”點,即pH=7,根據溶液電荷守恒:c(H+)+c(Na+)=c(OH-)+c(A-),推出c(Na+)=c(A-),X點后,c(Na+)>c(A-),選項D正確.答案為B.
題型4溫度(T)與體積圖象
例4常溫下,二甲胺[(CH3)2NH·H2O]為一元弱堿,其電離常數Kb=1.6×10-4.將0.1mol·L-1鹽酸滴入10mLcmol·L-1二甲胺溶液中,反應得到的混合溶液的溫度與鹽酸體積的關系如圖7所示.下列說法不正確的是( ).
A.二甲胺溶液的濃度為0.2mol·L-1
B.在Z和W點之間某點溶液pH=7
C.Z點存在:c(Cl-)>c[(CH3)2NH+2]>c(H+)>c(OH-)
D.常溫下,(CH3)2NH2Cl的水解常數Kh=6.25×10-11
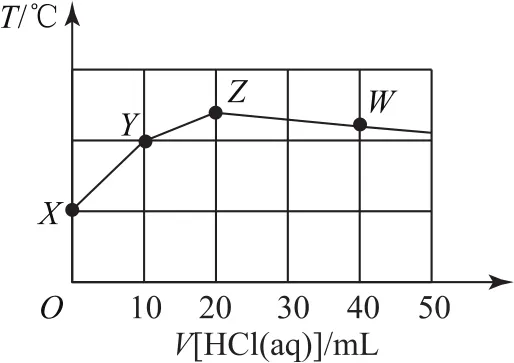
圖7
解析
酸堿中和反應為放熱反應,二甲胺與鹽酸恰好完全中和時放出熱量最多,此時體系溫度最高,即Z點為“恰好”反應點.根據一元酸和一元堿按等物質的量反應,所以(10×10-3)L×cmol·L-1=(20×10-3)L×0.1mol·L-1,解得c=0.2,選項 A正確.
二甲胺是一元弱堿,Z點對應的溶質是(CH3)2NH2Cl,屬于強酸弱堿鹽,其溶液呈酸性,Z到W點繼續滴加鹽酸,二甲胺已經反應完,溶質為(CH3)2NH2Cl和HCl混合溶液,酸性不斷增強,不可能出現pH=7的點,選項B錯誤.
由選項A、B分析知,Z點對應溶液呈酸性,電荷守恒為
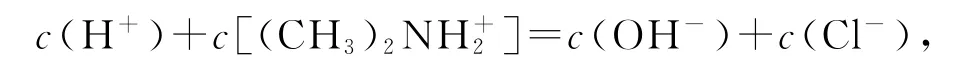
由于c(H+)>c(OH-),所以Y點存在:
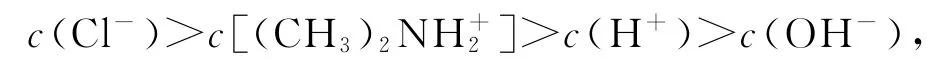
選項C正確.
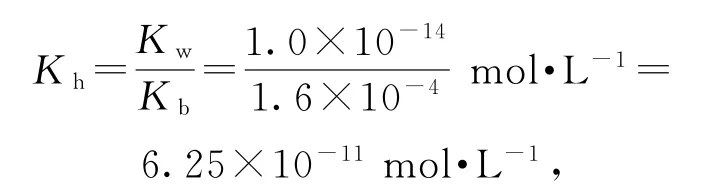
選項D正確.答案為B.
【解題感悟】1)抓反應的“起始”點,判斷酸、堿的相對強弱,酸的濃度、pH(H+濃度)、K的相互計算.
2)抓反應的“半”點,判斷是哪種溶質的等量混合.
3)抓溶液的“中性”點,判斷溶液中溶質的成分及哪種物質過量或不足.
4)抓“恰好”反應點,判斷生成的溶質成分及溶液的酸堿性.如果知道此時的pH,還可以計算A-水解常數(Kh)以及HA的電離常數(Ka).
5)抓反應的“倍”點,判斷溶液中的溶質,判斷哪種物質過量.

