基于一維和二維納米材料的神經界面構筑
許可 ,王晉芬
1中國科學院納米科學卓越創新中心,國家納米科學中心,北京 100190
2中國科學院納米生物效應與安全性重點實驗室,國家納米科學中心,北京 100190
3中國科學院大學,北京 100049
1 引言
神經界面是神經系統與神經電子器件進行信息交互的接口,構筑穩定可靠的神經-電極界面,不僅對神經環路的研究大有裨益,而且對腦機接口技術的發展1、神經假體的臨床應用2具有重要意義。理想的神經界面要求神經電極的生物相容性好,能與神經系統進行無縫集成3,4,尺寸盡量小以減少腦損傷5,6,記錄位點盡量多以檢測到更多的神經元活動5,7,具有足夠的電荷注入能力以實現電刺激8,信號記錄的時空分辨率、信噪比高9,10,能夠長期穩定地工作11。
傳統的神經電極以剛性材料為主,如金屬微絲電極12、密歇根電極13和尤他電極14等,其力學性能與柔軟的腦組織不匹配,植入后易發生微移動,導致神經界面附近的神經元衰退、神經膠質細胞增生,引發炎癥反應,形成膠質瘢痕,影響電極的長期記錄性能15,16。金屬材質的記錄位點在體液環境中易發生腐蝕,而且微米及毫米尺寸的神經電極空間分辨率低,難以完成亞細胞水平的神經活動檢測17,18。此外,隨著電極尺寸的減小,探針的界面阻抗增大,熱噪聲隨之增大,神經電極的信噪比降低,嚴重影響神經電極的信號質量6。上述問題嚴重制約著神經電極的發展和應用,因此亟需構筑新型的神經界面,解決現有神經電極存在的問題。
采用納米材料為基本組件構筑神經電極,為現有神經檢測技術的不足,提供了有力的解決方案。不同于塊體材料,納米材料比表面積大,具有小尺寸效應以及優異的電學、機械和光學性能等。已有研究表明納米材料生物相容性好,可與神經細胞發生相互作用,促進神經元粘附、引導軸突生長19-22。利用納米材料構筑神經電極可以減小電極的尺寸23、降低機體的免疫反應24、提高電極界面的離子電子轉換效率24,實現大范圍、高時空分辨和長期的神經電活動調控和記錄25。另外,納米材料與生物體內細胞或亞細胞結構的尺寸相匹配,且能夠通過多種合成或加工方法調控自身的結構與性質,因此成為構筑神經界面的理想材料。
本文主要以一維納米材料中的碳納米管(carbon nanotubes,CNTs)和硅納米線(Si nanowires,SiNWs)、二維納米材料中的石墨烯(graphene,GR)為例,概述了基于這三種材料構筑神經電極的研究進展,以及它們在神經界面發揮的作用,最后總結目前神經界面研究取得的突破與存在的挑戰,并展望其未來的發展方向。
2 碳納米管構筑神經界面
碳納米管是由石墨片卷曲而成的空心圓管狀一維納米材料,按照石墨片的層數可分為單壁碳納米管(single-walled carbon nanotubes,SWCNTs)與多壁碳納米管(multi-walled carbon nanotubes,MWCNTs)。單壁碳納米管的直徑為0.4-2.5 nm,最長長度可至毫米級;多壁碳納米管的直徑為2-100 nm,常見長度為微米級26。碳納米管的合成方法主要有化學氣相沉積法、電弧放電法及激光燒蝕法等。碳納米管的化學性能穩定,抗拉強度高,可通過改變手性、管徑、層數等因素調控導電性能,可通過表面修飾多肽、神經營養因子等生物活性分子提高生物相容性,這些特性為碳納米管構筑神經界面提供了可能。
2.1 碳納米管對神經界面的調控
為了考察碳納米管與神經細胞的相互作用,研究人員直接在碳納米管基底上體外培養細胞,觀察細胞的粘附與增殖情況。Mattson等27首次在鋪有多壁碳納米管的聚乙烯亞胺(polyethyleneimine,PEI)蓋玻片上體外培養大鼠胚胎海馬神經元,實驗結果表明神經細胞能夠粘附在碳納米管上并形成突起。此外,通過物理吸附作用在碳納米管表面引入生物活性分子4-羥基壬烯酸,在修飾后碳納米管基底上培養的神經細胞的突起及分支數量均增加,突起長度變為原來的2倍。Malarkey等28在不同厚度的化學修飾碳納米管薄膜上培養新生大鼠的海馬神經元,并用鈣黃綠素(calcein)對活細胞進行熒光標記以便于形態觀察(如圖1a所示)。碳管薄膜越厚,其電導率越高。以胞體大小、突起長度及數量等為衡量條件,研究人員發現神經元在10 nm厚碳管薄膜上的生長情況最好,而具有更高電導率的30及60 nm厚碳管薄膜對神經元生長的促進作用與PEI差不多,但電導率與神經元生長之間的內在聯系未被完全揭示,僅推測可能與細胞膜上離子傳輸過程有關。Krukiewicz等29提出了一種自支撐碳納米管薄膜,薄膜平均厚度為10 μm,電荷存儲容量、電荷注入能力等電學性能比鉑電極更優異,經過相同的培養時間,在碳納米管薄膜上生長的神經細胞突起長度比鉑箔上更長,星形膠質細胞所占面積更小。其他研究30,31也為碳納米管能夠促進神經細胞突起的生長與分化提供了佐證。然而,Visalli等32發現人神經母細胞瘤細胞(SHSY5Y)與碳納米管接觸后胞內活性氧含量增加、DNA受損,引發免疫反應。Bussy等33發現碳納米管對不同神經細胞的毒性作用不同,他們分別從胎鼠的額葉皮層和紋狀體分離得到神經元和神經膠質細胞,碳納米管對兩處腦區的神經元無明顯細胞毒性作用,但會使紋狀體的膠質細胞活力降低,而額葉皮層的膠質細胞不受影響。進一步分析證實與額葉皮層相比,紋狀體的膠質細胞中含有更多的小膠質細胞,而小膠質細胞攝取碳納米管的能力比星形膠質細胞更強,因而紋狀體膠質細胞受碳納米管的影響更大。上述實驗結果揭示了碳納米管與神經細胞相互作用的兩面性,需要注意的是,不同研究使用的碳納米管的尺寸及性質、神經細胞的種類及培養方法等不完全相同。
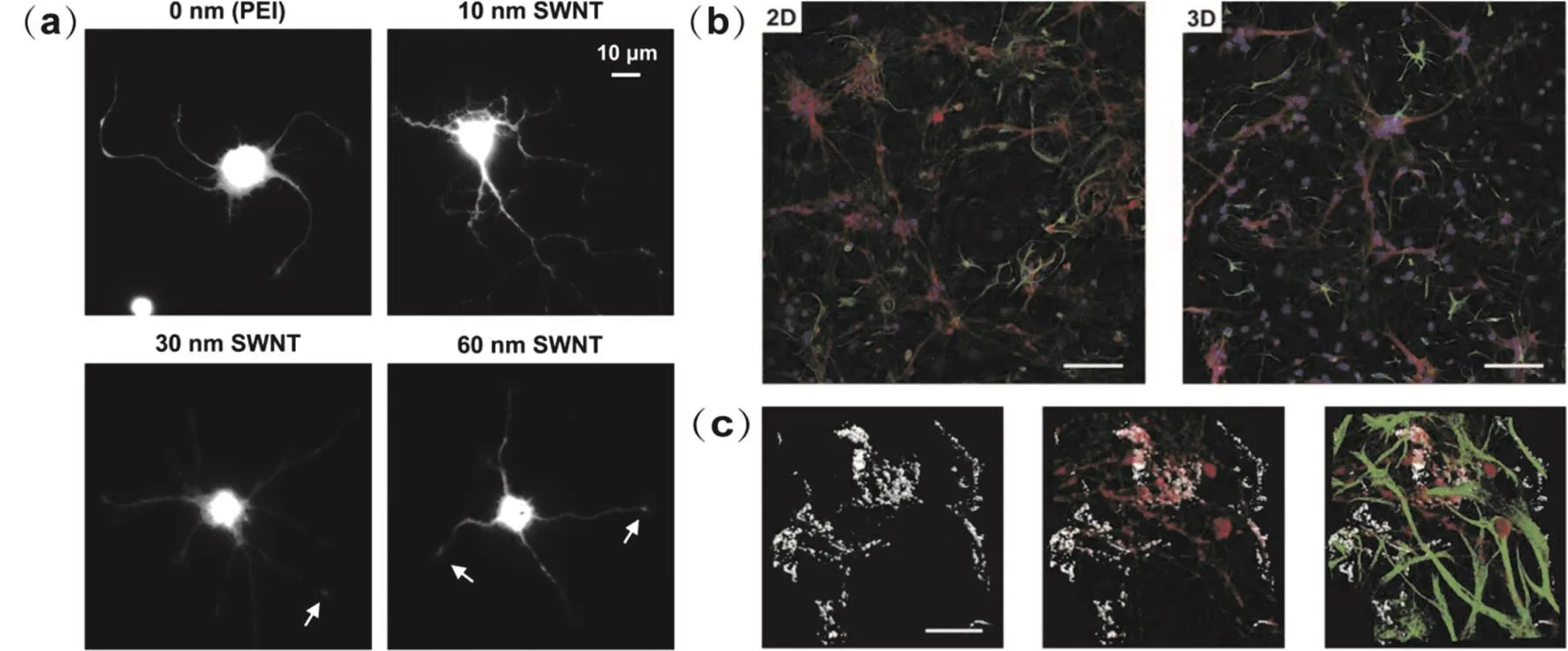
圖1 碳納米管調控神經細胞生長Fig.1 Carbon nanotubes modulate neuronal growth.
為了更加真實地還原神經細胞在體內的生長環境,Bosi等34設計制備了一種內含多壁碳納米管的聚二甲基硅氧烷(polydimethylsiloxane,PDMS)細胞支架,與二維平面基底相比,三維支架有助于神經元胞體遷移、實現三維任意方向的生長,從而形成大面積的神經功能網絡(如圖1b,c所示)。除此之外,研究人員還發現碳納米管的存在增強了突觸活動。關于碳納米管為何能夠促進神經元電活動,Cellot等35認為碳納米管與細胞膜緊密接觸,成為神經元在近端與遠端之間傳輸電信號的“捷徑”。他們采用全細胞膜片鉗技術記錄單個神經元的興奮性活動,在給予特定的電流脈沖后,碳納米管基底上培養的大鼠海馬神經元胞體細胞膜的去極化后電位比對照組的更大,間接證實了神經元樹突處鈣離子介導的反向傳播動作電位的存在,因此推測碳納米管能夠增強神經元胞體與樹突的耦合作用。
上述研究證實碳納米管及生物分子修飾的碳納米管,可在體外調控細胞的生長和分化,并能增強神經-電極界面的電活性,因此碳納米管可用于神經電極的基底導電層和修飾層材料。
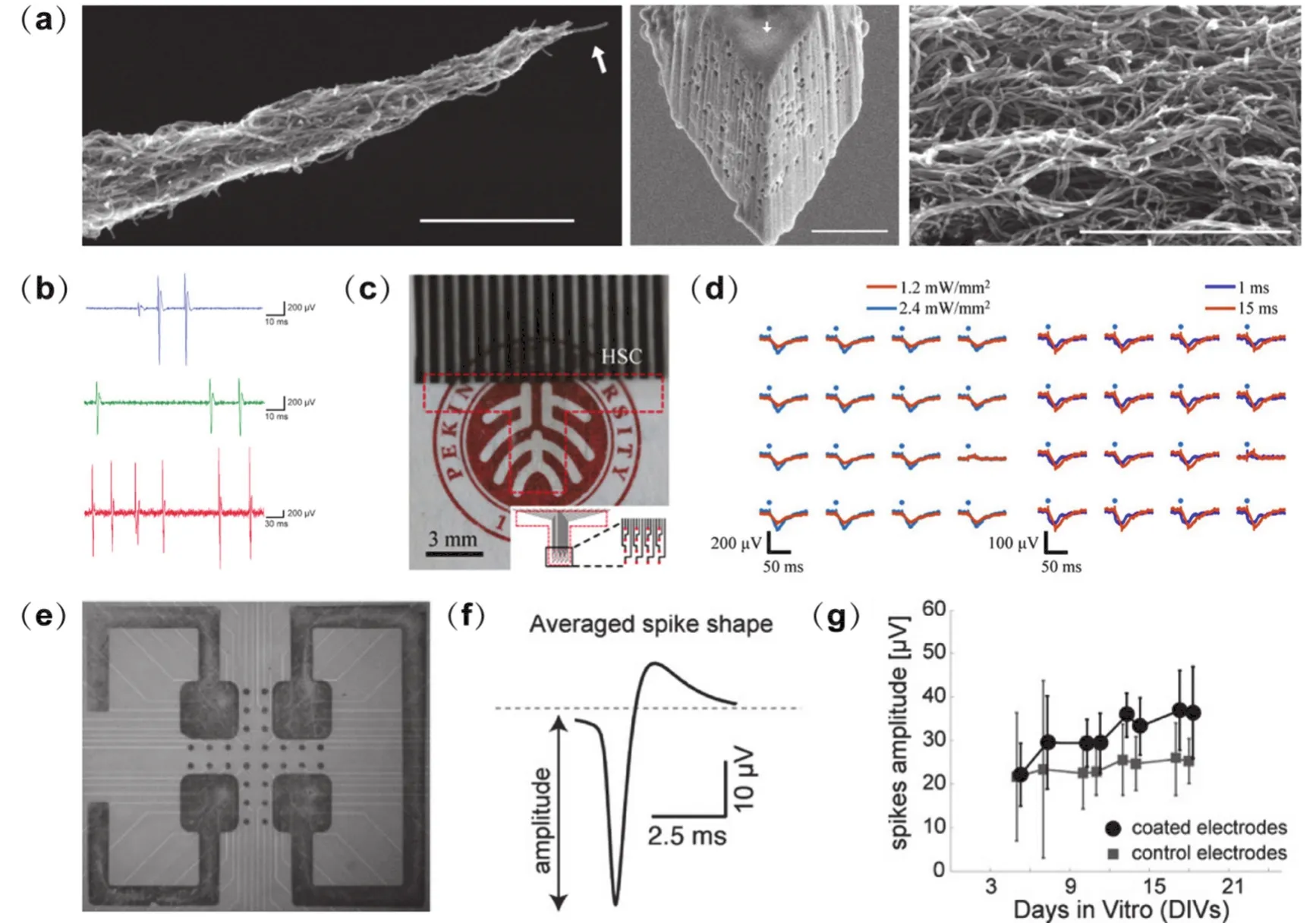
圖2 碳納米管作電極導電層或修飾層Fig.2 Carbon nanotubes as conducting layers or coating layers of neural electrodes.
2.2 碳納米管用于神經電極的導電層材料
利用碳納米管優異的電學性能和小尺寸效應,可構筑尺寸小和空間分辨率高的神經電極,用于胞內和胞外神經電信號的穩定記錄。Yoon等36通過介電電泳制備出一種多壁碳納米管電極,長約1.5 mm,自纏繞的碳管在鎢絲一端生長,在1-100 kHz頻率范圍內,電極阻抗值比玻璃微電極低一個數量級。毫米級長度有利于碳管電極刺入細胞,可在皮層神經元細胞內記錄到電刺激與光刺激響應下的信號;微米級尖端有助于提高空間分辨率,將碳管電極植入小鼠軀體感覺皮層進行體內細胞外信號記錄,單個神經元放電活動可被有效分離(如圖2a,b所示)。Su等37利用化學氣相沉積法在錐形硅尖端生長碳納米管,制得三維碳納米管神經電極。通過對電極表面進行氧等離子體處理清除無定形碳,增強了碳納米管的親水性,單位面積的阻抗顯著降低。與平面電極相比,三維碳納米管神經電極的空間分辨率更高,記錄到的動作電位峰間幅值可達80.4 μV。
因具有良好的力學性能,碳納米管非常適用于柔性神經電極的構筑。Zhang等38通過層層自組裝方法合成碳納米管與聚合物的納米復合材料,并以此為導電層制備柔性神經電極。為了將柔性神經電極順利地植入大腦,研究人員巧妙地將電極與梭子通過水冷凝過程暫時固定在一起,電極植入大鼠的運動皮層后,取出梭子。該電極具有較好的信噪比,可記錄到大鼠麻醉狀態下的低頻信號,峰值位于5 Hz。微電極陣列因具有多個記錄通道,能夠采集更加豐富的神經細胞活動信息而受到青睞。David-Pur等39在Ni圖案化催化層上用化學氣相沉積(chemical vapor deposition,CVD)法直接生長多壁碳納米管,并將其轉移到柔性聚合物基底上制得全碳管器件。該電極陣列與體外培養的雞胚胎視網膜接觸,給予脈沖電刺激后可記錄到突觸前細胞興奮性活動,加入受體拮抗劑阻斷突觸傳遞作用后無信號發放。Eleftheriou等40的研究進一步顯示,隨著培養時間的推移,電極距視網膜神經節細胞更近,碳納米管可結合到視網膜內界膜中,電刺激的閾值降低,記錄信號的信噪比提高,因此研究人員將碳納米管列為人造視網膜的候選材料之一。
透明電極能夠同時實現光電調控與檢測,有助于神經環路機制的研究,是神經電極技術發展的一大方向。Zhang等41制備了一種透明可伸縮的柔性碳納米管腦皮層電極(electrocorticography,ECoG)陣列,該陣列含16個通道,在400 nm-2.5 μm波長范圍內的透光性大于85%,經過多次伸縮變形后電極的透光性及電學性能穩定,可實現電生理記錄、光遺傳和雙光子鈣成像等的多功能集成。將該電極陣列置于轉基因小鼠的大腦皮層,可實現光遺傳調控和ECoG信號的同步記錄(如圖2c,d所示),與Au電極相比,碳納米管引入的光刺激偽跡可忽略不計。
除了用于電生理技術,碳納米管還為腦深部刺激、神經遞質檢測等領域注入了新的活力。Pt-Ir、Au、不銹鋼等金屬電極常用于腦深部刺激療法,但在同時進行的磁共振成像中會出現嚴重的圖像變形以及偽影,影響電極植入位置的準確判斷。Guo等42研究表明相較于Pt-Ir電極,碳納米管引起的磁共振成像失真更少,且免疫反應范圍更小。多巴胺是一種重要的神經遞質,與獎賞系統、成癮行為息息相關,常規采用電化學電極進行檢測,但多巴胺的氧化產物具有化學活性,易在電極表面發生反應形成絕緣層,影響電極檢測的準確性。Harreither等43制備了一種碳納米管纖維電極,抗多巴胺氧化產物污染的能力比常用的碳纖維電極提高了三倍。
2.3 碳納米管用于神經電極的修飾材料
神經電極的檢測位點多為金屬材料,采用碳納米管作為修飾層,能夠將傳統方法的普適性與納米材料的突出性能相結合,進一步優化神經界面。Keefer等44利用電化學沉積或共價連接的方式,在商用鎢絲、不銹鋼絲電極外層修飾碳納米管材料,改善金屬電極的性能。修飾后電極在1 kHz時的阻抗值由940 kΩ降低至38 kΩ,電荷轉移能力比修飾前提高40倍,施加電刺激能夠更靈敏地誘發神經元產生響應。在大鼠運動皮層、猴子視覺皮層記錄神經電信號,結果表明碳納米管修飾后的電極記錄到的信號幅值比對照組更大,噪聲更低。Suzuki等45在氧化銦錫(indium tin oxides,ITO)多電極陣列的記錄位點表面電鍍碳納米管,電鍍后電極陣列的電流密度大大提高,可檢測納摩爾濃度的多巴胺,將小鼠腦切片或體外培養的海馬神經元置于電極上,能以較大的信噪比記錄到突觸前膜的多巴胺釋放行為、場突觸后電位及動作電位。Fuchsberger等46通過微接觸印刷技術對TiN微電極陣列進行碳納米管修飾,修飾后電極檢測多巴胺的靈敏度提高,檢出限為1 μmol·L-1,而且記錄到的體外培養細胞的動作電位幅值更大(如圖2e,f,g所示)。
以聚吡咯(polypyrrole,Ppy)、聚苯胺(polyaniline,PANI)、聚噻吩(polythiophene,PT)、聚乙撐二氧噻吩(poly(3,4-ethylenedioxythiophene),PEDOT)為代表的導電聚合物生物相容性好、合成方法簡單,有助于在神經界面實現離子-電子信號轉化,因此也是神經電極表面修飾的重要材料。導電聚合物與碳納米管的復合材料將集成兩者的優勢,在改善神經-電極界面中發揮重要作用。碳納米管修飾電極的安全電荷注入量為1.0-1.6 mC·cm-2,經過Ppy與單壁碳納米管電化學共沉積修飾后,電極的安全電荷注入量從1.0-1.6 mC·cm-2提升至7.5 mC·cm-247,且細胞培養實驗結果表明PC12細胞能夠在Ppy/SWCNTs薄膜上生長并形成神經網絡,免疫組化實驗結果表明在修飾后電極植入界面附近100 μm內的星形膠質細胞密度更低。Chen等48將多壁碳納米管與PEDOT共沉積,復合材料修飾的神經電極在1 kHz的阻抗為12 kΩ,安全電荷注入量提高至7.74 mC·cm-2,信噪比比未修飾前提高了約兩倍。此外,導電聚合物/碳納米管修飾層與電極基底的附著比單獨的導電聚合物更牢固。為了避免納米材料與腦組織直接接觸,預防碳納米管在植入后從器件脫落,Castagnola等49在PEDOT-PSSCNTs(PSS,聚苯乙烯磺酸鈉,poly(sodium-pstyrenesulfonate))涂層外包覆聚甲基丙烯酸羥乙酯(poly(2-hydroxyethyl methacrylatey),pHEMA)水凝膠作保護層。pHEMA水凝膠不會對電極的電化學性能以及信號檢測能力造成明顯影響。4周后電極仍能記錄到高質量信號,且涂層保持完整沒有損壞。
碳納米管與導電聚合物的聯合使用,不僅能夠顯著改善界面的電學與機械性能,還可應用于藥物的控制釋放,降低神經電極與組織界面的免疫反應。Luo等50采用電聚合生成的Ppy將載藥的碳納米管封閉起來,實現了電刺激響應下的控制釋放,且釋放出來的地塞米松具有生物活性,能夠降低小膠質細胞的活化程度,效果與直接添加地塞米松相當。Castagnola等51則在玻碳電極上電沉積了兩層修飾層,其中PEDOT-PSS-CNTs作為中間層,能使外側PEDOT-地塞米松層與玻碳基底緊密結合。
3 硅納米線構筑神經界面
硅納米線作為一種一維納米材料,與體材料相比,比表面積大、表面活性高、吸附能力強;與其他低維納米材料相比,具有半導體性質,與現代半導體工藝兼容,展現了獨特的場發射、電子傳輸、光學性能。常用的硅納米線制備方法有化學氣相沉積法、金屬輔助化學刻蝕法、激光燒蝕法、熱蒸發法、水熱法等。硅納米線將硅的材料特性與納米結構的優勢結合在一起,可用于構建多種類型的神經電極,包括基于硅納米線場效應晶體管的神經電極和基于硅納米線陣列的神經電極,特別適合細胞內及閾值下信號的檢測。
3.1 硅納米線對神經界面的調控
細胞粘附是細胞與生長基底相互作用的第一步,在組織的發育和維持中具有重要意義。Park等52利用CVD法在硅襯底上合成出不同直徑的垂直對齊硅納米線,并在其上培養人胚腎細胞(HEK 293T),探究細胞粘附、生長與硅納米線機械性能之間的關系。結果表明直徑小、長度長的硅納米線更容易偏轉,為連接細胞與細胞外基質的粘著斑提供了更多的位點,有助于細胞的粘附并誘導其進行取向生長。利用電鏡觀察生長情況,并對相關基因表達水平進行測定后,Qi等53提出了硅納米線對細胞粘附、生長的影響機制。細胞與針狀的硅納米線陣列接觸后,將絲狀偽足伸向細胞下面及周圍的硅納米線,形成數量較多的粘著斑以增強粘附,同時硅納米線簇之間的間距阻礙了細胞的進一步伸展。
除了增強細胞的粘附,硅納米線還能在不受外力作用的條件下刺入細胞,與胞液直接接觸。Kim等54在硅納米線陣列上培養小鼠胚胎干細胞,借助共聚焦顯微鏡清楚地觀察到硅納米線刺入細胞,且細胞的壽命與刺入的硅納米線直徑有關,直徑越大細胞壽命越短。納米尺度的直徑和較大的高寬比使硅納米線容易進入活細胞內部,有助于在分子水平研究信號轉導與調節。因此硅納米線在構筑復雜神經界面的候選材料中占據著重要的一席之地。
3.2 硅納米線神經電極用于神經電信號記錄
硅納米線與金屬氧化物半導體場效應晶體管(metal oxide semiconductor field effect transistors,MOSFET)具有較好的匹配性,經n型或p型摻雜后作為MOSFET的溝道,溝道跨導可通過表面電荷或電壓進行調控。硅納米線FET檢測神經活動時,硅納米線與細胞接觸,當神經元活躍時,硅納米線附近環境電勢發生變化,晶體管器件獲取電流信號。采用自下而上的制備方法,硅納米線可以構筑寬尺寸范圍的神經電極,從亞細胞到細胞尺寸水平,實現胞內和胞外神經電信號記錄。
近十幾年來,Lieber課題組55-59報道了一系列基于硅納米線場效應晶體管的納米電子器件,主要分為平面型、扭結狀、U型硅納米線FET以及基于納米線-納米管異質結的枝狀FET。Patolsky等55在平面基底上制備高密度硅納米線FET陣列,研究了大鼠神經元的信號傳播。圖案化多聚賴氨酸直接誘導神經元軸突和樹突沿納米線陣列生長,形成多個硅納米線-神經突起異質結,接觸面積僅占0.01-0.02 μm2。在軸突和單個樹突起始處通過硅納米線FET施加電刺激,根據同一方向上其他硅納米線FET記錄到興奮性活動的時間,測得信號沿軸突和樹突傳播速率分別為(0.46 ± 0.06)、(0.15 ±0.04)m·s-1。
膜片鉗是傳統的胞內信號記錄技術,其尺寸大小與界面阻抗存在矛盾,為了解決這一問題,從而實現在減小細胞受到物理損傷的情況下進行胞內信號記錄,Tian等56和Qing等57采用扭結硅納米線構建了三維、柔性的納米FET生物探針,探針尖端呈60°,外層包覆磷脂雙分子層以利于探針記錄胞內信號。當硅納米線FET納米探針未與小鼠心肌細胞(HL-1)接觸時,電位顯示為0 mV,當探針尖端進入細胞內部后,電位由0 mV變為-46 mV,與玻璃微管電極記錄到的-50 mV胞內電位相差不大。類似的,Zhao等58提出一種三維U型硅納米線FET的設想,并規模化制造了數千個可記錄細胞內信號的納米線晶體管探針,探究了納米線的形狀與尺寸對信號質量的影響,發現曲率半徑與尺寸越小的FET能夠記錄到幅值更大的動作電位。此外,在單個探針臂上還可放置多個納米線FET實現對單個細胞的多位點檢測(如圖3a,b所示)。溝道長度約為50 nm、曲率半徑為0.75 μm的U型硅納米線FET在不經過脂質重新修飾的情況下,連續記錄了6個獨立的背根神經節神經元的胞內動作電位,信號的波形、幅值、發放模式及信噪比等特征都與膜片鉗記錄結果相似。上述研究證明了納米線FET具有尺寸小、可集成、侵入性小、不與細胞發生溶液交換等優點,有望代替傳統的膜片鉗電極進行高時空分辨率的胞內信號記錄。
扭結硅納米線需要原位逐個地組裝到生物探針上,難以大批量制備,限制了扭結硅納米線生物探針的進一步發展。Duan等59提出了另一種硅納米線FET,將二氧化硅納米管和硅納米線連接在一起形成T形結構,中空的納米管能穿透細胞膜使納米線與細胞質基質相接觸,這種器件被稱為枝狀納米管-場效應晶體管。增加了二氧化硅納米管后,FET的靈敏度由-170 nS·V-1提升至-4530 nS·V-1。由于FET檢測神經電活動不受界面阻抗的影響,該器件中的二氧化硅納米管尺寸可減小至3 nm,與神經細胞形成了穩定、緊密的封裝界面,信號記錄的空間分辨率大大提高。

圖3 硅納米線電子器件構筑神經界面Fig.3 Silicon nanowire-based nanoelectronic devices for neural interfaces.
為了能夠更好地同時進行體外組織培養和神經活動檢測,Tian等60發展了基于硅納米線場效應晶體管的多孔柔性納米電子支架,實時檢測細胞活動以及它們對藥物、pH變化的反應。Dai等61進一步將含有64個納米線晶體管的平面網狀支架通過內應力組裝成三維支架,在支架中體外培養大鼠心臟組織,同時記錄胞外動作電位,研究傳播方式。在8天的記錄期間,動作電位數量及幅值隨著組織發育而提升。
由于自下而上法制備納米線不受生長襯底的限制,硅納米線FET可集成到多種材料體系中。Qing等62在透明基底上制備硅納米線FET陣列,記錄急性腦切片中的單個細胞動作電位,繪制神經網絡的功能性連接,并進行多角度光學成像,更加完整地觀察細胞生長情況。利用3-500 μm間距不等的多個硅納米線晶體管記錄電刺激響應信號,通過比較相鄰晶體管的電導極性與振幅差異可獲取信號的空間分辨率,最高為5 μm。該器件記錄到的信號幅值在0.3-3 mV,通過使用突觸或離子通道阻斷劑,可將這些信號歸于突觸前或突觸后發放。硅納米線FET還可集成至多孔柔性網格神經探針63,64,采用玻璃管注射或冷凍方式植入小鼠腦中,與腦組織形成生物相容的神經界面,但是如何在活體實驗中對胞內和胞外的神經電信號進行穩定記錄,還有待進一步的探索。
硅納米線除了可以用于構建FET納米電子器件外,還可以用于構建神經電極陣列,以垂直硅納米線電極陣列為典型例子。Robinson等65制備了一種垂直硅納米線電極陣列,在每個位點上有9個垂直的硅納米線,直徑約為150 nm,長度為3 μm,納米線以Si為核、以SiO2為殼,尖端濺射金屬層Ti/Au。細胞與金屬尖端接觸,通過SiO2形成緊密封裝,防止電流泄漏。在電極陣列上體外培養大鼠皮層神經元,成功實現了對神經元電活動的刺激與記錄。研究人員還聯合使用該電極陣列與膜片鉗技術,繪制了單個突觸后神經元的多個突觸連接。Liu等66利用硅納米線電極陣列記錄體外培養的人誘導多能干細胞(hiPSC)來源的神經元活動,時長可持續6周,信號幅值可達99 mV。動作電位的極性反映了硅納米線所處的位置,刺入細胞內的硅納米線記錄到正電位,而細胞外的硅納米線則記錄到負電位(如圖3c所示)。
3.3 硅納米線用于神經活動調控
通過電或光刺激調控神經元活動,對腦科學基礎研究與腦疾病臨床治療都有著深遠意義。目前神經元活動的光學調控主要采用光遺傳方法67-69,它結合了光學、遺傳學和電生理等技術,使目標神經元在特定波長的光刺激下產生興奮性或抑制性活動,從而實現調控作用。由于需要提前在目標神經元中表達光敏蛋白,光遺傳方法的應用范圍受到限制。近年來,研究人員將目光投向電學、光學特性高度可調的硅納米材料,借助它們實現了無需基因操縱的遠程光學調控作用。
Jiang等70采用異質硅介孔結構顆粒構建了脂質雙分子層支撐的生物電界面,該顆粒以有序的硅納米線為骨架,隨機分布亞微米級孔洞,平均楊氏模量比單晶硅小2-3個數量級,具有生物相容性,可降解,通過快速瞬時的光熱效應誘導神經元去極化,打開鈉離子通道,產生動作電位。通過透射電鏡觀察橫截面可知該介觀結構材料中的硅納米線取向不受與之接觸的細胞表面影響,表明生物界面的穩定性與硅顆粒的形貌關系不大。波長與功率一定,使用不同時長的532 nm脈沖激光在生物界面誘發背根神經節神經元產生動作電位,平均閾值能量為5.32 μJ。接著以不同頻率條件施加該能量的脈沖激光,發現頻率增加,刺激效果減弱,而閾值下去極化行為更加明顯。Parameswaran等71研究了獨立的p型/本征/n型同軸硅納米線(PIN-SiNW)對神經元活動的調制,在單個納米線上記錄到了持續的陰極光電流,該電流可通過表面Au原子增強的光電化學過程激發原代培養的大鼠背根神經節神經元產生動作電位(如圖3d,e,f所示)。
Jiang等72以生物學原理為指導,提出一系列基于硅材料的自支撐生物電子設備的設計構想,構建了細胞內、細胞間及細胞外多尺度的生物界面,并在這些界面上對多種生理活動進行光學調控。Jiang等73總結了硅納米材料用于非遺傳式光調控的規范化流程,包括材料合成步驟、器件加工方法、材料光響應評估方法及儀器的詳細使用方法等,并介紹了利用硅納米材料對細胞鈣動力學、神經元興奮性、腦片神經遞質的釋放以及活體腦活動進行光調控的研究實例。如何用非遺傳式的方法實現特定腦區的神經元活動調控,是未來需要解決的難題之一。
4 石墨烯構筑神經界面
二維層狀材料的表面活性位點極多,展現出了與體材料不同的優異性能,石墨烯就是其中的一類。石墨烯由sp2雜化的碳原子以六邊形蜂窩狀排列方式組成,電子遷移率、導熱系數、拉伸強度等都大大優于其他材料,具有獨特的光學特性、機械穩定性與生物相容性。石墨烯可經功能化反應得到氧化石墨烯(graphene oxide,GO)、還原氧化石墨烯(reduced graphene oxide,rGO)及化學修飾石墨烯等衍生物。基于其突出的性能,石墨烯被認為是一種革命性的二維納米材料,受到了學術界與工業界的廣泛關注。除了在材料學、新能源等領域具有應用前景,石墨烯也有望替代傳統材料,用于構筑性能更加優異、功能更加多樣的神經界面。
4.1 石墨烯對神經界面的調控
干細胞擁有自我更新與增殖分化能力,主要應用于神經再生與修復、組織器官移植等。干細胞的活動受胞外微環境的影響,同時還與生長基底的表面形貌、應力、彈性、剛度及孔隙率等有關74。基于石墨烯材料的二維平面襯底21(如圖4a所示)或三維細胞支架22能夠提供仿生微環境,調控干細胞的命運,有助于進一步了解干細胞的命運決定機制。Guo等75用水熱還原法合成線型rGO纖維細胞支架,rGO纖維直徑約100 μm,表面粗糙,納米級多孔結構能夠提高神經干細胞新陳代謝所需營養物質的傳質效率,從而幫助細胞更好地粘附在纖維表面并生長。體外實驗結果表明,神經干細胞在這種纖維上的增殖速率比在石墨烯薄膜、組織培養板上的快,能夠在纖維表面形成細胞網絡,并且更傾向于分化成神經元而非膠質細胞。
除了干細胞療法,研究人員還致力于新型人工神經導管的開發。神經導管允許施旺細胞聚集、增殖,接納再生軸突,因能解決自體神經來源有限、異體神經存在免疫原性等問題,成為治療周圍神經缺損的自體神經移植替代物。Qian等76結合3D打印與逐層流延技術構建了一種多層多孔神經導管,該導管由聚多巴胺/多肽、石墨烯與聚己內酯組成,其中聚多巴胺與多肽能夠增強石墨烯對細胞膜的親和性,將導管植入大鼠體內,在坐骨神經損傷動物模型中有效促進了神經元軸突生長與髓鞘化,實現了外周神經修復功能。
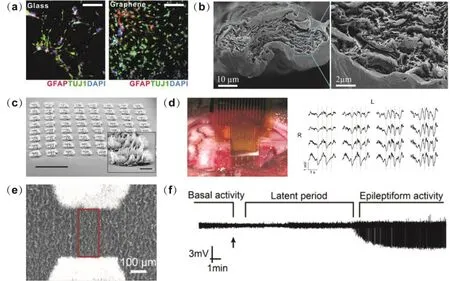
圖4 石墨烯電子器件用于檢測神經電活動Fig.4 Graphene-based electronics for neural recordings.
4.2 石墨烯神經電極用于神經電信號刺激與記錄
用于神經信號刺激與記錄的石墨烯電子器件主要分為微電極和場效應晶體管兩類。要實現高的信噪比和高時空分辨率的神經活動記錄及電刺激功能,微電極尺寸最好與單個神經元大小相當,界面阻抗低,電荷注入容量適當高以確保能夠傳遞足夠數量的電荷使細胞產生響應而又不損壞電極與生物介質。Wang等77采用濕法紡絲法獲得了以自支撐石墨烯纖維為導電層的神經微電極,濺射Pt作涂層(如圖4b所示),兩種材料的協同效應大大提高了該電極的電學性能,與單獨的石墨烯和Pt電極相比,1 kHz時的阻抗分別降低了5倍和300倍。電極的電荷注入容量為10.34 mC·cm-2,以9.2 dB的較高信噪比成功記錄到大鼠運動皮層以下1.5 mm深度處的單個神經元活動。
除了直接作導電層,石墨烯也可作為電極的修飾層材料,使神經界面更加穩定高效。Bourrier等78將連續的單層石墨烯轉移到密歇根電極上,植入后電極周邊的神經膠質細胞數量比修飾前的少,在5周時間內均可記錄到運動神經元的動作電位。然而,有研究顯示,由于受電極制備方法的限制與影響,修飾層材料與基底間的附著并不穩固,可能會從電極上脫落,導致電極性能降低甚至失效。為了解決這一問題,Lu等79通過CO2激光裂解法直接在PI基底上生成三維多孔石墨烯,制備得到柔性ECoG微電極陣列(如圖4c所示)。摻雜硝酸后,電極在1 kHz時的阻抗為519 Ω,電荷注入容量為3.1 mC·cm-2,遠優于傳統鉑電極。將該多孔石墨烯電極置于大鼠皮層可記錄到低頻場電位信號(如圖4d所示),施加電刺激可引發大鼠腿部肌肉活動。相較于微電極,場效應晶體管的突出優點是不受熱噪聲的影響,更易于構筑高空間分辨率的神經電極。Garrido課題組報道了一種柔性石墨烯場效應晶體管,單層石墨烯作溝道連接兩端的源極和漏極,浸沒在電解質溶液中的參比電極施加柵極電壓調控溝道電流。利用該石墨烯FET,研究人員分別記錄了麻醉狀態下大鼠皮層產生的自發慢波、視聽覺誘發的響應信號以及癲癇大鼠的同步放電活動80,發現石墨烯FET的信噪比與現有的鉑黑電極相當,但在低頻范圍內信噪比更高,適于記錄活動頻率極低的皮層擴散性抑制信號81。近年來,本課題組也對石墨烯場效應晶體管用于神經活動檢測進行了研究。Du等82研制了雙模式的柔性石墨烯FET陣列,ECoG電極貼附在大鼠腦表面,深部電極植入腦組織中,兩種模式的電極同時記錄青霉素誘發的癲癇信號,結果顯示表面癲癇信號的幅值明顯大于深部癲癇信號,癲癇放電過程始于腦表面,并且隨著時間的推移,腦表面和深部區域癲癇活動的同步性逐漸增強。
此外,本課題組還利用一維納米材料碳納米管和二維納米材料石墨烯的雜化優勢,采用一步化學合成法制備了無縫連接的單片全碳晶體管。全碳晶體管由石墨烯溝道和石墨烯/碳納米管雜化膜組成,具有連續的接觸電極,利用微納米加工技術,進一步制備了全碳晶體管陣列83。由于石墨烯FET的最小檢測限與其有效面積的平方根呈反比關系,所以不能無限制地減小石墨烯晶體管的尺寸來提高空間分辨率。為了進一步提高全碳晶體管陣列的空間分辨率,Yang等84采用機械壓縮法制備了柔性褶皺全碳晶體管陣列,在不損失晶體管有效面積的同時,器件的投影面積降低至原有面積的16%,空間分辨率提高6倍。在大的機械形變下,常規的石墨烯/金屬晶體管往往會產生應力破裂和節的失效,但石墨烯和碳納米管仍能保持穩定的電學性能。研究人員利用該器件實現了大鼠癲癇信號的在體高空間分辨檢測(如圖4e,f所示)。上述結果表明,新型材料的研究和器件的設計對于推動納米神經電極的發展具有重要的作用。
4.3 石墨烯構筑多模態集成神經電極
神經電極記錄神經電信號的時間分辨率較高,不足之處在于無法記錄大面積和高通量的神經元電活動85。透明神經電極可將電生理與神經成像、光遺傳等技術結合起來,改善這一問題,實現對電極位點處神經細胞在光或電刺激下活動狀態的觀察,有助于更加清晰完整地認識腦的結構與功能。ITO是透明電極的常用材料,但它的缺點是受到外力易產生裂縫,從而影響器件的使用壽命。石墨烯在較寬波長范圍內的透光性均超過90%86,且機械穩定性好,兼具柔性、生物相容性,因此成為構筑多功能神經界面的首選材料。此外,與磁共振成像兼容的神經電極,可將高分辨率的電生理檢測與大腦活動成像相結合,對于基礎神經科學研究和臨床腦疾病研究都至關重要。
Park等87發展了透明的石墨烯μECoG (microelectrocorticography)電極陣列并利用它開展了以下研究:(1)μECoG可對自發的神經活動和電刺激誘發的神經活動進行穩定記錄;(2)結合光遺傳,記錄并比較轉基因小鼠在不同光刺激下的響應信號;(3)通過熒光顯微法、光學相干斷層成像,觀察石墨烯神經電極與神經組織界面的狀態特征。對照實驗表明石墨烯電極的電學性能、神經信號記錄性能都與常規的Pt或Au電極相當,但在活體光學成像方面擁有顯著優勢,石墨烯電極位點下方的血管組織成像清晰,而常規金屬電極則會阻擋觀察視野(如圖5a,b,c所示)。在此基礎上,研究人員還借助鈣離子成像,繪制了神經組織在石墨烯電極施加不同電刺激條件下的時空活動(如圖5d,e,f所示)88。
Kuzum等89報道了一種同時用于神經信號檢測與鈣成像的透明石墨烯電極。該電極可實現對自發腦電和藥物或刺激誘發的相關電位的檢測,且噪聲水平比相同尺寸的Au電極低5-6倍。在鈣成像中,因鈣瞬變緩慢,無法觀測高頻神經活動,可借助石墨烯神經電極對其進行記錄;反之,鈣成像能夠反映神經網絡中單個神經元的活動狀態。此外,研究人員在石墨烯電極陣列位置實現了一系列從微觀到介觀的電信號記錄與光成像結構觀察,包括距離腦表面1200 μm深度的雙光子成像、光遺傳刺激引發的小動脈擴張及電刺激導致的血液動力學響應(如圖5g,h,i所示)90。光遺傳刺激和電信號同時記錄是神經環路研究的重要方法,但是傳統金屬電極在光刺激時會產生偽跡,影響電信號的記錄。上述兩項研究均發現,石墨烯神經電極在同時進行光刺激和電記錄時,均未產生光學引發的偽跡,解決了傳統金屬電極存在的問題。
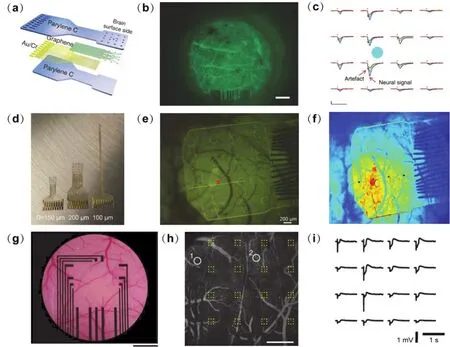
圖5 多模態集成的石墨烯神經電極Fig.5 Graphene microelectrodes for multimodal neural interfaces.
Jeong等91制備了透明的石墨烯/垂直排列碳納米管神經電極,其中碳納米管與細胞形成緊密接觸,石墨烯為光學觀察與調控提供了便利,同時雜化材料顯示了突出的導電性,利用該電極可檢測到大鼠皮層神經元自發的動作電位,峰間幅值高達1600 μV。Zhao等92通過低壓化學氣相沉積(low pressure chemical vapor deposition,LPCVD)法在銅微絲外包覆無縫、全覆蓋的石墨烯,得到與磁共振成像(magnetic resonance imaging,MRI)兼容的神經電極。石墨烯的加入能夠解決常規銅材料電極具有生物毒性不適于活體檢測的難題。該電極可以記錄到局部場電位和動作電位,且MRI研究證明其不會產生磁共振偽影。隨著神經檢測和各種成像技術的更新迭代,對大腦研究的方法將更加的多樣化,神經電極必將向著多模態集成的方向發展。
5 其他一維和二維納米材料構筑神經界面
除了上述受到廣泛關注的碳納米管、硅納米線和石墨烯納米材料,金屬及金屬氧化物納米線、氮化硼納米管、黑磷(black phosphorus,BP)及過渡金屬碳/氮化物(MXene)等一維和二維納米材料也被應用于神經界面的構筑,研究發現它們在神經活動檢測與刺激、視覺假體、組織修復等方面發揮了重要作用。
5.1 其他一維納米材料構筑神經界面
金屬納米線是一維納米材料的重要組成部分,具有獨特的電學和機械性能,可改善神經界面,實現神經電活動的在體穩定記錄。Kang等93在鎢絲尖端粘附單晶金納米線制備得到亞細胞尺寸的神經電極,將該電極植入小鼠海馬腦區,信噪比及空間分辨率均優于鎢絲電極,可記錄到單個神經元電活動,以及社交情景與疾病狀態下腦電活動的變化。神經電極的記錄功能不同,對電極的性能要求不同,用于脊髓神經元活動檢測的神經電極需要具有可拉伸性。Lu等94通過熱拉伸聚合物,隨后包覆一層網狀銀納米線作導電層和PDMS作絕緣層,制得一種柔性可拉伸的光電電極。與連續的金屬薄膜相比,網狀銀納米線導電層在彎曲和拉伸狀態下不易破裂,確保電極兼具良好的機械與電學性能,實驗表明該電極在拉伸100%后仍能保持較低的阻抗。該電極可記錄光刺激響應下的脊髓神經元動作電位,研究人員還發現光誘導的神經活動可導致小鼠后肢肌肉收縮。進一步增加電極通道數、排除信號檢測時運動噪聲的干擾是脊髓用神經電極的發展方向。
金屬氧化物納米材料具有多種氧化態、配位數和對稱性,展現出更加復雜的晶體結構和獨特的光電學性能95,這也使其在神經界面構筑中具有特殊的地位。Tybrandt等96以金修飾的二氧化鈦(Au-TiO2)納米線作導電層制備32通道的柔性神經網格電極(如圖6a所示),并將該電極植入大鼠的軀體感覺皮層,由于該電極可拉伸,動物手術時的開顱面積可小于電極尺寸。該電極可檢測刺激后肢產生的響應信號、不同睡眠時期的場電位變化(如圖6b所示),能夠長期穩定可靠地對神經電活動進行記錄。高取向性和各向異性的一維納米線的形貌和結構與感光體類似,能夠有效實現光吸收和電荷分離,因此非常適宜構建視覺神經假體。受光感受器的結構與納米線光伏器件的功能啟發,Tang等97研發了一種Au-TiO2納米線陣列人工光感受器(如圖6c所示),定向排列在柔性基底上的納米線增強了與視覺神經界面交互的有效性,在光照的作用下可以產生光電流使神經元去極化,而Au納米顆粒通過表面等離子體共振效應提高TiO2納米線在可見光范圍內的光吸收。研究人員將Au-TiO2納米線陣列植入失明小鼠的視網膜下方,發現小鼠的視網膜神經節細胞恢復了對綠光、藍光及近紫外光的響應(如圖6d所示),空間分辨率約50 μm。此外,在初級視覺皮層記錄到光誘導神經信號和瞳孔反射活動增強,表明這種人工光感受器有助于重建視覺功能。此外,進一步提高納米線陣列對光的靈敏度以改善空間分辨率、發展具有不同頻段光譜響應的納米線類型以實現彩色視覺的感知,是下一步需要解決的問題。
氮化硼納米管是碳納米管的結構類似物,具有獨特的機械、化學和電學性能。Ciofani等98提出了一種由氮化硼納米管與超聲波聯合調控的非侵入式間接電刺激方法。由于氮化硼納米管具有良好的壓電性,可通過內吞作用進入細胞內部,接收超聲波后因壓電效應導致內部極化,從而給予細胞電刺激。體外細胞培養實驗結果表明,受到氮化硼納米管電刺激的PC12細胞的突起長度比未受刺激的長30%,推測電刺激可能激活了神經細胞分化相關信號通路中TrkA受體下游的的信號分子,氮化硼納米管充當了內流的鈣離子角色。盡管這種電刺激方法得到了概念性驗證,借助壓電效應實現神經刺激引發的神經活動變化尚未揭露,氮化硼納米管的生物安全性也還有待更加詳細全面的評估。
5.2 其他二維納米材料構筑神經界面
二維半導體層狀材料BP是最穩定的磷同素異形體,能帶間隙調控范圍較寬,常用作高性能場效應晶體管的溝道材料,基于BP的光電器件的響應波長范圍涵蓋紫外光波段到微波波段99。近年來,黑磷-生物界面的多項研究表明,BP在生物醫學方面同樣具有很大的應用前景。過渡金屬離子代謝異常是導致神經退行性疾病的關鍵因素之一,使用螯合劑將它們變為無毒的金屬配合物能夠起到神經保護的作用。Chen等100首次將BP納米片用作納米藥物,它不需要額外負載其他藥物,可高效地選擇性螯合過多的銅離子,減少活性氧,保護神經細胞不受到毒害。與其他納米藥物相比,BP納米片的顯著優勢是可通過光熱效應提高血腦屏障的通透性從而穿越血腦屏障進入腦組織。BP在生理環境下可被氧化成磷酸根離子等小分子產物,起到促進細胞粘附和軸突延伸作用101。Qian等102制備了同軸逐層組裝的黑磷/聚己內酯納米支架,BP能夠在較長時間內被緩慢釋放。該支架具有良好的機械穩定性和導電性,在輕度氧化應激條件下能夠誘導血管生長、刺激鈣依賴的軸突和髓鞘再生,植入后4個月時間內未發現明顯的毒性反應。Liu等103則考察了BP與氧化石墨烯納米片對細胞增殖和骨再生的協同效應,發現氧化石墨烯主要在初期增強細胞粘附,BP促進了成骨細胞的分化。
過渡金屬碳/氮化物(MXene)是二維納米材料的新成員,片層結構與石墨烯類似,由于具有良好的導電性、親水性和大的比表面積,成為構筑神經界面的理想材料。Xu等104利用超薄導電的Ti3C2MXene構建了FET,用于海馬神經細胞的多巴胺檢測和神經電信號記錄,時間分辨率可達50 ms。透明的Ti3C2MXene有助于同時進行神經電信號記錄與鈣離子成像,可與神經細胞形成長期穩定的兼容性神經界面。Driscoll等105將Ti3C2MXene分散液直接旋涂到硅片上制備神經電極。與同樣尺寸的Au電極相比,Ti3C2電極的阻抗值降低4倍,信噪比更高(如圖6e,f所示)。神經元可在Ti3C2薄膜上生長并形成神經網絡,表明Ti3C2無明顯的細胞毒性。
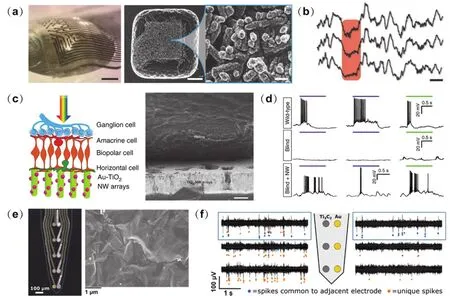
圖6 其他一維和二維納米材料構筑神經界面Fig.6 Other 1D and 2D nanomaterials for neural interfaces.
6 總結與展望
實現對神經元集群活動的實時觀察,進而解析神經環路的結構和功能,對認識腦、保護腦、開發腦具有重要意義。神經電極是檢測神經電生理信號的重要工具,電極的長期穩定性有賴于電極-神經組織界面的物理、化學、機械及電學性質106。傳統的神經電極由硅或貴金屬組成,但因力學性能與腦組織不匹配,電極尺寸受到限制,電極的長期穩定性、時空分辨率都有待提高。具有優異性能的納米材料的出現,為構筑及調控神經界面開辟了新的途徑。在前文中,我們對一維碳納米管和硅納米線、二維石墨烯以及其他一維二維納米材料各自的性質、與細胞的相互作用以及在神經電極中的應用做了綜述。眾多研究表明,納米材料具有良好的生物相容性,其尺寸及電學性能可以被精準調控,易于轉移到柔性基底上制備成柔性神經電極,電極與腦組織的力學性能更加匹配,長期植入的機械相容性更好,大大改善了傳統記錄方法存在的局限性,成功實現了對培養的神經細胞、腦片和活體動物大腦組織神經元電活動的記錄與刺激、神經遞質的微量檢測以及與光遺傳、光成像、核磁共振等技術的聯合應用。
盡管取得了長足進展,基于納米材料構筑的神經電極還需要更深入、更全面的研究,特別是作用機制以及在實際應用中所面臨的問題。例如,納米材料與神經組織的相互作用、干細胞在納米材料上的命運決定機制、電極材料在植入腦組織后的動力學變化以及納米材料在體內的毒性等都尚未得到清楚的認識。Pampaloni等107通過理論模擬及實驗觀察,提出單層石墨烯能夠調控細胞外離子分布,在石墨烯表面俘獲鉀離子,降低了鉀離子的遷移率,從而導致石墨烯上生長的神經元興奮性增強。Li等108在石墨烯上體外培養小鼠海馬神經元,發現與聚苯乙烯組織培養板相比,石墨烯上神經元的生長相關蛋白GAP-43表達水平更高,推測這是石墨烯能夠促進神經突起出芽生長的原因之一。
目前基于納米材料的神經電極主要在嚙齒類動物中進行在體實驗,如何利用神經電極實現全腦尺度的神經環路機制追蹤以及如何對人類神經系統疾病進行臨床診斷與治療是未來的研究趨勢,這也對神經界面提出了更高的要求。首先是納米材料的安全性,顆粒濃度、尺寸大小、幾何形狀、組成及表面等多種復雜因素共同決定了納米材料的毒性效應,體現在產生活性氧、溶入有毒離子、改變蛋白質折疊構象、造成細胞膜變薄或斷裂等109。例如,Yang等110發現碳納米管可以進入并聚集在小鼠胚胎干細胞中導致DNA氧化損傷。Pulskamp等111發現材料合成過程中引入的金屬催化顆粒會殘留在碳納米管中帶來毒副作用。雖然這些研究顯示了碳納米管對細胞存在毒性效應,但當其被固定在基底或電極上,經過純化或表面功能化修飾處理后,危險程度比自由活動狀態的碳納米管低112。Hu等113探究了痕量氧化石墨烯對斑馬魚產生的生物效應,結果表明氧化石墨烯可誘導神經功能障礙,子代斑馬魚的多巴胺能神經元丟失66-87%,內質網的形態與超微結構受損,自噬相關蛋白表達水平上調。石墨烯納米材料產生細胞毒性的機制目前尚不十分明確,但已有的研究表明產生氧化應激和炎癥反應是其導致細胞死亡的主要機制114。Jiang115系統研究了不同硅納米線的細胞毒性,隨著硅納米線濃度的增加和共孵育時間的推移,細胞活性呈明顯下降趨勢,相同培養條件下腫瘤細胞的活性高于正常細胞,濕法化學刻蝕法制備的硅納米線的生物相容性優于氣-液-固相法制備的硅納米線。可見納米材料的安全性存在爭議,在實際應用中需針對具體的使用對象及方式,優化材料的結構設計與合成方法,并對安全性進行充分謹慎的評估。其次是神經元活動信號的采集,如何將電極在不受損的情況下植入腦組織更深的位置、對跨腦區的多個神經元活動同時進行檢測、降低或消除多種來源的噪聲等,都是值得研究的課題。最后是納米材料神經電極的商業化開發。規模化生產要求反應條件盡量溫和,成本消耗較低,合成出的納米材料質量均一。因柔性聚合物基底不耐CVD法中的高溫條件,石墨烯往往需要在其他基底上生長,然后進行轉移,這一步容易造成石墨烯出現褶皺和缺陷,限制了石墨烯用于高通量設備的制造。改良轉移操作技術以保持石墨烯性質不變,或讓石墨烯在較低溫度直接生長在最終所需的基底上,成為打破這項限制的兩個研究方向116。
一維及二維納米材料可構筑性能優異、功能多樣的神經界面,為新型神經電極的構想創造了機遇。在多學科、跨領域研究人員的通力合作下,將電極作為記錄模塊與光學成像、電子工程等集成在一起,構建閉環系統按需調控神經活動,實現設備的微型化、智能化以及多功能化,是未來神經電極發展的趨勢。

