分泌性中耳炎患者手術前后血清和中耳積液中β2?M、S?IgA及炎性因子水平變化
王 玲,羅 偉,文 科,黃朝平
分泌性中耳炎(secretory otitis media, SOM)為耳鼻喉科常見病、多發病,表現為聽力下降、鼓室積液,且近年發病率呈逐漸上升趨勢[1]。 臨床常采用鼓膜切開、鼓室穿刺抽液等多種手術方式或糖皮質激素等藥物治療[2?3],準確評估其治療效果具有重要意義。 目前關于SOM 的發病機制尚未明確,作為典型炎性疾病,血清炎性因子[腫瘤壞死因子?α(TNF?α)、白細胞介素?6(IL?6)、白細胞介素?10(IL?10)]水平變化對疾病診斷具有重要參考價值[4]。 β2?微球蛋白(β2?M)、分泌型免疫球蛋白A(S?IgA)亦是反映免疫水平的指標,其中β2?M 作為一種小分子蛋白質,主要由免疫細胞產生[5?6],而免疫球蛋白A(IgA)為血清含量僅次于免疫球蛋白G(IgG)的免疫球蛋白類型,可分為血清型與分泌型[7]。 現文獻關于SOM 患者手術前后β2?M、S?IgA變化研究較少。 因此,本文分析SOM 患者手術前后血清與中耳積液中β2?M、S?IgA 及炎性因子水平變化,現報告如下。
1 資料與方法
1.1一般資料 選取2017 年5 月—2019 年5 月我院收治的符合納入及排除標準的88 例SOM 作為觀察組,其中男47 例,女41 例;年齡23 ~54(38.45±3.96)歲;病程1~10(5.78±0.62)個月;阻塞后鼻孔程度51~75(63.13±6.45)%;體質量指數15 ~30(22.35±2.47)kg/m2。 納入標準:①接受耳顯微鏡或內鏡等檢查,且符合SOM 診斷標準[8];②均行手術治療;③患者聽力下降或反復間斷性耳痛、耳堵塞感,鼓膜內陷活動度下降,呈黃色或琥珀色,可見液平面或積液征;④聲導抗測試鼓室導抗圖為B 型,有傳導性聽力損失20 ~50 dB;⑤患者和(或)其家屬對本研究知情同意,且簽署知情同意書。 排除標準:①合并腺樣體殘留、鼻咽癌、慢性肥厚性鼻炎等五官占位性病變;②其他病變所致的中耳積液或鼓室積液;③合并嚴重心、肝、腎功能障礙或原發性高血壓病等循環系統疾病;④合并糖尿病等內分泌系統、免疫系統、精神系統疾病;⑤近期未口服影響免疫抗體藥物。 選擇同期在我院體檢的健康者60 例作為對照組,其中男32 例,女28 例;年齡25 ~52(38.52±3.89)歲。 兩組性別、年齡比較差異無統計學意義(P>0.05),具有可比性。 本研究經醫院醫學倫理委員會批準執行。
1.2治療方法 觀察組行鼓膜切開置管術,于耳內鏡下操作,先進行外耳道常規消毒,在骨膜前下象限穿刺抽取積液,常規予以地塞米松及α 糜蛋白酶沖洗鼓室,后進行置管操作。
1.3觀察指標 比較觀察組術前血清和中耳積液與對照組體檢時血清β2?M、S?IgA 及 炎性 因 子(TNF?α、IL?6、IL?10)水平以及SOM 患者術前及術后3 d 血清和中耳積液β2?M、S?IgA 及炎性因子水平,分析SOM 患者血清和中耳積液β2?M、S?IgA 與中耳積液炎性因子的相關性。
采集觀察組術前、術后3 d 中耳積液,即常規消毒外耳道,鼓膜表面麻醉后行鼓膜前下象限穿刺抽取積液0.1 ml,放于浸入冰水中的含50 μl 抑肽酶的塑料管中備用。 此外,觀察組于術前和術后3 d、對照組于體檢時采集空腹靜脈血3 ml,以3000 r/min的速度離心10 min,取上清液保存于-80℃冰箱中備用。 采用放射免疫法測定β2?M 水平,試劑盒購自北京華清生化技術研究所,嚴格按照試劑盒說明書進行;采用美國庫爾特-貝克曼公司提供的AU5800 型全自動生化分析儀測定S?IgA 水平;采用酶聯免疫吸附試驗法測定血清TNF?α、IL?6、IL?10水平,試劑盒購自上海恒遠生物科技有限公司。
1.4統計學方法 采用SPSS 20.0 統計學軟件處理數據,計量資料多組間比較采用單因素方差分析,兩兩比較采用Dunnet?t檢驗或配對樣本t檢驗,以均數±標準差(±s)表示;采用Pearson 相關性分析觀察SOM 患者血清和中耳積液β2?M、S?IgA 與中耳積液炎性因子的相關性,以α =0.05 為檢驗水準。
2 結果
2.1β2?M、S?IgA 水平比較 與對照組血清比較,觀察組術前血清和中耳積液β2?M、S?IgA 水平升高,差異有統計學意義(P<0.05 或P<0.01),見表1。
表1 分泌性中耳炎患者術前血清和中耳積液及健康體檢者體檢時血清β2?M、S?IgA 水平比較(±s)

表1 分泌性中耳炎患者術前血清和中耳積液及健康體檢者體檢時血清β2?M、S?IgA 水平比較(±s)
注:觀察組為分泌性中耳炎患者,對照組為健康體檢者;β2?M 指β2?微球蛋白,S?IgA 指分泌型免疫球蛋白A;與對照組血清比較,aP<0.05,bP<0.01
組別 例數 β2?M(μg/ml) S?IgA(g/L)觀察組 88 血清 2.34±0.26a 2.53±0.26b 中耳積液 7.01±0.74b 4.96±0.52b對照組血清 60 2.25±0.22 2.26±0.28 F 50.631 35.629 P<0.001 <0.001
SOM 患者術前和術后3 d 血清β2?M、S?IgA 水平均低于中耳積液水平,差異有統計學意義(P<0.01);與術前比較,SOM 患者術后3 d 血清和中耳積液β2?M、S?IgA 水平下降,差異有統計學意義(P<0.01)。 見表2。
表2 SOM 88 例手術前后β2?M、S?IgA 水平比較(±s)
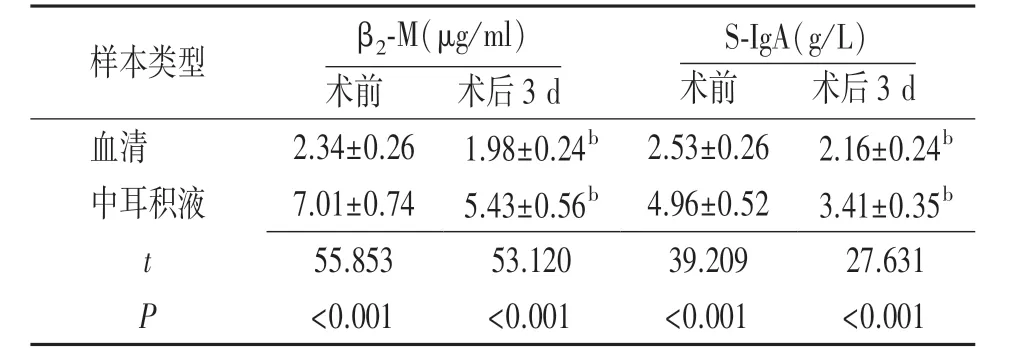
表2 SOM 88 例手術前后β2?M、S?IgA 水平比較(±s)
注:SOM 指分泌性中耳炎,β2?M 指β2?微球蛋白,S?IgA 指分泌型免疫球蛋白A;與術前同一樣本比較,bP<0.01
樣本類型 β2?M(μg/ml)術前 術后3 d S?IgA(g/L)術前 術后3 d血清 2.34±0.26 1.98±0.24b 2.53±0.26 2.16±0.24b中耳積液 7.01±0.74 5.43±0.56b 4.96±0.52 3.41±0.35b t 55.853 53.120 39.209 27.631 P<0.001 <0.001 <0.001 <0.001
2.2炎性因子水平比較 與對照組血清比較,觀察組術前血清和中耳積液TNF?α、IL?6、IL?10 升高,差異有統計學意義(P<0.01)。 見表3。
表3 分泌性中耳炎患者術前血清和中耳積液及健康體檢者體檢時血清炎性因子水平比較(±s)
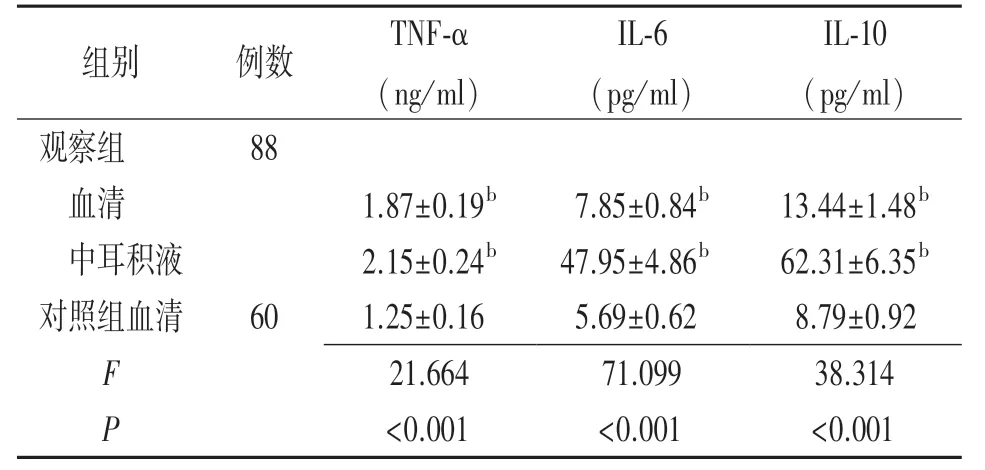
表3 分泌性中耳炎患者術前血清和中耳積液及健康體檢者體檢時血清炎性因子水平比較(±s)
注:觀察組為分泌性中耳炎患者,對照組為健康體檢者;TNF?α 指腫瘤壞死因子?α,IL?6 指白細胞介素?6,IL?10 指白細胞介素?10;與對照組血清比較,bP<0.01
組別 例數 TNF?α(ng/ml)IL?6(pg/ml)IL?10(pg/ml)觀察組 88 血清 1.87±0.19b 7.85±0.84b 13.44±1.48b 中耳積液 2.15±0.24b 47.95±4.86b 62.31±6.35b對照組血清 60 1.25±0.16 5.69±0.62 8.79±0.92 F 21.664 71.099 38.314 P<0.001 <0.001 <0.001
SOM 患者觀察組術前和術后3 d 血清TNF?α、IL?6、IL?10 水平均低于中耳積液水平,差異有統計學意義(P<0.01);與術前比較,SOM 患者術后3 d血清和中耳積液TNF?α、IL?6、IL?10 水平下降,差異有統計學意義(P<0.01)。 見表4。
表4 SOM 88 例手術前后炎性因子水平比較(±s)
注:SOM 指分泌性中耳炎,TNF?α 指腫瘤壞死因子?α,IL?6 指白細胞介素?6,IL?10 指白細胞介素?10;與術前同一樣本比較,bP<0.01
樣本類型 TNF?α(ng/ml)術前 術后3 d IL?6(pg/ml)術前 術后3 d IL?10(pg/ml)術前 術后3 d血清 1.87±0.19 1.65±0.18b 7.85±0.84 6.54±0.78b 13.44±1.48 9.42±0.99b中耳積液 2.15±0.24 1.86±0.19b 47.95±4.86 23.48±2.49b 62.31±6.35 43.12±4.43b t 8.851 7.527 76.271 60.902 70.311 69.644 P<0.001 <0.001 <0.001 <0.001 <0.001 <0.001
2.3SOM 患者血清和中耳積液β2?M、S?IgA 與中耳積液炎性因子相關性分析 Pearson 相關性分析顯示,SOM 患 者血 清β2?M、S?IgA 與 中耳 積 液TNF?α、IL?6 呈正相關,中耳積液β2?M、S?IgA 與中耳積液TNF?α、IL?6 也呈正相關(P<0.05 或P<0.01),見表5、表6、圖1、圖2。
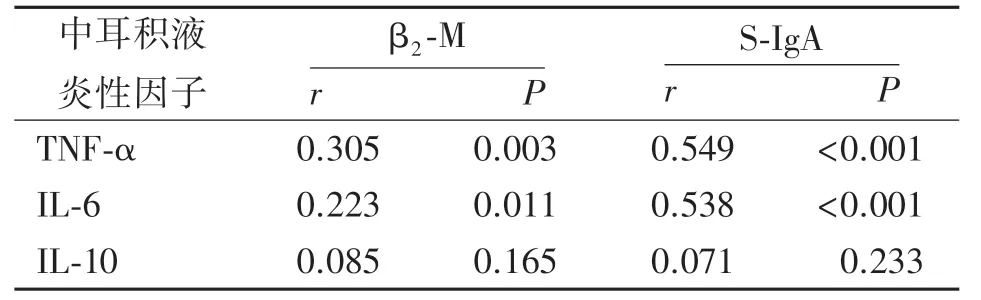
表5 SOM 患者血清β2?M、S?IgA與中耳積液炎性因子相關性分析
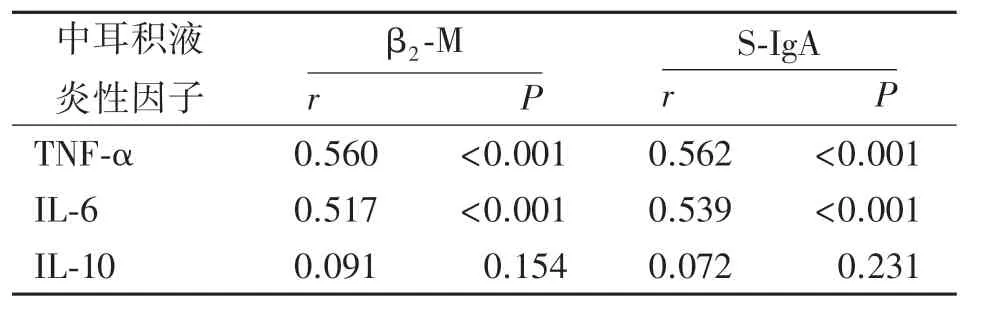
表6 SOM 患者中耳積液β2?M、S?IgA與中耳積液炎性因子相關性分析
3 討論
SOM 為臨床常見的中耳非化膿性炎性疾病[9],患者咽鼓管黏膜腫脹閉塞導致中耳呈負壓狀態,黏膜血管于負壓影響下發生充血、擴張,最終導致鼓室積液,若未及時治療,可能導致鼓室粘連、聽骨鏈壞死等情況,同時造成不同程度的傳音性耳聾,嚴重影響患者生活質量,因而及早診治具有重要意義[10?11]。 關于SOM 的發病機制目前尚未明確,多認為免疫功能低下、炎性因子水平變化是SOM 主要發病機制。 β2?M 在循環系統中不易與血漿蛋白形成復合物,且不受患者年齡、腎功能狀態等影響,其水平變化可較好反映腎小球濾過功能,與腎小球腎炎等早期腎損傷關系密切[12]。 有研究發現,中樞神經系統發生感染時,組織器官會出現免疫應激細胞變性、壞死等癥狀,繼而產生過量的β2?M[13]。 SOM 屬于中樞性疾病,考慮β2?M 也會發生一定變化。S?IgA是由J 鏈連接形成的多聚體IgA 與分泌片段結合后形成的復合物,為黏膜免疫的主要抗體,可有效阻斷病原體對深層組織的感染與入侵[14],故考慮S?IgA 在SOM 患者黏膜損傷中也有一定作用,但目前關于β2?M、S?IgA 在SOM 患者手術前后的變化研究較少。
本研究顯示,觀察組術前血清與中耳積液β2?M水平均明顯高于對照組血清,且SOM 患者術前血清β2?M 水平低于中耳積液水平,表明SOM 患者體內β2?M 呈升高趨勢,尤其是中耳積液β2?M 升高較明顯,與汪曉雷等[15]研究結果相似。 中耳積液β2?M升高更明顯可能是因為β2?M 主要為源自中耳黏膜的局部免疫應答物質,是由Ⅲ型變態反應引起中耳黏膜損傷導致毛細血管通透性增加而滲出所致[16]。免疫球蛋白為機體體液免疫功能的重要組成部分,由漿細胞分泌,是存在抗體活性與免疫調節作用的蛋白質,其中IgA 由鼻、肺等部位的黏膜分泌,屬于防御病原體的第一道防線[17]。 張國龍和陶躍進[18]報道急性SOM 患者外周血T 淋巴細胞亞群及免疫球蛋白均有一定變化,其中IgA 經治療后水平明顯下降。 本文觀察組術前血清與中耳積液S?IgA 水平均明顯高于對照組,且SOM 患者術前血清S?IgA 水平低于中耳積液水平,表明SOM 患者血清或中耳積液S?IgA 水平呈升高趨勢,尤其是中耳積液S?IgA 升高更明顯,可能是因為S?IgA 為黏膜表面分泌最多的抗體,可在細胞內中和病原微生物,穿透上皮細胞而有效清除黏膜部位的免疫復合物、上皮細胞內抗原[19]。 若SOM 患者鼓室黏膜發生腫脹和閉塞[20],可檢測到患者中耳積液較高水平的S?IgA。 本研究顯示,SOM 患者術后3 d 血清與中耳積液β2?M、S?IgA水平低于術前,且血清與中耳積液同一時間β2?M、S?IgA 水平比較差異也有統計學意義,證實β2?M、S?IgA 對評估SOM 患者手術治療效果也有一定價值。
SOM 患者在受到病原體感染、創傷等因素影響后,體內存在一定的炎性反應,而TNF?α 為淋巴細胞、單核巨噬細胞合成與分泌的炎性因子,可刺激內毒素而誘導炎性因子如IL?6、IL?10 等生成,加重炎癥反應[21?22]。 本研究發現,觀察組術前血清與中耳積液TNF?α、IL?6、IL?10 水平均較對照組升高,與更藏達杰和毛海明[23]報道的SOM 患者體內炎性因子及細胞或體液免疫狀態均表現異常的結果一致。 本研究對比了SOM 患者手術前后炎性因子水平變化,發現SOM 患者術后3 d 血清與中耳積液TNF?α、IL?6、IL?10 較術前下降,且術前和術后3 d 血清與中耳積液TNF?α、IL?6、IL?10 水平比較差異均有統計學意義,表明監測炎性因子水平對評估SOM 治療效果有積極意義。 馬翔宇[24]研究證實,SOM 患者手術前后TNF?α、IL?6、IL?10 發生明顯變化。
本研究Pearson 相關性分析顯示,SOM 患者血清β2?M、S?IgA 與中耳積液TNF?α、IL?6 呈正相關,中耳積液β2?M、S?IgA 與中耳積液TNF?α、IL?6 也呈正相關,表明SOM 患者中耳黏膜損傷也可能與炎癥反應水平有關,在治療時可從減輕患者中耳黏膜損傷入手以提高整體治療效果。
綜上所述,SOM 患者手術前后血清及中耳積液β2?M、S?IgA 與炎性因子(TNF?α、IL?6、IL?10)發生一定變化,監測其水平變化有利于評估治療效果。

