免疫檢查點抑制劑治療的肝臟毒性管理
黃佩新, 張 嵐, 陳 漪
復旦大學附屬中山醫院肝腫瘤內科,上海 200032
近年來,以免疫檢查點抑制劑(immune checkpoint inhibitors, ICIs)為代表的免疫治療在惡性腫瘤治療領域獲得了令人矚目的療效,成為繼化療、靶向治療后,腫瘤全身治療的又一重要選擇。隨著ICIs的廣泛運用,在改善多種腫瘤預后的同時,其帶來的免疫相關不良事件(immune-related adverse events, irAEs)也不容小覷。肝臟是消化系統的重要器官,承擔人體的消化吸收、藥物代謝及部分免疫功能,也是irAEs的累及系統之一。基于CheckMate 040[1]及KEYNOTE-224[2]研究結果,美國FDA批準納武單抗(nivolumab,2017年)和帕姆單抗(pembrolizumab,2018年)作為二線用藥,用于索拉非尼治療失敗的肝細胞肝癌(hepatocellular carcinoma, HCC),但其在提高療效的同時,也增加了肝臟相關不良事件[3]。系統認識ICIs相關的肝臟不良反應,早期診斷和規范管理,對于改善腫瘤患者預后具有重要意義。
1 ICIs概述
目前批準的ICIs類藥物主要包括細胞毒性T淋巴細胞抗原4(CTLA-4)抑制劑和程序性死亡因子-1(PD-1)及其配體(PD-L1)抑制劑。ICIs的作用機制區別于傳統的“免疫增強”理論,被認為是“免疫正常化”,即選擇性阻斷PD-1/PD-L1或CTLA-4下游信號通路,通過恢復效應T細胞的功能,特異性識別和殺傷腫瘤細胞,從而在腫瘤微環境中發揮阻斷腫瘤免疫耐受和免疫逃逸的作用[4-5]。irAEs的發生可能與免疫系統非特異性激活,降低自身免疫耐受、打破免疫平衡相關,但具體機制尚不明確。研究[6]顯示,不同的ICIs發生irAEs的毒性譜并不相同,irAEs的產生機制也各有差異。可能的機制主要有3個方面:(1)ICIs與非腫瘤組織的靶受體結合誘導下游免疫反應的產生;(2)效應T細胞對非靶組織上的抗原再激活,誘導免疫攻擊;(3)ICIs誘導炎癥因子的產生。
2 irAEs的發生率及致死率
irAEs可發生在全身各個系統,大多數為輕至中度,經激素治療后可逆,致死率較低。最常發生的部位包括皮膚、消化道、內分泌及肝臟;而腎臟、心臟、眼、神經系統、呼吸系統及血液學毒性較為罕見,但致死率較高[7-10]。ICIs首次治療的6個月內是發生irAEs的高峰期,皮膚毒性通常最早(2~3周)出現,其次是消化道不良反應,如腹瀉、結腸炎(一般6~7周),肝臟毒性(8~12周),但整個免疫治療過程中,甚至治療結束后均有發生irAEs的風險。ICIs的常見irAEs及其發生率見表1[11-12],在不同瘤種和不同臨床試驗中數據有差異。Wang等[13]的研究顯示, 從2009至2018年全球藥物不良反應數據庫Vigilyze-Vigibase(http://www.vigiaccess.org/)總計超過1 600萬例報告中共篩選出31 059例接受ICIs治療的相關病例,僅有613例患者死于irAEs,占0.3%~1.3%。該研究統計了112項共計19 217例患者的臨床試驗結果,顯示4種不同ICIs免疫不良反應的總體死亡率分別為0.36%(PD-1抑制劑)、0.38%(PD-L1抑制劑)、1.08%[14](CTLA-4抑制劑)及1.23%[15](CTLA-4/PD-1聯合用藥),聯合用藥的irAEs死亡率升高;發生的中位時間分別為40 d(PD-1/PD-L1抑制劑)、40 d(CTLA-4抑制劑)和14.5 d(聯合用藥),數據多來自黑素瘤臨床試驗。CTLA-4抑制劑的irAEs發生率和嚴重程度均高于PD-1/PD-L1抑制劑,其最常見的致死性irAE為結腸炎,占CTLA-4抑制劑irAEs致死病例數的70%[16];PD-1/PD-L1抑制劑相關的致死性毒性,常見為肺炎(35%)、肝臟毒性(25%)和神經毒性(15%)[17]。聯合用藥的irAEs致死率顯著升高,其中免疫性結腸炎(5%)、心肌炎(39.7%,致死率最高)、內分泌毒性(2%)、肝炎及肺炎(10%~17%)為主要致死性不良反應類型[18]。
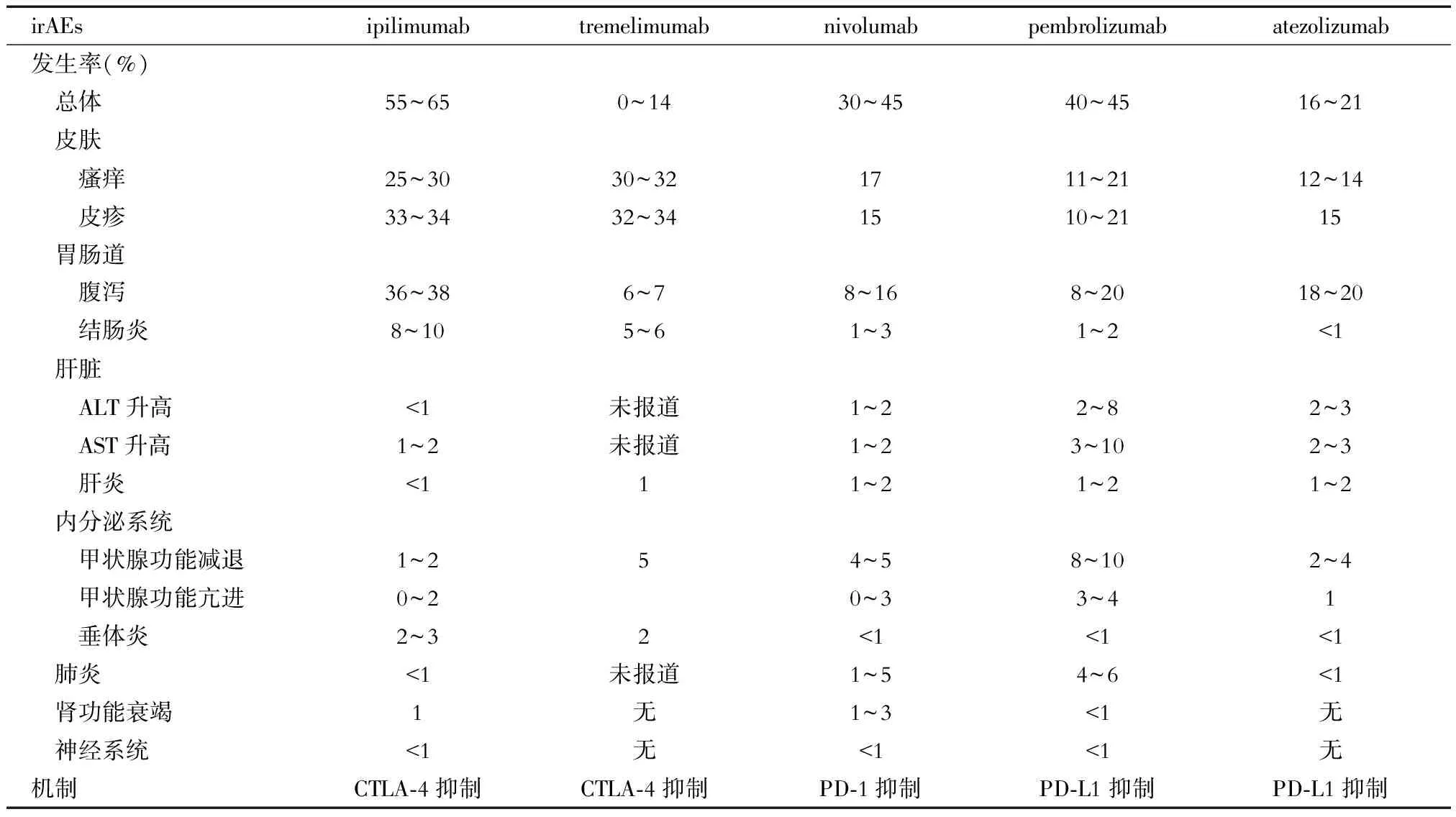
表1 常見ICIs致irAEs的發病情況[11-12]
ALT:丙氨酸轉氨酶;AST:天冬氨酸轉氨酶
3 ICIs的肝臟不良反應
肝臟是重要的藥物代謝器官,也具有一定的免疫功能。接受常規劑量ICIs治療,免疫相關的肝臟毒性發生率單藥為1%~10%,3級及以上為1%~2%;CTLA-4抑制劑出現丙氨酸轉氨酶(alanine transaminase, ALT)和/或天冬氨酸轉氨酶(aspartate aminotransferase, AST)升高的發生率在10%以內;PD-1/PD-L1抑制劑發生率約5%;聯合用藥的肝毒性發生率為25%~30%,3級及以上約為15%[19]。單藥3級以上肝臟irAEs發生的中位時間約為14.1周,聯合用藥的3級以上irAEs發生中位時間為7.4周,且持續時間更長[20]。值得注意的是,ICIs聯合化療或靶向治療時,irAEs的發生率均有所升高(9%~20%)[19]。肝臟irAEs的發生通常較為隱匿,可不伴有明顯的臨床癥狀,也可與其他消化道癥狀伴隨出現,如納差、乏力等。實驗室檢查主要表現為ALT及AST升高,伴或不伴膽紅素升高,需進一步完善檢查,如肝炎病毒學檢測、肝臟影像學檢查,必要時進行肝穿刺活檢,獲得病理學依據。病理學診斷有助于鑒別其他抗腫瘤藥物引起的藥物性肝損傷、病毒激活或肝內腫瘤進展引起的肝功能異常等,對于指導后續治療具有重要意義。ICIs肝毒性的病理表現為活動性泛小葉型肝炎,與自身免疫性肝炎較難鑒別,需要有經驗的病理科醫師參與。CTLA-4抑制劑引起的肝臟irAEs,通常伴以淋巴細胞為主的混合炎癥細胞浸潤(肝竇組織細胞增生癥)和中央靜脈炎;而PD-1/PD-L1抑制劑引起的門靜脈炎癥較輕;罕見門靜脈炎癥及膽管炎報道[21-22]。
4 肝臟irAEs的治療及預后
隨著ICIs在臨床實踐中大量應用(美國FDA已在8種惡性腫瘤中批準使用[23])及對irAEs認識的逐漸加深,國內外相關專業機構制訂irAEs管理的指南和指導意見。目前國際上常用的irAEs管理指南主要由美國國立綜合癌癥網(National Comprehensive Cancer Network, NCCN)與美國臨床腫瘤學會(American Society of Clinical Oncology, ASCO)聯合發布[23-24],歐洲醫學腫瘤學協會(European Society of Medical Oncology, ESMO)[25]、國際腫瘤免疫治療學會毒性反應管理協作組[Society for Immunotherapy of Cancer(SITC)Toxicity Management Working Group][7]等權威發布,在我國,則由中國臨床腫瘤學會(Chinese Society of Clinical Oncology, CSCO)[26]發布。
這些指南在肝臟不良反應分級上基本一致,分為1~4級(G1~G4),分別為輕、中、重度及致死性肝臟不良事件,以ALT及AST為主要評價指標;但在對膽紅素升高的評價和管理上,略有區別。毒性管理根據不良反應級別進行:輕度(G1)肝臟毒性(ALT、AST<3倍正常上限),建議繼續使用ICIs治療,每周監測1次肝功能,如肝功能穩定,適當減少檢測頻率。中度(G2)肝臟毒性(ALT、AST 3~5倍正常上限),建議暫停ICIs治療,排除其他可能引起肝功能異常的因素后,予以口服潑尼松治療(推薦劑量每天0.5~1 mg·kg-1),肝功能好轉后逐步減量,各指南建議皮質類固醇的總療程為至少4周。重度(G3)肝臟毒性(ALT、AST達5~20倍正常上限),建議暫停ICIs,靜脈使用甲潑尼龍1~2 mg/kg;待肝臟毒性降至2級后,可等效改口服潑尼松并繼續緩慢減量。對于ALT/AST>400或膽紅素、INR或白蛋白異常者,建議每天1~2 mg·kg-1甲潑尼龍靜脈使用,并密切監測肝功能。對于靜脈激素治療3 d效果不佳者,可考慮加用嗎替麥考酚酯0.5~1 g,每日2次。致死性(G4)肝臟不良事件者(ALT、AST>20倍正常上限),所有指南一致建議永久停用ICIs治療,住院接受每天1~2 mg·kg-1靜脈皮質類固醇治療,降至2級后,改等效潑尼松口服并逐步減量;3 d后如肝功能無好轉,考慮加用嗎替麥考酚酯;如嗎替麥考酚酯效果仍不佳,可加用他克莫司,對于ICIs肝臟毒性患者不推薦使用英夫利西單抗,因該藥物本身可致肝損。NCCN和ESMO指南均指出,在個例報道中,激素和嗎替麥考酚酯治療無效的急性重型肝炎使用抗甲狀腺球蛋白抗體可能有效。此外,IL-6單抗、抗CD20及抗TNF-α單抗成功治療危重和難治性肝毒性的案例也有報道[27],但NCCN指南指出,抗TNF-α藥物應避免用于免疫相關性肝炎。各指南對于膽紅素升高的管理各有不同,ESMO和NCCN指南對轉氨酶升高1級以上且膽紅素升高>1.5正常上限的irAEs患者,建議永久停用ICIs治療,其治療遵從4級不良反應治療原則;CSCO和SITC指南將膽紅素參照常見不良事件評價標準(CTCAE 5.0)[28]分為1~4級,與ALT、AST并列,管理相同。此外,對于基線存在肝轉移的患者,SITC和CSCO提示可在相當于2級肝臟毒性以內的肝功能水平進行ICIs治療;當發生肝臟irAEs,ALT/AST升高超過基線50%,并持續1周以上時,則須永久停止ICIs治療。
值得注意的是,肝細胞肝癌患者使用ICIs后的irAEs發生率增高可能與患者的肝病基礎有關,如肝硬化、病毒性肝炎等[29],目前各大指南對此均無針對性的指導建議。CheckMate 040研究中,nivolumab治療肝細胞肝癌患者,肝臟毒性的發生率為31%,中位發生時間為6周,3級以上肝臟毒性發生率為14.5%,中位發生時間為2.1周,大多數患者經治療后緩解[1]。CSCO指南結合我國合并病毒性肝炎(HBV/HCV感染)患者較多的現狀,指出需將HBV-DNA控制在2 000 U/mL以下再開始ICIs治療,并定期監測;對于HCV感染患者,指南沒有推薦在進行ICIs治療的同時進行核苷類似物或干擾素的治療,但需定期監測HCV-RNA水平的變化。
總體來說,ICIs引起的肝臟損傷預后較好,患者較少發生肝功能衰竭及死亡,通常在治療后1~3個月肝功能可恢復至基線水平。2級肝臟毒性好轉后可恢復ICIs治療;3級以上肝臟毒性患者經治療好轉后,CSCO指南建議謹慎嘗試重啟ICIs治療,但存在再次發生嚴重肝臟不良事件的可能,需要充分評估可能的風險和生存獲益,國外指南均建議永久停用ICIs治療。此外,接受一種類型ICIs治療后出現毒性者(如ipilimumab),可考慮接受另一種類型的ICIs治療(如nivolumab),此時并不一定會再次出現肝臟毒性,但不建議換用同一類型的ICIs(如PD-1抑制劑換用為PD-L1抑制劑)。
5 小結及展望
隨著ICIs在腫瘤治療領域廣泛應用,irAEs的出現也越來越受到臨床醫師的重視[30]。肝臟是重要的藥物代謝及消化器官,可有原發和繼發腫瘤的累及,在ICIs治療過程中,肝臟不良事件是值得關注的重要事件。定期監測肝功能,有助于早期識別irAEs。鑒別肝功能異常的原因,排除肝內腫瘤進展引起的肝功能異常、病毒感染或再激活、其他抗腫瘤藥物引起的肝臟損害和基礎肝病的惡化,有助于明確ICIs引起的肝毒性,從而指導治療。各大指南在肝臟irAEs的管理上基本達成共識,但對肝細胞肝癌或有基礎肝病的患者仍缺乏有針對性的管理策略。皮質類固醇治療,是應對肝臟irAEs的有效手段,大多數患者經治療后肝功能可以恢復。但對于免疫相關肝臟不良反應的早期預測指標、早期快速診斷以及個體化管理等問題,有待于建立國際性的登記系統,收集真實世界的irAEs數據來進一步解決。

