不可手術切除的肝轉移癌行50Gy/10f分割模式立體定向放療療效評估
盧振國, 孫君碟, 向作林, 盧 欣, 王愛華, 袁 駿
同濟大學附屬東方醫院腫瘤放射治療科,上海 200120
肝臟是各類惡性腫瘤中最常見的遠處轉移臟器之一。25%~30%消化系統腫瘤患者在發病時即有肝轉移或隨著疾病發展出現肝轉移,尤其在結直腸癌患者中更為常見。肝轉移病灶的首選治療方式是手術切除,而未經治療的肝轉移患者1年總生存率<30%,5年總生存率<5%[1-2]。然而,70%~90%的肝轉移癌是不可切除的,需要一種安全有效的替代治療方案[3]。立體定向放療(stereotactic body radiotherapy,SBRT)可使腫瘤局部受到高劑量照射,同時確保周圍正常組織僅受到較低劑量照射,已被廣泛應用于各類實體瘤的治療中。
SBRT技術對肝轉移癌的治療取得較好療效[4-5]。現回顧性分析同濟大學附屬東方醫院腫瘤放射治療科收治的28例不可手術切除的肝轉移癌患者采用SBRT的治療情況,并將初步結果報告如下。
1 資料與方法
1.1 研究對象 選取2018年3月至2019年11月同濟大學附屬東方醫院收治的肝轉移癌患者28例。納入標準:(1)原發腫瘤均由病理明確診斷;(2)所有肝轉移灶若無法取得病理診斷,均需CT、MRI或PET/CT及血液學檢查結果證實為肝轉移;(3)因病期太晚、無法耐受手術、拒絕手術等原因無法行肝轉移灶手術治療。排除標準:(1)Karnofsky(KPS)評分<70分;(2)有其他嚴重內科疾病;(3)丙氨酸轉氨酶(alanine aminotransferase, ALT)、天冬氨酸轉氨酶(aspartate aminotransferase, AST)大于正常值上限5倍以上;(4)肝轉移灶曾接受過任何方式的放療;(5)肝轉移灶接受的放療分割模式不是50Gy/10f。本研究經同濟大學附屬東方醫院倫理委員會批準,所有患者均知情且簽署知情同意書。
1.2 治療方法 所有患者均采用仰臥位,真空袋固定,采用4D-CT或呼吸門控技術進行CT模擬定位,圖像掃描層厚為2.5 mm。根據不同的CT模擬定位方式勾畫影像資料顯示的肝轉移灶,分別命名為內靶區(internal target volume, ITV)或腫瘤區(gross tumor volume,GTV)。采用4D-CT掃描在最低密度投影的CT圖像上勾畫ITV,或采用呼吸門控技術直接在CT圖像上勾畫GTV,靶區勾畫均同時參考MRI或PET/CT的影像資料。在ITV或GTV的基礎上外擴3~5 mm形成計劃靶區(planning target volume,PTV)。所有患者均使用瓦里安公司(美國)的EDGE直線加速器進行治療,治療計劃由Eclipes 13.5軟件系統優化完成。采用6 MV的X射線,非均準模式(flattening filter free,FFF),容積調強技術或適形調強技術,采用50Gy/10f的分割模式,處方劑量50 Gy的98%等劑量線覆蓋PTV體積的90%以上,100%等劑量線完全覆蓋ITV或GTV。每次治療前采用錐形束CT(cone beam computed tomography,CBCT)確認患者的擺位誤差在允許范圍內再開始治療。
1.3 臨床評價及隨訪 根據RECIST標準[6]評價患者肝轉移灶的局部反應情況。局部進展定義為治療病灶大小增加超過20%和/或在目標治療部位出現1個或多個病灶,局部控制定義為治療病灶消失、縮小或治療病灶大小增加少于20%。局部控制:局部控制時間為自放療開始至該病灶局部進展;生存期為自放療開始至隨訪截止日(2018年3月20日至2020年1月20日)或患者死亡日期。根據CTCAE 4.0[7]評估患者治療的不良反應。放療后根據患者情況定期隨訪,隨訪中行腹部B超、CT、MRI或PET/CT及血液學檢查,了解病灶變化情況及不良反應情況。
1.4 統計學處理 采用SPSS 22.0軟件進行Kaplan-Meier法計算局部控制率和總生存率,繪制生存曲線。檢驗水準(α)為0.05。
2 結 果
2.1 一般資料分析 結果(表1)顯示:共納入28例肝轉移癌患者,年齡36~85歲(中位年齡62歲),男性18例,女性10例。原發腫瘤位于消化系統23例,位于肺、乳腺、鼻咽、卵巢、膀胱各1例,共51個肝轉移病灶。4例原發腫瘤患者未行手術治療(原發部位分別為鼻咽、結腸、膽管、肺)。89.2%患者接受過化療,42.9%患者接受過靶向治療,僅1例患者接受過免疫治療。

表1 28例肝轉移癌患者一般資料分析
2.2 局部控制情況 結果(圖1)表明:所有患者3個月的局部控制(local control,LC)率為100%,6個月的LC率為97.1%,1年和1年半的LC率均為92.2%。患者行SBRT治療前后是否接受過化療、靶向治療、免疫治療對局部控制率的影響差異無統計學意義。
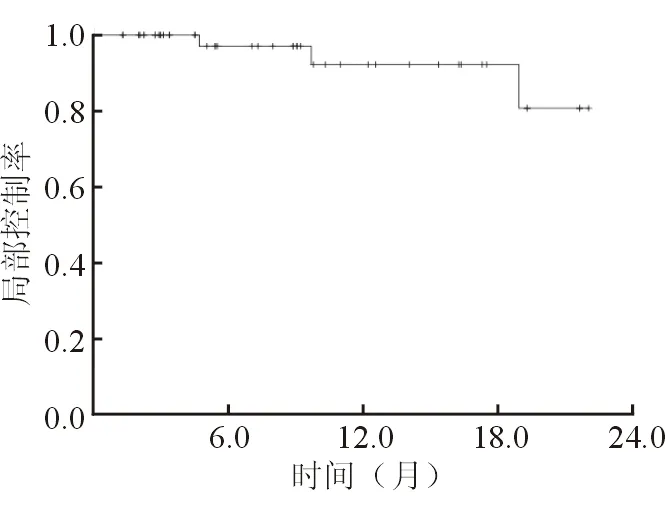
圖1 28例肝轉移癌患者局部控制情況
2.3 生存情況 結果(圖2)顯示:截至本研究結束,未達中位生存時間,所有患者3個月的總生存率(overall survival,OS)為100%,6個月的OS為95.0%,1年的OS為70.1%,1年半的OS為58.4%。患者行SBRT治療前后是否接受過化療、靶向治療、免疫治療對總生存率的影響差異無統計學意義。
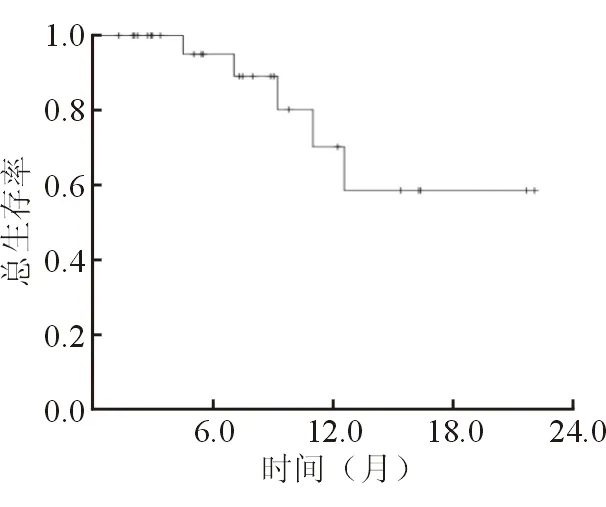
圖2 28例肝轉移癌患者Kaplan-Meier法生存曲線
2.4 不良反應 結果(表2)顯示:所有患者均順利完成全程放療,總體不良反應的發生率很低,所有患者均未出現Ⅲ級以上的不良反應。
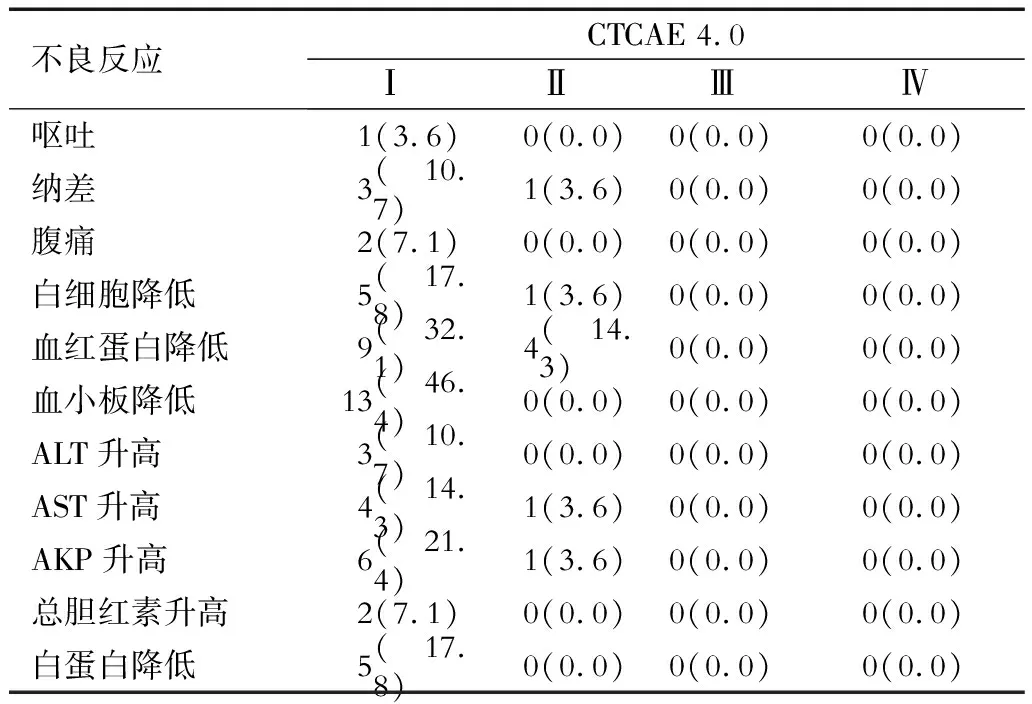
表2 28例肝轉移癌患者主要不良反應 n(%)
2.5 隨訪情況 28例患者均順利完成治療,中位隨訪期為7.4(1.3, 22.0)個月,隨訪率為100%。
3 討 論
近30年來,肝轉移癌的局部治療已成為常規治療方法。目前公認的肝轉移病灶的最佳治療方式是手術切除,手術治療的5年總生存率可達35%,而姑息治療僅5%[8]。Creasy等[9]報道的經選擇的結直腸癌肝轉移患者的手術治愈率達20%。但是不可手術切除的肝轉移癌的綜合治療包括全身和介入化療、分子靶向治療及針對肝臟病灶的局部治療[10]。這些局部治療手段包括射頻消融、微波消融、經動脈化療栓塞、放療、冷凍消融和乙醇注射等[11]。通常射頻消融是最常用的替代方案,但是與SBRT相比,兩者在原發性肝細胞肝癌的治療中療效相當,而對于轉移性肝腫瘤,SBRT療效更佳[12]。而且目前射頻消融術的適應證僅限于遠離重要危及器官的相對較小腫瘤。
早期研究[13-14]結果顯示,全肝放療可能導致放射性肝病。迄今為止,除了使用類固醇或利尿劑保守治療外,放射性肝病尚無有效的治療方法,相當一部分出現放射性肝病的患者會死于肝衰竭。這就限制了放療劑量的提高,使治療達不到理想效果。但是隨著放療計劃軟件的改進,呼吸門控、4D-CT模擬定位技術及圖像引導技術的出現與發展,使得SBRT技術得以開展。
本研究所有病例1年的局部控制率為92.2%,1年的總生存率為70.1%,Ⅲ級以上的不良反應為0。大量研究[15]報道,原發性肝癌或肝轉移癌患者經SBRT治療后,1年的局部控制率為49.8%~96.0%,1年的總生存率為63%~95%,Ⅲ級以上的不良反應為0~48%。故本研究療效不劣于國外研究結果。在RTOG 0438研究[16]中,以50Gy/10f的分割模式治療肝轉移癌患者的中位生存期為22.3(9.7,47.1)個月,且均未發生劑量限制性不良作用,證明50Gy/10f的分割模式是可行和安全的。由于隨訪時間較短,本研究暫無2年局部控制率和總生存率的數據。而肝轉移癌患者姑息治療1年的總生存率約為20%。本研究中不少患者同時伴有肝外其他部位轉移或肝內多發轉移,完全沒有手術或射頻消融的機會,在沒有明顯增加患者放療不良反應的情況下,局部控制率和總生存率仍較高。本研究病例在接受肝轉移灶SBRT治療前后有不同比例的患者接受過化療、靶向治療、免疫治療,然而這些治療對患者的局部控制率或總生存率的影響差異無統計學意義。這可能是因為本研究病例數偏少,隨訪時間較短。進一步將設計前瞻性、多中心的臨床研究以驗證本研究結論及其他相關治療對患者的局部控制率、總生存率的影響。
綜上所述,采用直線加速器實施50Gy/10f分割模式的SBRT技術治療肝轉移癌患者可取得較高的局部控制率和總生存率,是不可手術患者或不適合進行其他局部治療患者的很好的可替代方案。此外,SBRT聯合靶向、免疫等治療手段也有可能提高療效,尤其是SBRT與免疫治療有明顯的協同作用[17-20]。但兩者如何結合可達到最佳效果,還需要更多的前瞻性、多中心的臨床研究來驗證。

