經血源性間充質干細胞的分離培養與鑒定
余柯達 毛佳婷 師帥 鄒立波 劉鴻 江文嬌
間充質干細胞(MSCs)來源于胚胎發育的中胚層,具有自我更新和多向分化潛能等特點,在再生醫學和組織工程研究方面具有廣闊的應用前景[1]。MSCs幾乎存在于所有的器官和組織中。自1957年Mcculloch等[2]首次從骨髓中發現MSCs,研究者們先后又從脂肪、臍帶、牙髓等組織中發現MSCs。目前MSCs已經應用于神經系統損傷[3]、糖尿病[4]、心臟疾病[5]和衰老虛弱[6]等多種疾病的治療研究。經血中含有出血時脫落的子宮內膜碎片,子宮內膜在女性身體中每月更新,表明其中具有高度增殖能力的干細胞。Meng等[7]首次從女性經血中分離得到子宮內膜來源的MSCs,即經血源性間充質干細胞(MenSCs)。其具有來源廣,取材易,無創獲得的優點,且來源于人體廢棄物,避免倫理問題。作者對MenSCs形態、增殖、鑒定和體外分化進行研究,從而解決再生醫學和組織工程的理論和臨床應用中的種子細胞來源問題。
1 材料和方法
1.1 材料 (1)經血來源:選擇20~30歲健康女性志愿者,其月經規律,月經量正常,臨床檢查無生殖器畸形和內分泌疾病。志愿者于月經第2天用月經杯收集經血5ml。(2)主要試劑:1.073g/L Ficoll分離液購自美國SIGMA公司;DMEM/12培養基、胰酶、胎牛血清、青霉素-鏈霉素混合液購自美國GIBCO公司;抗人CD73 PE、CD90 PITC、CD105 PE、CD19 APC、CD45 PITC、CD34 PE、CD14 APC抗體購自美國BD公司。實驗時間2019年11月至2020年4月。
1.2 方法 (1)細胞分離培養:將收集的經血與等體積PBS(含1%青霉素-鏈霉素)混合,4℃保存,在24h內送至實驗室。用Ficoll密度梯度離心法分離MenSCs,將經血樣本吹打混勻,置于等體積Ficoll分離液上層,1800r/min離心25min,取離心后的中間細胞層,用PBS洗滌2次,再用含10% FBS的DMEM/F-12培養基重懸細胞,接種于6孔培養板中,置于37℃、5% CO2濃度、飽和濕度下常規培養,待細胞貼壁集落形成記為P0,細胞密度達90%,消化傳代。(2)繪制生長曲線:取生長良好的MenSCs,消化離心后將細胞重懸成密度為2×107個/L單細胞懸液,96孔板中每孔接種100μl,置于37℃、5% CO2濃度、飽和濕度下培養。在1、3、5、7、9d的固定時間向各孔中加入10μl CCK-8溶液孵育4h后,測定450nm波長的吸光度。(3)細胞表面標志物檢測:取生長良好的MenSCs用0.25%胰酶消化,PBS漂洗2遍,再用PBS制成1×106個/L單細胞懸液,在待測樣本中各加入CD73 PE、CD90 PITC、CD105 PE、CD19 APC、CD45 PITC、CD34 PE和CD14 APC抗體1μl,同時以PBS作為空白對照。避光室溫孵育30min,PBS洗2遍,1300r/min離心5min,用PBS重懸細胞,流式細胞儀檢測。(4)成脂誘導分化:根據試劑盒說明書的方法進行。收集生長良好的第三代MenSCs進行體外成脂誘導分化,接種MenSCs(4×104個/孔)于12孔板中培養6h后,更換培養液為成脂誘導分化培養液,換液1次/3~4d,連續培養14d,用4%多聚甲醛固定,再加入油紅O染色。
2 結果
2.1 MenSCs的形態特征 原代分離的細胞24h后可觀察到少量不規則形、多邊形或多角形貼壁細胞,72h后全量換液,棄去雜質細胞。12~14d后原代細胞(P0)貼壁成單層,傳代后為P1代細胞(見圖1)。隨著傳代次數的增多,細胞種群逐漸同類化,多數細胞呈紡錘狀,排列呈漩渦狀且成簇,表現出典型的MSCs特征。

圖1 MenSCs(A:P0,B:P1)的形態特征(比例尺:100μm)
2.2 MenSCs的生長曲線 經血來源的干細胞增殖能力(見圖2),第1~3天細胞緩慢增長,為生長期的潛伏期,第3 天開始細胞增殖進入對數生長期,快速增長,第5 天后對數增殖期結束進入緩慢增長期。
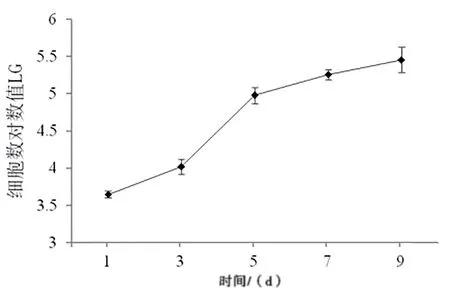
圖2 MenSCs的生長曲線
2.3 細胞表面分子標志物檢測 經血來源的干細胞表面分子標志物表達情況,流式細胞術鑒定表明細胞高表 達CD73、CD90和CD105,低 表 達CD14、CD34、CD45及CD19,符合MSCs表面分子標志物表達標準。見圖3。

圖3 MenSCs表面分子標志物鑒定
2.4 MenSCs成脂誘導分化 經血來源干細胞的成脂誘導分化情況(見圖4),利用MSCs誘導培養基定向誘導經血來源的干細胞,結果可見,成脂誘導后,鏡下可見透明圓形脂滴亮點,油紅O染色為陽性。

圖4 MenSCs成脂分化實驗
3 討論
人類的子宮內膜在女性一生中至少要經歷400個增殖、分化和脫落周期,是一種活力強盛不斷更新的組織[8]。子宮內膜組織的厚度可在4~10d內從0.5mm增長至5~7mm,其生長水平與表皮、腸上皮及造血系統等高度再生組織中的細胞更替速度相當,甚至更快。在高度再生組織中,成體干細胞通過分化補充損失的細胞,以維持組織的穩態[9]。以上結果表明在子宮內膜中可能存在具有高度增殖分化能力的成體干細胞。2007年Meng等[7]從女性經血中分離得到子宮內膜來源的MSCs,即MenSCs。目前國外研究發現MenSCs具有非常強的自我更新和多向分化能力,在生殖、免疫、心血管、消化和神經等系統和代謝疾病方面具有初步的研究進展[10]。MenSCs來源于經血,可以有規律的不斷從同一女性志愿者中獲取具有相同遺傳背景的MSCs,為MSCs的理論研究和臨床應用提供了便利。本研究結果表明,經血經Ficoll密度梯度離心法可以分離得到大量的貼壁生長的紡錘狀細胞。生長曲線顯示,在經歷3d短暫的潛伏期后,其可以迅速進入對數生長期,表明細胞活力強。對分離得到的細胞表面標志物檢測結果表明,CD73、CD90和CD105為陽性表面標志物,CD14、CD34、CD45和CD19為陰性表面標記物,CD34、CD45表達陰性表明其為非造血性細胞,與Meng等[7]對MenSCs表面分子標志物檢測結果一致,符合MSCs表面分子標志物表達標準。多向分化潛能也是判斷MSCs的條件之一,體外誘導分化實驗表明本研究分離得到的細胞可向脂肪細胞分化。以上結果符合國際細胞治療學會提出的MSCs鑒定標準[11],可以判定本研究分離得到的貼壁生長的紡錘狀細胞是MenSCs。
綜上所述,MenSCs可以從健康女性經血中分離得到,其具有MSCs常規的細胞表面標志物和相應的生物學特性,表明本研究初步成功地建立一種簡單可行的MenSCs分離培養方法。MenSCs具有來源廣泛、取材方便、無創取材、無倫理道德問題等優點,且增殖迅速,具有多向分化潛能,證明其是開展再生醫學和組織工程研究更理想的種子細胞。本研究為下一步利用MenSCs進行人類組織工程學研究奠定了實驗基礎。

