種薯/土壤帶菌對馬鈴薯生長及其干腐病發生的影響
郭成瑾,楊 波,王喜剛,沈瑞清
(1.寧夏農林科學院植物保護研究所/寧夏植物病蟲害防治重點實驗室,銀川 750002; 2.寧夏農墾農林牧技術推廣服務中心,銀川 750021)
0 引 言
【研究意義】馬鈴薯是繼稻谷、玉米和小麥之后的第4大主糧作物,營養價值高、適應能力強、產量高[1]。寧夏位于我國西北地區,氣候冷涼,日照充足,適宜種植馬鈴薯生長。近幾年,重茬以及種薯調運等問題,馬鈴薯上各種病害逐年加重,已成為制約寧夏馬鈴薯產業發展的重要因素之一[2]。馬鈴薯干腐病(Potato dry rot)是馬鈴薯生長期和窖藏期的重要病害,自播種后可造成爛芽爛種現象,出苗延遲,至后期病害嚴重度增加,直接影響植株的生長甚至造成死亡,窖藏期是該病害發病的主要時期[3-4]。據報道,寧夏馬鈴薯主要種植區干腐病常年發病率達50%[5],由于該病屬于土傳病害,防治較為困難,嚴重影響著馬鈴薯的產量和品質。【前人研究進展】馬鈴薯干腐病是由鐮刀菌(Fusariumspp.)引起的一種真菌性病害。據統計,我國有22種鐮刀菌可引起該病害[6],其中國內外報道最多的致病鐮刀菌是茄病鐮刀菌(F.solani)和接骨木鐮刀菌(F.sambucinum)[7-12],該類鐮刀菌主要在土壤或病殘體組織中以分生孢子或菌絲體的形態越冬,以分生孢子完成初侵染和再侵染[13]。據報道,種薯切塊后沒有愈合的傷口是病原菌主要的侵染途徑,種薯帶菌和土壤帶菌均可侵染未愈合的馬鈴薯傷口,導致馬鈴薯干腐病的發生[14]。針對馬鈴薯干腐病的防治,生產上多以窖藏期進行藥劑防治為主[15-16],可降低馬鈴薯干腐病進一步感染,減輕馬鈴薯窖藏爛損度。但窖藏期藥劑防治僅能緩解馬鈴薯干腐病發病程度,無法從根本上預防和控制病害發生。播前藥劑拌種是防治馬鈴薯病害侵染的關鍵措施之一,已用于防治馬鈴薯晚疫病[17]、馬鈴薯瘡痂病[18]、馬鈴薯黑痣病[19]等。據報道,代森錳鋅[20]或與甲基硫菌靈、氟酰胺混合使用[21]進行播前拌種對防治馬鈴薯干腐病具有防治效果。Wharton等[22]研究表明,將咯菌腈和代森錳鋅混合在播種前10 d對種薯進行處理,可有效控制致病鐮刀菌引起的種薯腐爛和苗期芽腐。【本研究切入點】從病害流行角度看,哪種侵染方式對馬鈴薯生長及干腐病發生影響較大,目前未見報道。而國內關于防治馬鈴薯干腐病進行種薯藥劑拌種的使用效果報道較少。研究種薯/土壤帶菌對馬鈴薯生長及其干腐病發生的影響。【擬解決的關鍵問題】研究通過田間試驗以種薯帶菌和土壤帶菌兩種侵染方式,采用藥劑拌種和不拌種處理,測定馬鈴薯出苗、株高等指標,調查窖藏后子代馬鈴薯薯塊干腐病發病率和病情指數,分析種薯/土壤帶菌對馬鈴薯生長及干腐病發生的影響,評估藥劑拌種對病害的控制效果,為寧夏馬鈴薯干腐病綜合防治技術提供理論依據。
1 材料與方法
1.1 材 料
供試病原菌:茄病鐮刀菌和接骨木鐮刀菌(分離自寧夏固原市西吉縣,菌株編號N-54-1和N-26-1,保藏于寧夏農林科學院植物保護研究所植物病理室)。
試驗基地:寧夏固原市西吉縣新營鄉。
培養基:PDA培養基:馬鈴薯200 g、葡萄糖20 g、瓊脂12 g、蒸餾水1 000 mL;PDB培養基:葡萄糖20 g、馬鈴薯200 g、蒸餾水1 000 mL;玉米粉稻殼麥麩培養基∶稻殼∶麥麩:玉米粉=1.5∶6∶2.5,水適量。
鐮刀菌菌懸液:將供試鐮刀菌在PDA培養基上25 ℃恒溫培養5 d,在超凈工作臺上用無菌打孔器打取菌餅,將打好的菌餅用接種針挑到盛有125 mL PDB培養液的150 mL三角瓶中,每瓶接菌餅10個,放至搖床上震蕩培養7 d后,用血球計數板測定孢子濃度,待用。
鐮刀菌擴繁物:將玉米粉稻殼麥麩培養基配制好后,121 ℃下濕熱滅菌50 min,取出放入超凈工作臺上晾干,倒入培養好的鐮刀菌菌懸液,攪拌均勻,分裝于滅菌盤中蓋上無菌報紙,放入溫度為26℃,濕度為80%的培養箱中培養7 d。
主要試驗儀器:搖床、LE204E/02電子天平(梅特勒-托利多儀器有限公司)、TOMY SX-500高壓滅菌器(上海麥森醫療科技有限公司)、無菌操作臺、SPX-250生化培養箱(上海躍進醫療器械有限公司)等。
1.2 方 法
1.2.1 種薯處理
試驗設4個處理,每個處理3次重復。事先用25%嘧菌酯懸浮劑稀釋1 500倍,裝入噴霧器中均勻噴灑在試驗田馬鈴薯播種溝內,進行土壤消毒。處理1(T1-1):將混合菌懸液噴灑在切好的馬鈴薯種子上,混勻,使菌液與種薯表面充分接觸;處理2(T1-2):種薯事先按照處理1方法接種混合菌懸液,待種薯陰干后,按20 mL 2.5%咯菌腈對150 mL清水稀釋拌25 kg種薯,再次進行拌種;處理3(T1-3):按20 mL 2.5%咯菌腈對150 mL清水稀釋拌25 kg種薯;對照(T1-4):種薯不做任何處理。所有處理陰干后播種。
1.2.2 土壤處理
接種體設3個濃度梯度:50 g(混合鐮刀菌擴繁物)/10 kg(土壤)、100 g/10 kg、150 g/10 kg;設藥劑拌種(20 mL 2.5%咯菌腈對150 mL清水稀釋拌25 kg種薯)和不拌種兩個處理。試驗設8個處理,每個處理3次重復。處理1(T2-1):將制備好的接種體按50 g/10 kg混入土壤中,混勻,均勻的撒于播種壟溝內,然后播種不拌種的種薯;處理2(T2-2):將制備好的接種體按100 g/10 kg接入土壤中,其余同處理1;處理3(T2-3):將制備好的接種體按150 g/10 kg接入土壤中,其余同處理1;處理4(T2-4):將制備好的接種體按50 g/10 kg接入土壤中,按20 mL 2.5%咯菌腈對150 mL清水稀釋拌25 kg種薯后進行播種;處理5(T2-5):將制備好的接種體按100 g/10 kg接入土壤中,其余同處理4;處理6(T2-6):將制備好的接種體按150 g/10 kg接入土壤中,其余同處理4;處理7(T2-7):播種溝內不做處理,播種不拌種的種薯;處理8(T2-8):播種溝內不做處理,播種藥劑拌種的種薯。
“回溯人類歷史進程,不難發現,任何時候都能夠找到懼怕變革的人,”他說,“當我還是個孩子的時候,我還常常聽到老人抱怨拖拉機。”
1.2.3 馬鈴薯植株生長性狀
馬鈴薯播種時調查每個小區的播種數,播種50 d后調查出苗數,計算出苗率;在馬鈴薯開花期用卷尺測定株高(莖基部到生長點),游標卡尺測定莖粗(主莖基部),目測法數分枝數。每個小區隨機3點,每點5株。
1.2.4 發病情況
收獲時每個小區隨機5點,每點5株,將挖出的薯塊用馬鈴薯專用袋分裝,放入窖中,窖藏8周后調查各處理馬鈴薯薯塊發病個數及發病級數,計算馬鈴薯干腐病發病率和病情指數。
1.2.5 馬鈴薯塊莖發病分級標準
馬鈴薯干腐病分級標準[11]:0級,薯塊無病斑;1級,病斑面積占薯塊的5%以下;2級,病斑面積占薯塊的6%~15%;3級,病斑面積占薯塊的16%~30%;4級,病斑面積占薯塊的31%~50%;5級,病斑面積占薯塊的50%以上。
1.2.6 計算公式
出苗率=(出苗數/播種數)×100%;發病率=(發病塊莖數/調查塊莖數)×100%;病情指數=∑[(各級病薯數×相對級數值)/(調查總薯數×5)]×100。
1.3 數據處理
試驗數據采用Microsoft Office Excel 2010軟件進行處理,利用統計軟件DPS 3.1 Duncan新復極差法進行差異顯著性分析(P<0.05)。
2 結果與分析
2.1 種薯處理對馬鈴薯生長性狀的影響
研究表明,不同種薯處理對馬鈴薯生長性狀有一定的影響。出苗率以處理T1-3和T1-4最高,分別為96.44%和96.22%,兩處理間差異不顯著,顯著高于其他處理;株高和莖粗均以處理T1-3最高,分別為74.89 cm和1.73 cm,顯著高于其他處理;分枝數以處理T1-3最高,為2.45,與其他處理差異不顯著。種薯經藥劑拌種后不影響馬鈴薯出苗,促進馬鈴薯生長;而播前非藥劑拌種處理的種薯帶菌影響馬鈴薯出苗,阻礙馬鈴薯生長。表1
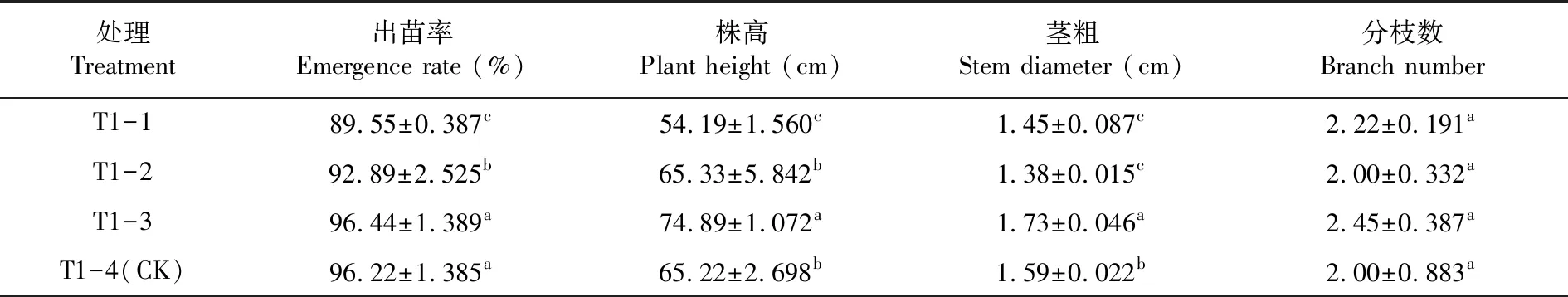
表1 不同種薯處理下馬鈴薯生長性狀變化Table 1 Effects of different seed potato treatments on potato growth
2.2 種薯處理對馬鈴薯干腐病發病的影響
研究表明,處理T1-1的病薯數、發病率和病情指數均最高,分別為8.95個、34.00%和20.64,顯著高于其他處理。而處理T1-3病薯數、發病率和病情指數均最低,分別為2.75個、12.33%和4.59,病薯數和發病率均顯著低于其他處理,病情指數顯著低于處理T1-1和T1-2,與處理T1-4差異不顯著。種薯在播種前藥劑拌種,能很好的控制馬鈴薯干腐病的發生,種薯帶菌干腐病發病顯著高于種薯藥劑拌種。表2
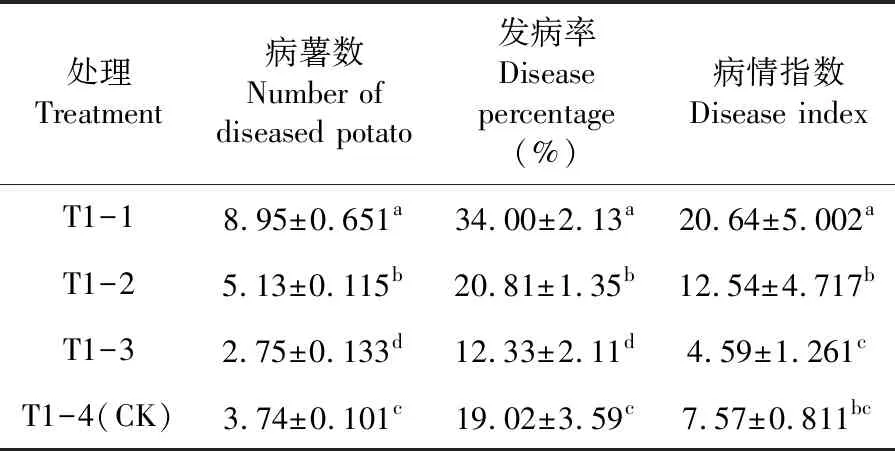
表2 不同種薯處理下馬鈴薯干腐病發病變化Table 2 Effects of different seed potato treatments on pathogenesis of potato dry rot
2.3 土壤處理對馬鈴薯生長性狀的影響
研究表明,不同土壤處理對馬鈴薯生長性狀也有一定的影響。處理T2-8的出苗率、株高和莖粗均最高,分別為96.88%、76.12 cm和1.84 cm,其次是處理T2-7,出苗率、株高和莖粗分別為95.00%、71.86 cm和1.72 cm,兩處理間差異不顯著,處理T2-8出苗率、株高和莖粗顯著高于其余處理;分枝數以處理T2-5最高,為2.89個,顯著高于處理T2-3、T2-4和T2-6,與其余處理差異不顯著。土壤帶菌均影響馬鈴薯生長,尤其降低馬鈴薯出苗率、株高和莖粗等指標;種薯藥劑拌種處理的馬鈴薯生長指標高于種薯不拌種處理所對應生長指標值。表3
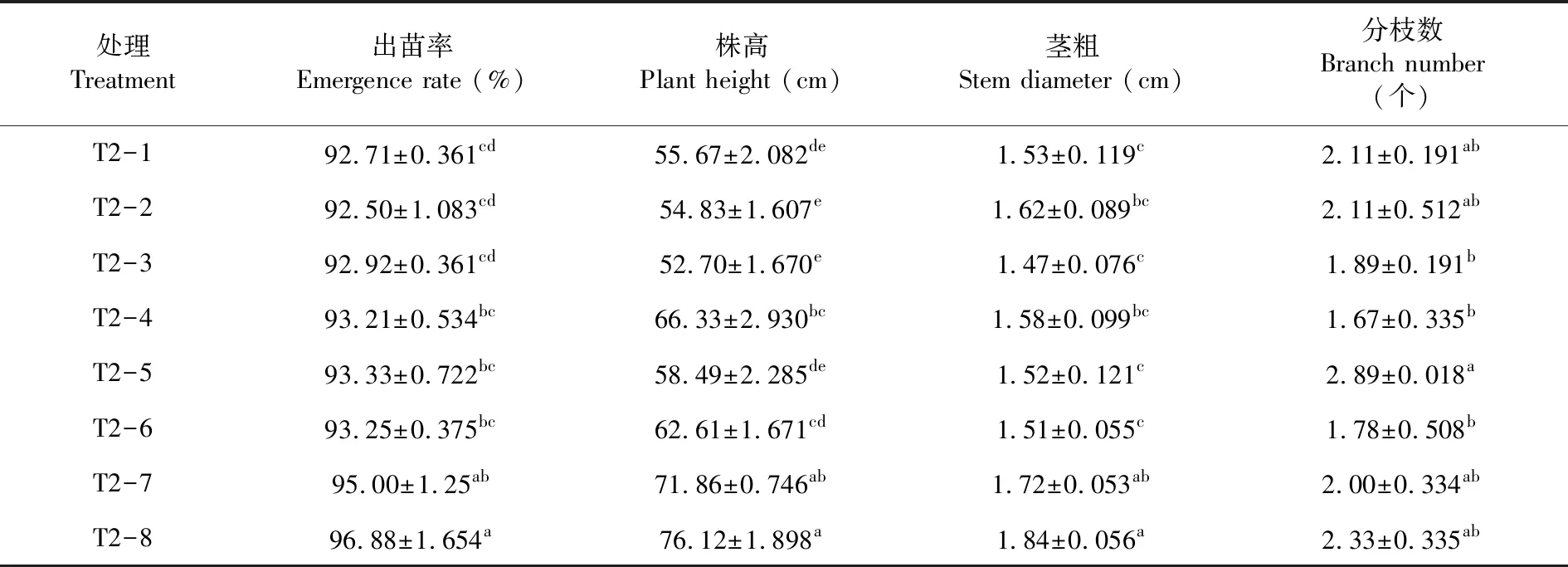
表3 不同土壤處理下馬鈴薯生長性狀變化Table 3 Effects of different soil treatments on potato growth
2.4 土壤處理對馬鈴薯干腐病發病的影響
研究表明,不同土壤處理對馬鈴薯干腐病發病情況有一定的影響。處理T2-3的病薯數、發病率和病情指數均最高,分別為6.95個、27.09%和18.74,其次是處理T2-6,病薯數、發病率和病情指數分別為6.22個、21.46%和13.03,兩處理間差異不顯著。而處理T2-8和T2-7病薯數、發病率和病情指數均最低,顯著低于處理T2-3和T2-6。隨著土壤帶菌量的增加,馬鈴薯干腐病病薯數、發病率和病情指數均呈遞增趨勢;種薯藥劑拌種處理的馬鈴薯干腐病發病低于種薯不拌種處理。表4
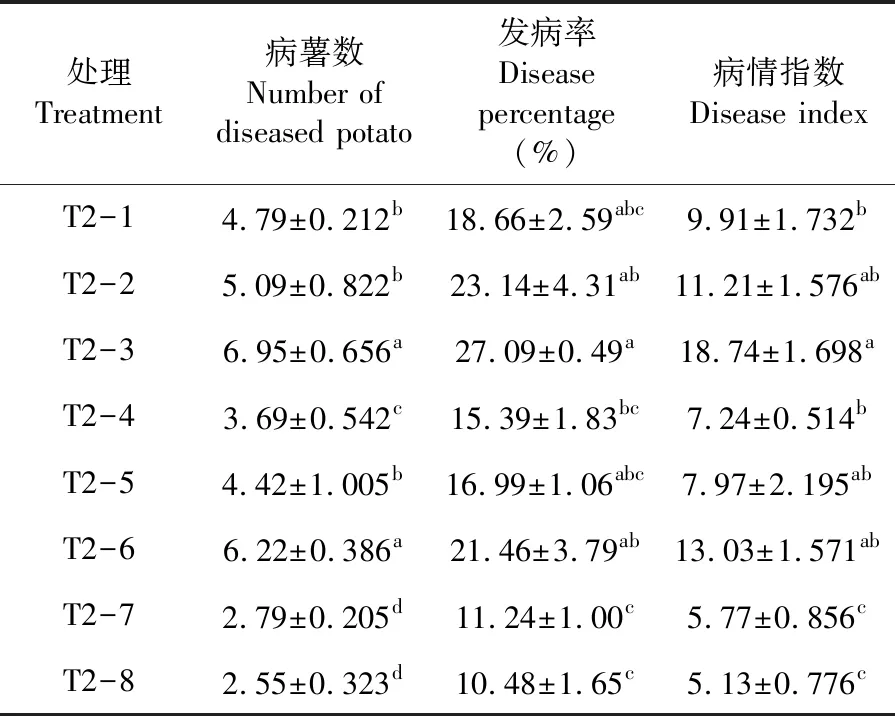
表4 不同土壤處理下馬鈴薯干腐病發病變化Table 4 Effects of different soil treatments on pathogenesis of potato dry rot
2.5 窖藏期病薯上病原物的分離鑒定
對試驗病薯進行分級統計分析,將馬鈴薯干腐病發病程度分為6個等級,發病癥狀表現為,隨著病情發展,染病薯肉變褐腐爛,薯塊慢慢變干,僵縮、變輕,形成空心,濕度一定時,薯塊內部長滿白色的菌絲。
研究表明,將健康種薯接菌的發病薯塊進行病原菌再分離,通過分離獲得的鐮刀菌,形態學鑒定為茄病鐮刀菌和接骨木鐮刀菌,這兩種病原菌就是引起馬鈴薯干腐病的主要致病菌。圖1

注:0為健康薯塊;1~5分別代表不同等級的發病薯塊。Note: 0: Healthy potato; 1-5: Represent different grades of diseased potato tuber.圖1 窖藏期馬鈴薯薯塊發病癥狀Fig.1 Symptoms of potato tuber in cellar storage
3 討 論
鐮刀菌引起的馬鈴薯干腐病嚴重影響著馬鈴薯的品質。降低初侵染是防治馬鈴薯干腐病的主要措施之一。了解不同接種源對馬鈴薯干腐病發生的影響,將有助于病害防控。結果表明,種薯接菌引起的馬鈴薯干腐病遠高于土壤接菌各處理。這與Adams等[23]的研究結果一致,表明受病原菌浸染的種薯可導致馬鈴薯子代塊莖干腐病的發生和發展。而Heltoft等[24]研究表明,種子接菌處理均未引起子代塊莖發生干腐病,土壤接菌引發的子代塊莖干腐病腐爛情況相比對照嚴重。造成不同結果的原因可能與不同種類鐮刀菌的種子接菌和土壤接菌相對重要性存在差異有關。Adams等[23]研究表明,硫色鐮刀菌(F.sulphureum)更易從感染種薯傳播到子代塊莖,而Heltoft等[24]表明了受接骨木鐮刀菌侵染的土壤導致子代馬鈴薯感染干腐病更加嚴重。種薯帶菌對馬鈴薯子代感染干腐病程度高可能與馬鈴薯品種有關。Daami-Remadi等[25]研究突尼斯當地馬鈴薯品種對四種鐮刀菌敏感性比較表明,沒有一個品種對整個鐮刀菌類群具有完全抗性,禾谷鐮刀菌(F.graminearum)對大部分品種侵染性最強。Heltoft等[24]研究發現,接骨木鐮刀菌對挪威10個常見馬鈴薯品種最具侵染性,其中早熟品種干腐病癥狀最嚴重。Du等[3]研究表明,中國馬鈴薯種質資源對接骨木鐮刀菌具有中高度易感性。Bojanowski等[26]分析表明,目前尚未發現對所有致病鐮刀菌具有抗性的馬鈴薯品種。土壤帶菌作為馬鈴薯干腐病發病的另一個重要侵染來源,在國內的相關報道較少,邱甜等[27]在對馬鈴薯晚疫病的研究中發現,不同土壤處理對馬鈴薯晚疫病發病病級的影響具有顯著差異。研究顯示,土壤中攜帶的病原菌量的多少,直接影響馬鈴薯干腐病的發生。
研究表明,用咯菌腈進行播前拌種,不影響種薯出苗,馬鈴薯植株生長指標均高于未拌種處理,說明藥劑拌種具有促進馬鈴薯植株生長作用,這與任向宇[28]研究結果一致。同時,咯菌腈拌種處理子代薯塊馬鈴薯干腐病發病率和病情指數均低于未拌種處理,說明咯菌腈拌種對干腐病具有一定的防治效果,與楊春[29]對馬鈴薯枯萎病防治的藥劑拌種篩選結果一致。Bains等[30]研究表明,咯菌腈播前拌種主要是通過抑制病薯上致病鐮刀菌的傳播,從而降低子代薯塊被感染的風險。而劉小娟等[19]同樣用咯菌腈等藥劑拌種對馬鈴薯黑痣病進行田間防效試驗,結果表明咯菌腈拌種處理對黑痣病的防效沒有嘧菌酯等藥劑的防治效果好,說明咯菌腈拌種針對不同病害的防治,其防治效果存在明顯的差異。
不同種類鐮刀菌接種種薯和土壤,以及同一種鐮刀菌接種不同品種馬鈴薯對干腐病的發生均存在著差異。而研究僅是對已知致病鐮刀菌混合物接種進行試驗的,試驗研究較不全面。而品種抗性研究是病害防控的重要環節,下一步將進一步評估不同主栽品種和不同種致病鐮刀菌的種薯、土壤帶菌對馬鈴薯干腐病發生的影響。
4 結 論
種薯帶菌和土壤帶菌均可引起寧夏馬鈴薯產區干腐病的發生,其中種薯帶菌是主要的侵染因素;土壤帶菌量越多,干腐病發生越嚴重。將2.5% 咯菌腈懸浮劑20 mL對150 mL清水稀釋調制成藥液,噴灑在馬鈴薯薯塊表面,充分混勻,陰干后播種,可促進馬鈴薯植株生長,減少子代馬鈴薯干腐病的發生。

