芻議藥包材的異常毒性檢查和實驗動物福利
高保栓 康 莉 刁立琴 付 釗
(河北省醫療器械與藥品包裝材料檢驗研究院,石家莊 050061)
直接接觸藥品的包裝材料和容器(簡稱藥包材)按材質不同可分為塑料類、金屬類、玻璃類、陶瓷類、橡膠類和其他類(如紙、干燥劑)等,也包括由兩種或兩種以上的材料復合或組合而成的復合膜和鋁塑組合蓋等[1]。藥包材作為藥品的一部分,其本身的質量、安全性等對藥品質量、臨床使用安全性有著十分重要的影響。國家藥包材標準包括藥包材標準(YBB標準)和產品注冊標準(企業標準)。目前,塑料類、金屬類及復合膜等國家藥包材標準均規定了異常毒性檢查[2]。但是,發現在2015版YBB標準中異常毒性試驗方法有的增加了空白對照,有的未增加空白對照;甚至存在著許多企業注冊標準與相關的YBB標準不一致,國內各省的同類藥包材注冊標準不統一現象。顯然,增加空白對照試驗就意味著增加實驗動物的使用數量。如果沒有科學依據,就違背了實驗動物福利的“3R”(減少、替代、優化)基本原則[3-4]。因此,我們對于2015版YBB標準中異常毒性試驗設立空白對照的意義和必要性進行了探討,對于保障實驗動物福利及有效實施具有一定的積極意義。
1 對異常毒性的認識
1.1 異常毒性概念[1]
異常毒性有別于藥物本身所具有的毒性特征,是指由生產過程中引入或其他原因所致的毒性。
異常毒性檢查法系給予動物一定劑量的供試品溶液,在規定時間內觀察動物出現的異常反應或死亡情況,檢查供試品中是否污染外源性毒性物質以及是否存在意外的不安全因素。
1.2 異常毒性檢查法
試驗用動物:質量合格的動物,在試驗前及試驗的觀察期內均應按正常飼養條件飼養。做過本試驗的動物不得重復使用。
1.2.1 非生物制品試驗:《中華人民共和國藥典》[1]規定:除另有規定外,取(中國藥典未作規定,一般使用清潔級或SPF級動物試驗)小鼠5只,體質量18~22 g,每只小鼠分別(中國藥典未作規定,一般采用尾靜脈注射)靜脈給予供試品溶液0.5 mL。 應在4~5 s內勻速注射完畢。除另有規定外,全部小鼠在給藥后48 h內不得有死亡;如有死亡時,應另取體質量19~21 g的小鼠10只復試,全部小鼠在48 h內不得有死亡。試驗未規定設立動物空白對照。
1.2.2 生物制品試驗:《中華人民共和國藥典》[1]規定:除另有規定外,異常毒性試驗應包括小鼠試驗和豚鼠試驗,試驗中應設同批動物空白對照。按照規定的給藥途徑緩慢注入動物體內。小鼠試驗和豚鼠試驗均采用腹腔注射給藥法進行,要求在觀察期內,動物應全部健存,且無異常反應,到期時每只動物體質量應增加,判定供試品符合規定。
1.3 急性全身毒性和異常毒性的區別
1.3.1 概念:藥包材的急性全身毒性試驗系將一定劑量的供試品溶液由靜脈注入小鼠體內,在規定時間內觀察小鼠有無毒性反應和死亡情況,以判定供試品是否符合規定[5]。
1.3.2 急性全身毒性檢查法[5]:供試用(YBB00042003-2015未作規定,一般使用清潔級或SPF級動物試驗)小鼠,體質量17~23 g。將小鼠隨機分為試驗組和對照組,每組5只,放入固定器內,自尾靜脈分別注入供試品溶液和空白對照液,注射速度為0.1 m L/s,注射劑量為50 m L/kg體質量。注射完畢后,觀察小鼠即時反應,試驗后待觀察小鼠喂養方法同試驗前,并于 4、24、48、72 h觀察和記錄試驗組和對照組動物的一般狀態、毒性表現和死亡動物數,在72 h時稱量動物體質量。整個觀察期內,試驗組動物的反應不大于對照組動物,則判定供試品合格。
1.3.3 兩種毒性試驗法的區別:藥包材的急性全身毒性和異常毒性的區別見表1。

表1 藥包材兩種毒性試驗法的區別Table 1 Difference of two methods for toxicity test of pharmaceutical packaging materials
2 新舊藥包材標準在異常毒性檢查方面的變化
將新版國家藥包材標準(即2015版YBB標準)與原版YBB標準(國家食品藥品監督管L局2002~2006年陸續頒布的《直接接觸藥品的包裝材料和容器標準匯編》,共6輯)進行比較,發現部分品種的異常毒性試驗增加了空白對照,詳見表2~表5。
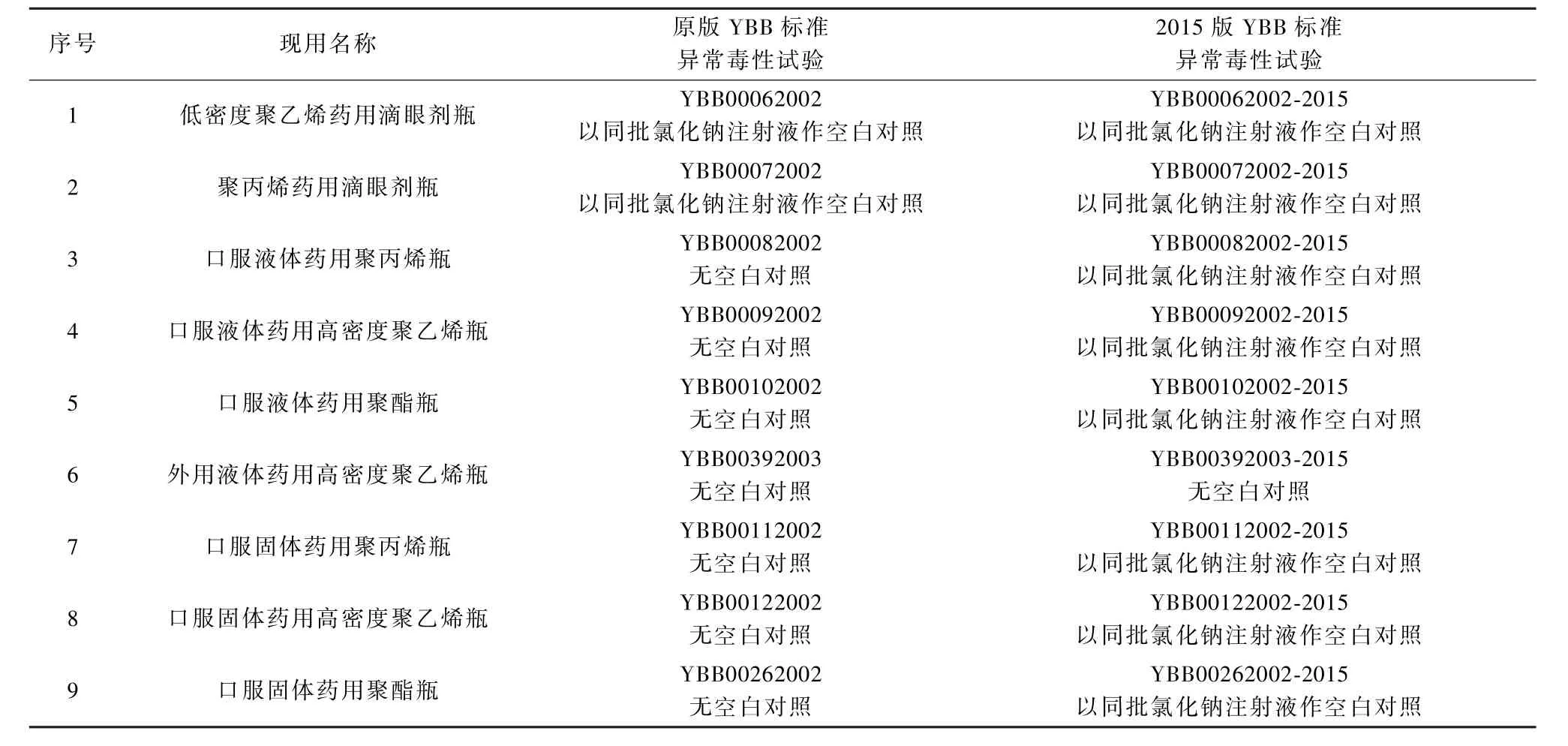
表2 塑料瓶類藥包材新舊標準的變化比較Table 2 Comparison of the changes of new and old standards for plastic bottls for pharmaceutical packaging

表3 金屬類藥包材新舊標準的變化比較Table 3 Comparison of the changes of new and old standards for metals for pharmaceutical packaging

表4 復合膜、硬片類藥包材新舊標準的變化比較Table 4 Comparison of the new and old standards for laminated films and sheets for pharmaceutical packaging

表5 鋁塑組合蓋類藥包材新舊標準的變化比較Table 5 Comparison of the changes of the new and old standards for aluminum-plastics combination caps for pharmaceutical packaging
3 討論
3.1 藥包材作為藥品的一部分[2],應屬于非生物制品。《中華人民共和國藥典》2015版四部異常毒性檢查法中非生物制品試驗并沒有規定設立空白對照。
3.2 由表2~表5可以看出,2015版YBB標準除了滴眼劑瓶和聚乙烯/鋁/聚乙烯復合藥用軟膏管原標準就有空白對照外,其他塑料瓶和復合膜類均新增加了空白對照,而藥用鋁箔和硬片類等卻沒有增加空白對照,甚至藥用低密度聚乙烯膜、袋未增加空白對照,與同材質的低密度聚乙烯藥用滴眼劑瓶原標準就有空白對照也不一致。
3.3 根據異常毒性的毒性特征,檢查的是藥包材樣品是否污染外源性毒性物質以及是否存在意外的不安全因素,關注的是否引起小鼠死亡,這是不同于急性全身毒性試驗的關鍵點。況且,眾所周知氯化鈉注射液是臨床輸液常用的生L鹽水,一般來說,不可能引起動物死亡。因此,增加以生L鹽水為動物空白對照必要性值得商榷。
近年來,國內外實驗動物福利的發展在很多領域令人可喜。早在1959年,英國動物學家威廉·拉塞爾和微生物學家雷克斯·伯奇就在《人道主義實驗技術原L》中提出L念:科學、合L、人道地使用實驗動物及鑒別和減少“非人道”的動物實驗。目前,已成為國際社會普遍認可的實驗動物福利“3R”基本原則,即替代(replacement)、減少(reduction)和優化(refinement)原則。為了規范實驗動物工作,保障實驗動物福利,據了解我國的《實驗動物福利法》現正在加緊制訂中。倡導“減少”“替代”“優化”的“3R”原則,更要求科學、合L、人道地使用實驗動物。作為從事實驗動物工作的人員,如何最大限度地保障實驗動物的福利,值得大家思考和關注!
針對藥包材的異常毒性檢查,如果不能科學、合L的安排試驗,隨意增加動物空白對照,直接增加了實驗動物小鼠的使用數量,顯然不符合“白對照原則。異常毒性試驗中沒有必要地設立動物空白對照,將使成千上萬的小鼠白白為人類做出犧牲和貢獻,實驗動物作為人類的替難者,這是不人道、不公平的。因此,建議在相關的藥包材標準修訂、更新時考慮舍去異常毒性試驗的空白對照,將對有效地保障和實施實驗動物福利產生積極的影響。

