術中直接電刺激運動誘發電位對腦干運動功能保護作用初探
陶曉蓉 王明然 王榮 李志保 樊星 張力偉 喬慧
腦干占位性病變特別是膠質瘤,由于與鄰近腦組織界限不清,手術切除過程中可能造成腦神經核團和皮質脊髓束(CST)的牽拉損傷,易導致術后新發功能障礙[1]。術中直接電刺激運動誘發電位(DES?MEP)通過直接電刺激中央前回和皮質脊髓束,記錄遠端復合肌肉動作電位(CMAP),以監測運動神經傳導通路功能,用于指導腦功能區腫瘤的切除已成為國內外共識,但仍缺乏術中DES?MEP評估腦干運動功能的研究。首都醫科大學附屬北京天壇醫院神經外科近3年來共收治136例腦干腫瘤患者,通過術中常規電生理監測或常規電生理監測聯合DES?MEP監測,結合運動功能評價對DES?MEP監測技術在腦干腫瘤切除手術中的應用價值進行初步探討。
對象與方法
一、研究對象
1.納入與排除標準 (1)術前經頭部MRI證實為腦干腫瘤且累及皮質脊髓束,行腦干腫瘤切除術。(2)術中行電生理監測。(3)年齡5~ 65 歲。(4)術前四肢Lovett肌力分級≥3級。(5)排除既往有癲病史、顱內植入物等不宜行經顱電刺激患者,以及術前四肢Lovett肌力分級<3級或存在語言障礙無法配合肌力評價的患者。
2.一般資料 選擇2017年1月至2020年5月在我院神經外科行腦干腫瘤切除術的患者共136例,男性72例,女性64例;年齡5~65歲,中位年齡26.50(15.00,38.75)歲;病程1~72 個月,中位病程為3(2,7)個月。術前頭部MRI顯示,腫瘤位于延髓37例(27.21%)、腦橋 58例(42.65%)、中腦 14例(10.29%)、腦橋和延髓21例(15.44%)、中腦和腦橋6例(4.41%);其中手術全切除37例(27.21%)、近全切除74例(54.41%)、部分切除25例(18.38%);術后病理分型為高級別(WHOⅢ~Ⅳ級)膠質瘤62例(45.59%)、低級別(WHOⅠ~Ⅱ級)57例(41.91%),海綿狀血管瘤或其他類型腫瘤17例(12.50%)。根據術中皮質脊髓束監測方法,采用隨機數字表法隨機分為常規電生理監測聯合神經導航技術組(對照組,68例)和常規電生理監測基礎上加用直接電刺激聯合神經導航技術組(聯合監測組,68例)。兩組患者一般資料比較,差異無統計學意義(均P>0.05,表1),均衡可比。
二、研究方法
1.麻醉方案 患者仰臥位,氣管插管全身麻醉。以全憑靜脈麻醉(TIVA)藥物異丙酚2 mg/kg、舒芬太尼0.30 μg/kg和羅庫溴銨0.60 mg/kg作為麻醉誘導,予以瑞芬太尼2 μg/(kg·min)和異丙酚4~6 mg/(kg·h)進行維持,腦電雙頻指數(BIS)45~55。
2.術前MRI檢查 所有患者均于術前行MRI檢查,采用Philips Ingenia CX MRI掃描儀行DTI掃描以重建錐體束三維結構,重復時間(TR)4000 ms、回波時間(TE)88 ms,翻轉角(FA)90°,掃描視野(FOV)218 mm×200 mm,矩 陣 80×85,激 勵 次 數(NEX)1次,b值 1000 s/mm2,層厚 2.50 mm、層間距為零,共60層,掃描時間405.50 s,范圍覆蓋全腦。同時聯合美國Medtronic公司生產的神經導航系統顯示腫瘤與錐體束及其周圍神經纖維的三維解剖關系,通過導航工作站軟件StealthViz version 1.3.0.34將導航掃描序列與DTI序列自動融合,勾畫腫瘤輪廓,重建錐體束。
3.術中誘發電位監測 采用美國Cadwell公司生產的Cascade誘發電位監測儀行術中監測。(1)對照組:行常規誘發電位監測,包括經顱電刺激運動誘發電位(TceMEP)、體感誘發電位(SEP)和腦干聽覺誘發電位(BAEP)。(2)聯合監測組:術中行常規誘發電位與DES?MEP聯合監測。DES?MEP監測的刺激電極為手持單極電刺激器,與導航系統萬能注冊器相連接,以單極刺激器代替導航定位探針作為陰極、單極針電極(置于Fz)作為陽極;采取5~8個串的脈沖刺激,脈沖波寬為200 μs、間隔2 ms,刺激頻率500 Hz、強度為0.50~10 mA,自0.50 mA逐漸增加刺激強度直至引出復合肌肉動作電位,該刺激強度即為刺激閾值,以定位刺激點與腦干和皮質脊髓束的位置關系。記錄電極為皮下針電極,上肢分別置于大魚際肌和小魚際肌、下肢置于展肌;濾波范圍為30~1500 Hz,信號分析時間為100 ms,靈敏度為50 μV至1 mV。

表1 聯合監測組與對照組患者一般資料的比較Table 1. Comparison of general data between combined monitoring group and control group
4.評價指標 (1)運動功能:分別于術前和術后2周,采用Lovett肌力分級標準對患者左側和右側、上肢和下肢肌力進行評價。0級,無可見或僅感覺到肌肉收縮;1級,可觸及輕微肌肉收縮,但無關節活動;2級,可在消除重力的姿勢下做全關節活動范圍的運動;3級,可抗重力做全關節活動范圍的運動,但無法抗阻力;4級,可抗重力和一定的阻力做運動;5級,可抗重力和充分的阻力做運動。除肌力評價,尚須記錄四肢Lovett肌力分級最低值。根據手術前后肌力變化判斷是否存在新發運動障礙,與術前相比,術后2周肌力無下降或下降程度≤1級,則為無嚴重的新發運動障礙;術后2周肌力降低≥2級,為存在嚴重的新發運動障礙。(2)DES?MEP 與運動功能的關系:根據術中DES?MEP監測結果和術后運動功能評價,定義DES?MEP監測結果。真陽性,DES?MEP監測呈陽性且無嚴重的新發運動障礙;假陽性,DES?MEP監測陽性,但存在嚴重的新發運動障礙;真陰性,DES?MEP監測呈陰性,且存在嚴重的新發運動障礙;假陰性,DES?MEP監測呈陰性,但無嚴重的新發運動障礙。(3)DES?MEP預測術后嚴重的新發運動障礙:根據DES?MEP監測結果,計算DES?MEP預測術后嚴重新發運動障礙的靈敏度與特異度、陽性預測值與陰性預測值、準確率。靈敏度=真陽性例數/(真陽性例數+假陰性例數)×100%,特異度=真陰性例數/(假陽性例數+真陰性例數)×100%,陽性預測值=真陽性例數/(真陽性例數+假陽性例數)×100%,陰性預測值=真陰性例數/(假陰性例數+真陰性例數),準確率=(真陽性例數+真陰性例數)/總例數×100%。
5.統計分析方法 采用SPSS 23.0統計軟件進行數據處理與分析。計數資料以相對數構成比(%)或率(%)表示,采用χ2檢驗。呈非正態分布的計量資料以中位數和四分位數間距[M(P25,P75)]表示,采用Mann?WhitneyU檢驗。以P≤0.05為差異具有統計學意義。
結 果
術后2周,對照組46例(67.65%)患者無嚴重新發運動障礙、22例(32.35%)存在嚴重新發運動障礙,聯合監測組57例(83.82%)無嚴重新發運動障礙、11例(16.18%)存在嚴重新發運動障礙,組間差異具有統計學意義(χ2=4.841,P=0.028)。
聯合監測組48例(70.59%)患者于大魚際肌、小魚際肌或展肌記錄到DES?MEP波形,且波形與TceMEP波形相似,呈多相波(圖1);20例(29.41%)未記錄到異常波形。根據術中DES?MEP監測結果和術后運動功能評價,DES?MEP監測真陽性44例、假陽性4例、真陰性7例、假陰性13例,其預測術后嚴重新發運動障礙的靈敏度為77.19%(44/57)、特異度7/11,陽性預測值91.67%(44/48)、陰性預測值35%(7/20),診斷準確率為75%(51/68,表2)。

圖1 女性患者,14歲。間歇性頭痛2年余、加重1個月,臨床診斷為腦干星形細胞瘤,行腦干腫瘤切除術。術中DES?MEP監測分別于左側和右側大魚際肌、小魚際肌和展肌記錄到多相波,術后2周未見嚴重新發運動障礙Figure 1 A 14?year?old female patient with intermittent headache for more than 2 years and aggravating for 1 month,was clinically diagnosed as brainstem astrocytoma,and underwent resection of brainstem tumor.DES?MEP monitoring was performed during the operation.Multiphase waveforms were recorded in the left and right thenar muscles and musculi abductor hallucis respectively.No severe new dyskinesia occurred 2 weeks after operation.
討 論
腦干手術是神經外科最具挑戰性的手術,具有較高的病殘率和病死率。腦干結構復雜,其間穿行運動和感覺傳導通路,腦干手術存在增加術后神經功能缺損的高風險[2]。皮質脊髓束是腦干下行傳導纖維中最大的纖維束,其神經元起源于皮質中央前回及其他區域,下行穿過腦干在延髓形成錐體,并大部分交叉至對側,形成皮質脊髓側束,最后止于脊髓前角;小部分在錐體未交叉的纖維則形成皮質脊髓前束,在脊髓前索下行,同樣止于脊髓前角,其主要功能是支配骨骼肌并控制肢體隨意運動,是術中最需保護的白質纖維束。如何在保護運動功能的前提下實現腫瘤的最大程度切除,仍是神經外科的一大難題[3?4]。目前,神經導航技術已廣泛應用于神經外科手術,基于術前MRI可以準確定位病變,精確實現白質纖維束的可視化,并顯示病變與白質纖維束的解剖關系,從而指導術前制定手術方案、確定手術切口和入路,以及術中避開重要解剖結構,以免造成不必要的手術損傷[5]。但該項監測技術不能實時反映運動功能,因此術中神經電生理監測仍是術中評價運動功能的“金標準”,指導神經外科手術[3,6]。
目前,廣泛應用于腦干腫瘤切除手術中的電生理監測技術主要為腦干聽覺誘發電位、體感誘發電位、TceMEP[7]和腦干神經核團 Mapping技術等的多模態聯合,可以較為全面地反映運動神經核團的分布,以及皮質脊髓束、皮質延髓束等功能狀態,為術者清晰地展示病灶周圍重要神經結構,從而降低手術病殘率。術中多模態神經電生理監測和現代影像學技術的發展及聯合應用,為提高手術療效、減輕術后神經功能缺損提供了有力支撐,但目前監測方法對運動功能的保護仍存不確定性,需進一步研究改進[8]。有文獻報道,腦干聽覺誘發電位聯合體感誘發電位監測腦干功能的陽性率僅為20%[9],盡管TceMEP對評價皮質脊髓束功能狀態和腦干缺血性損傷具有重要意義[10?11],但其主要是通過監測對側肢體復合肌肉動作電位以反映皮質脊髓束完整性,這一神經傳導通路經過多突觸傳遞,極易受麻醉藥物特別是肌松藥的影響,波幅和潛伏期的變異性較大,與運動功能預后之間無線性相關關系[12]。在幕上腫瘤手術過程中,TceMEP的預警標準是復合肌肉動作電位波幅降低50%,而脊髓手術中波幅消失方需術者的高度警惕,由此可見,尚缺乏統一的腦干手術預警標準[13]。同時,TceMEP所誘發的穩定的復合肌肉動作電位所需刺激強度較高,術中易引發患者體動,進而增加手術風險。因此,腦干腫瘤手術亟需一種安全、高效的術中神經電生理監測技術,用于評估和保護患者運動功能,彌補現階段術中神經電生理監測技術在皮質脊髓束功能保護方面的不足。DES?MEP可在降低假陰性率的同時,精準提供與運動傳導束之間距離等信息,對于確定病灶切除范圍具有重要意義,是一種比TceMEP更加安全、有效的保護運動功能的監測技術。本研究結果顯示,聯合監測組患者術后2周出現嚴重新發運動障礙(Lovett肌力分級降低≥2級)的比例為16.17%(11/68),低于常規電生理監測組的32.35%(22/68),結果表明術中常規電生理監測聯合DES?MEP監測可以有效降低術后嚴重新發運動障礙的發生。
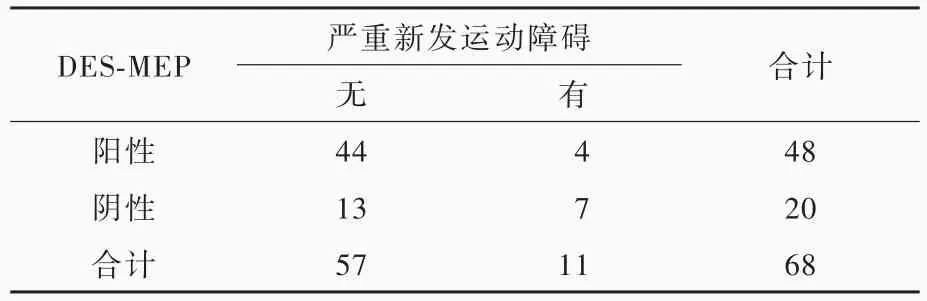
表2 DES?MEP監測結果預測術后嚴重新發運動障礙的靈敏度和特異度分析(例)Table 2. Sensitivity and specificity ofDES?MEP monitoring results in predicting postoperative severe new dyskinesia(case)
本研究聯合監測組有48例(70.59%)患者于大魚際肌、小魚際肌和展肌記錄到DES?MEP波形,其中44例術后2周未出現嚴重的新發運動障礙,DES?MEP監測陽性預測值為91.67%(44/48),提示術中DES?MEP監測呈陽性對術后運動功能有較好的預測價值;其余4例術后發生嚴重的新發運動障礙,推測可能是由于刺激位點鄰近皮質脊髓束。Prabhu等[14]發現,刺激電極距離皮質脊髓束<5 mm時,可加重神經功能障礙。Cedzich等[15]于顳葉致灶切除術后首次以2~10 mA的單極電刺激直接刺激腦干誘發出運動誘發電位,因此認為,DES?MEP誘發腦干運動誘發電位的刺激強度(2~10 mA)低于皮質運動誘發電位(5~18 mA),推測可能與腦干運動傳導神經更加局限有關。本研究是否存在因刺激位點距離皮質脊髓束過近或刺激強度過大而引發運動功能缺失的現象?尚待進一步研究加以驗證。本研究聯合監測組有20例(29.41%)患者未記錄到DES?MEP波形,其中13例術后2周未出現嚴重的新發運動障礙,推測可能是由于刺激位點距離皮質脊髓束較遠[1],未損傷運動功能;其余7例術后發生嚴重的新發運動障礙,DES?MEP監測的陰性預測值為35%(7/20)。本研究結果提示,DES?MEP監測的陽性結果對術后運動功能的預測價值高于陰性結果。
DES?MEP刺激強度是否與刺激部位和傳導束之間的距離存在線性相關關系,尚存爭議,主要是由于不同研究之間測量方法和統計分析方法不盡相同[16],這也是本研究的局限性,今后尚待對腦干DES?MEP的最佳刺激模式進行深入研究。
綜上所述,腦干腫瘤手術中聯合應用常規電生理監測和DES?MEP監測,可以實現對腦干運動功能的保護,彌補現階段術中神經電生理監測技術在皮質脊髓束功能保護方面的不足。
利益沖突 無

